Poloni
| Poloni, 84Po | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên, ký hiệu | Poloni, Po | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phiên âm | Pô-lô-ni | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poloni trong bảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử (Z) | 84 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn (Ar) | 209 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | á kim | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm, phân lớp | 16, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | [Xe] 6s2 4f14 5d10 6p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2, 8, 18, 32, 18, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Bạc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Chất rắn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ nóng chảy | 527 K (254 °C, 489 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ sôi | 1235 K (962 °C, 1764 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | (alpha) 9,196 g·cm−3 (ở 0 °C, 101.325 kPa) (beta) 9,398 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt lượng nóng chảy | 13 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt bay hơi | 102,91 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | 26,4 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Áp suất hơi
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | 6, 4, 2, -2 Lưỡng tính | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 2,0 (Thang Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 812,1 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính cộng hoá trị | thực nghiệm: 168 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 140±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính van der Waals | 197 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu trúc tinh thể | Lập phương | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ giãn nở nhiệt | 23,5 µm·m−1·K−1 (ở 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | ? 20 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điện trở suất | ở 0 °C: (α) 0,40 µ Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Không từ tính | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7440-08-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính: Đồng vị của Poloni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Poloni là nguyên tố hóa học với ký hiệu hóa học là Po và số nguyên tử 84. Polonium nằm trong nhóm 16, chu kì 6. Một kim loại phóng xạ hiếm và không có đồng vị bền , poloni về mặt hóa học tương tự như selen và tellur, mặc dù đặc tính kim loại của nó tương tự thalli, chì và bismuth. Do chu kỳ bán rã ngắn của tất cả các đồng vị của nó, sự xuất hiện tự nhiên của nó chỉ giới hạn ở những vết nhỏ của polonium-210 (với chu kỳ bán rã 138 ngày) trong quặng urani , vì nó có mặt trong chuỗi phân rã phóng xạ của urani-238 và chuỗi phân rã của radi-226 . Mặc dù các đồng vị tồn tại lâu hơn một chút, chúng khó sản xuất hơn nhiều. Ngày nay, polonium thường được tạo ra với số lượng miligam bằng cách chiếu xạ neutron vào bismuth. Do tính phóng xạ mạnh của nó, dẫn đến sự phân giải phóng xạ của các liên kết hóa học và sự tự đốt nóng phóng xạ, hóa học của nó hầu như chỉ được khảo sát trên quy mô vết.
Một vài số liệu
[sửa | sửa mã nguồn]- Nhiệt độ nóng chảy: 254 °C
- Nhiệt độ sôi: 962 °C
- Năng lượng liên kết phân tử: 812,1 kJ/mol
Nguồn gốc tên gọi
[sửa | sửa mã nguồn]Poloni là nguyên tố phóng xạ được hai vợ chồng nhà hoá học Marie Curie và Pierre Curie phát hiện cùng với nguyên tố phóng xạ khác là radi ở trong quặng urani vào năm 1898. Nguyên tố được đặt tên là poloni để ghi nhớ tổ quốc của bà Marie (polinia trong tiếng Latinh là Ba Lan). Bà muốn cho quốc gia này được thế giới chú ý đến vì đang bị cả Nga, Phổ và Áo cai trị thời bấy giờ.
Ứng dụng-Điều chế
[sửa | sửa mã nguồn]Đồng vị Po210 được dùng để làm nguồn hạt alpha. Có thể điều chế trong lò phản ứng nguyên tử (với lượng mg hoặc g) khi bắn chùm neutron vào bismuth.
Tính chất
[sửa | sửa mã nguồn]Poloni thể hiện rõ nhất tính kim loại trong nhóm VIA, vì thế nó tác dụng được với axit.
Đồng vị
[sửa | sửa mã nguồn]Poloni có 33 đồng vị, tất cả chúng đều là đồng vị phóng xạ. Chúng có khối lượng nguyên tử từ 188 đến 220 u.210Po (chu kỳ bán rã 138,4 ngày) là đồng vị phổ biến nhất.209Po (chu kỳ bán rã 103 năm) và 208Po (chu kỳ bán rã 2,9 năm) có thể tạo ra từ việc bắn phá hạt alpha, proton hoặc deuteron đối với chì hoặc bismut trong máy gia tốc.
210Po phát ra tia alpha có chu kỳ bán rã 138,4 ngày tạo ra đồng vị con bền nhất là 206Pb. 1 mg210Po phát ra các hạt alpha/1 giây bằng với lượng hạt alpha phát ra từ 4.5 gram 226Ra. Một ít curie (1 curie tương đương 37 gigabecquerels, 1 Ci = 37 GBq) của 210Po phát ra ánh sáng màu xanh do chúng làm kích thích không khí xung quanh. Một gram 210Po sinh ra 140 W năng lượng.[2][3][4] Do nó phát ra nhiều hạt alpha, loại hạt bị ngăn chặn trong một khoảng cách rất ngắn trong môi trường đặc và giải phóng năng lượng, 210Po đã được sử dụng như nguồn nhiệt nhỏ để phát điện cho tế bào nhiệt điện trong các vệ tinh nhân tạo.[5]
Trạng thái rắn
[sửa | sửa mã nguồn]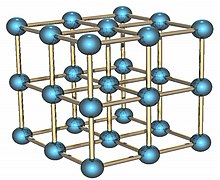
Poloni là nguyên tố phóng xạ có hai đồng phân kim loại. Đồng phân anpha là một ví dụ duy nhất được biết đến ở dạng cấu trúc tinh thể lập phương đơn giản trong một nguyên tử đơn, với cạnh dài 335,2 picometer; dạng beta có cấu trúc trực thoi.[6][7][8] Cấu trúc của poloni được đặc trưng hóa bởi nhiễu xạ tia X[9][10] và nhiễu xạ electron.[11]
210Po (là dạng phổ biến như 238Pu) có khả năng hóa hơi để trở thành dạng khí dễ dàng: nếu một mẫu poloni dạng này được nung trong không khí đến 55 °C (131 °F), 50% của nó hóa hơi trong 45 giờ để tạo thành phân tử Po2, mặc dù điểm nóng chảy của nó là 254 °C (489 °F) và điểm sôi là 962 °C (1.764 °F).[12][13]
Tác động sinh học - Độc tính
[sửa | sửa mã nguồn]Polonium rất nguy hiểm và không có vai trò y sinh học. Một đồng vị của nguyên tố Polonium, Polonium-210 là một chất cực độc, chỉ cần một lượng rất nhỏ cũng đủ để gây chết người. Polonium-210 gây chết người bởi nó phóng ra hạt alpha với năng lượng đủ để phá hủy cấu trúc gen của tế bào. Polonium -210 không được dùng cho phóng xạ y học như các đồng vị caesium-137 hoặc cobalt-60.
Phơi nhiễm Polonium-210
[sửa | sửa mã nguồn]Nạn nhân đầu tiên của chất phóng xạ Polonium chính là con gái của Marie Curie, Irene Joliot Curie. Cô Irene đã qua đời 10 năm sau khi xảy ra một tai nạn trong phòng thí nghiệm do chứng leukemia. Hiện nay, mức sản xuất Polonium trên thế giới chỉ vào khoảng 100 gram với mục đích ứng dụng vào việc khử bụi trong các kính hiển vi điện tử và trong các cân tiểu li siêu chính xác.
Đứng về phương diện độc tố học, chất phóng xạ tạo ra những nguyên tử có khả năng ức chế tế bào của cơ thể con người, điện hoá các tế bào trên và sau cùng tiêu huỷ chúng. Đối với việc tiếp nhiễm do phóng xạ thiên nhiên ở nồng độ thấp, các tế bào bị điện hoá được cơ thể tái tạo lại sau đó, do đó nguy cơ bị ngộ độc không xảy ra.
Tuy nhiên, khi cơ thể tiếp nhiễm một số lượng lớn phóng xạ như trường hợp của Litvinenko, cơ thể không thể tự hàn gắn và trấn áp cùng thay thế các tế bào đã bị huỷ diệt, từ đó nguy cơ tử vong rất cao. Các loại tế bào trong cơ thể bị ảnh hưởng trực tiếp và bị nhiễm độc là bạch cầu và tế bào sinh sản hồng cầu.
Sự thiếu hụt tế bào trong cơ thể là dấu hiệu đầu tiên của sự phơi nhiễm phóng xạ; sau đó, tế bào ruột non bị xâm nhập tạo ra sự nôn mửa kéo theo cơ thể bắt đầu bị mất nước.
Thời gian sau đó, tuỳ theo mức độ phơi nhiễm và loại phóng xạ (có chu kì bán rã khác nhau), phóng xạ bắt đầu tàn phá các mô cứng và mềm qua các triệu chứng như:
- Nhức đầu
- Hơi thở dồn dập
- Tim đập nhanh
- Ho khan (không có đàm)
- Lồng ngực bị đau từng cơn
- Da chuyển sang màu sậm
- Ở phần dưới da và bất cứ nơi nào trong cơ thể đều xuất hiện những hạt máu nhỏ do các tĩnh mạch bị vỡ ra
- Xuất hiện chứng thiếu máu trầm trọng
Nghiêm trọng hơn, nếu bị phơi nhiễm khoảng 10 Gray (Gy- đơn vị phóng xạ), nạn nhân có thể tử vong trong vòng hai đến bốn tuần. Cường độ của mức phóng xạ phơi nhiễm cho phép chúng ta có thể ước tính được mức nguy hại đến nạn nhân như sau: - Nếu cơ thể bị phơi nhiễm 100 Roentgen, các triệu chứng do phơi nhiễm phóng xạ bắt đầu xuất hiện. - Nếu cơ thể bị phơi nhiễm khoảng 400 Roentgen, nửa phần cơ thể có thể bị liệt - Nếu cơ thể bị phơi nhiễm khoảng 100.000 Roentgen, nạn nhân bị hôn mê tức khắc và chết trong vòng một tiếng đồng hồ.
Đơn vị đo lường phóng xạ gồm:
- Roentgen: lượng phóng xạ phóng thích do tia gamma trong 1 cm³ không khí, ký hiệu là R
- Rad: lượng phóng xạ phơi nhiễm, là đơn vị dùng để ước tính lượng phóng xạ có trong cơ thể
- Gray: Ký hiệu là Gy, là đơn vị chuẩn quốc tế (SI) tương đương với 100 Rad
Cơ chế của sự phơi nhiễm Polonium-210
[sửa | sửa mã nguồn]Qua trường hợp của Litvinenko, ảnh hưởng sinh hoá học lên cơ thể của các đồng vị phóng xạ được soi rọi rõ ràng hơn vì trước đây, việc phơi nhiễm phóng xạ với liều lượng cao chỉ được diễn đạt qua tính toán và ước tính.
Polonium-210 là hoá chất đã từng được dùng để chế bom nguyên tử phân hạch(fission) các tia alpha. Những tia này có chu kì bán rã (half life) là 138 ngày. Nguyên tố Polomium-210 sau khi tách rời tất cả tia alpha, sẽ biến thành nguyên tố chì bền vững (Lead-206) và nhân Helium cùng phóng thích ra 5,3 MeV năng lượng.
Tia alpha rất dễ dàng bị ngăn chặn bởi một mảnh giấy mỏng, do đó Polonium-210 chỉ độc hại một khi đã xâm nhập vào bên trong cơ thể qua đường hô hấp hoặc do nuốt phải
Nếu Litvinenko uống vào 1 ug Po-210 dưới dạng muối citrate hay chloride (đã được các nhà khoa học phỏng đoán), thì có khoảng 3.1015 (3 ngàn ức) đồng vị phóng xạ đã vào cơ thể ông ta, một lượng đồng vị đủ để cho hàng trăm đồng vị kết hợp với mỗi tế bào của cơ thể. Ở mỗi điểm đến của tia alpha, chúng để lại một số năng lượng lớn trong một vùng nhỏ của tế bào, căn cứ vào kết quả nghiên cứu của GS Roger Howell thuộc Đại học Y khoa. Mỗi tia alpha sẽ ngăn cách tế bào tạo thành một chuỗi gốc (radical) lần lần thiêu huỷ protein của cơ thể cũng như gây thương tổn đến các chuỗi DNA.
Litvinenko qua đời sau 22 ngày bị đầu độc, theo TS Wiley Jr. thuộc Radiation Emergency Assistance Center, Tennessee, có lẽ đến từ nguyên do là các tia alpha đã phá huỷ các tế bào gốc trong tuỷ xương. Hiện tượng này làm mất sự cân bằng của số lượng hồng cầu và ảnh hưởng đến các tế bào trong hệ miễn dịch của cơ thể.
Phương pháp chữa trị
[sửa | sửa mã nguồn]Trong giai đoạn đầu sau khi bị phơi nhiễm, thuốc chống nôn mửa và các loại thuốc giảm đau có thể được sử dụng để chống lại các dấu hiệu ban đầu qua ảnh hưởng của phóng xạ. Còn các ảnh hưởng tiếp theo, cần phải có thuốc kháng sinh mạnh trong việc trị liệu. Và nạn nhân cần phải được truyền máu để chống lại bệnh thiếu máu (anemia).
Thông thường trong những tai nạn về phóng xạ, như trường hợp ở Liên bang Nga cách đây hơn 20 năm, ảnh hưởng của phóng xạ vẫn còn tiếp tục, và các chứng bệnh kể trên vẫn còn hiện diện. Các cơ quan trong cơ thể bị ảnh hưởng dài hạn như các tuyến nội tiết (endocrine) và tuyến hormone bài tiết (hormone secreting).
Tại Chernobyl, số lượng nạn nhân bị ung thư tuyến giáp trạng (thyroid) ở Belarus, quốc gia bị ảnh hưởng nặng nhất, tăng gấp 100 lần 20 năm sau khi tai nạn xảy ra.
Về các bệnh liên quan đến thần kinh, theo kết quả UNICEF công bố là bệnh rối loạn (disorder) về xương, bắp thịt tăng 43%, về mắt tăng 62%. Đặc biệt trong trường hợp tai nạn Chernobyl, TS George Vargo, thuộc Chương trình An toàn Hạch nhân Quốc tế (INSP) thuộc LHQ đã ra một khuyến cáo là hiện tượng suy dinh dưỡng và việc không đủ phương tiện y khoa để chữa trị như trường hợp ở Belarus cũng có thể là nguyên nhân của sự gia tăng số lượng nạn nhân, ngoài ảnh hưởng chính là do phơi nhiễm phóng xạ.
Riêng về ảnh hưởng đến các thế hệ về sau, hiện tại, các khoa học gia vẫn còn đang tranh cãi về ảnh hưởng của phóng xạ lên hệ thống di truyền vì DNA của người bị phơi nhiễm bị biến đổi và chuyển qua các thế hệ tiếp nối. Điều này đã được chứng minh, nhưng vẫn chưa có báo cáo khoa học nào về vấn đề này đối với nạn nhân ở và trong thời Thế Chiến thứ Hai.
Tham khảo
[sửa | sửa mã nguồn]- Hoá học vô cơ, tập 2, Hoàng Nhâm
Ghi chú
[sửa | sửa mã nguồn]- ^ Boutin, Chad. “Polonium's Most Stable Isotope Gets Revised Half-Life Measurement”. nist.gov. NIST Tech Beat. Truy cập ngày 9 tháng 9 năm 2014.
- ^ “Polonium” (PDF). Argonne National Laboratory. Bản gốc (PDF) lưu trữ ngày 3 tháng 7 năm 2007. Truy cập ngày 5 tháng 5 năm 2009.
- ^ Emsley, John (2001). Nature's Building Blocks. New York: Oxford University Press. tr. 330–332. ISBN 0-19-850341-5.
- ^ Greenwood, p. 251
- ^ Andrew Wilson (1987). Solar System Log. Luân Đôn: Jane's Publishing Company Ltd. tr. 64. ISBN 0710604440.
- ^ Greenwood, p. 753
- ^ Miessler, Gary L.; Tarr, Donald A. (2004). Inorganic Chemistry (ấn bản thứ 3). Upper Saddle River, N.J.: Pearson Prentice Hall. tr. 285. ISBN 0-13-120198-0.
- ^ “The beta Po (A_i) Structure”. Naval Research Laboratory. ngày 20 tháng 11 năm 2000. Bản gốc lưu trữ ngày 4 tháng 2 năm 2001. Truy cập ngày 5 tháng 5 năm 2009.
- ^ Desando, R. J.; Lange, R. C. (1966). “The structures of polonium and its compounds—I α and β polonium metal”. Journal of Inorganic and Nuclear Chemistry. 28 (9): 1837–1846. doi:10.1016/0022-1902(66)80270-1.
- ^ Beamer, W. H.; Maxwell, C. R. (1946). “The Crystal Structure of Polonium”. Journal of Chemical Physics. 14 (9): 569. doi:10.1063/1.1724201.
- ^ Rollier, M. A.; Hendricks, S. B.; Maxwell, L. R. (1936). “The Crystal Structure of Polonium by Electron Diffraction”. Journal of Chemical Physics. 4 (10): 648. Bibcode:1936JChPh...4..648R. doi:10.1063/1.1749762.
- ^ Wąs, Bogdan; Misiak, Ryszard; Bartyzel, Mirosław; Petelenz, Barbara (2006). “Thermochromatographic Separation of 206,208Po from a Bismuth Target Bombardet with Protons” (PDF). Nukleonica. 51 (Suppl. 2): s3–s5.
- ^ Lide, D. R. biên tập (2005). CRC Handbook of Chemistry and Physics (ấn bản thứ 86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
Liên kết ngoài
[sửa | sửa mã nguồn]- Poloni tại Từ điển bách khoa Việt Nam
- Polonium tại Encyclopædia Britannica (tiếng Anh)
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Polonium
- Polonium at The Periodic Table of Videos (University of Nottingham)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |


