வேதி வினை

வேதி வினை (Chemical reaction) என்பது வேதிப்பொருட்களின் ஒரு தொகுதி வேறு வேதிபொருட்களின் தொகுதியாக மாற்றம் அடையும் செயல்முறை வேதிவினை எனப்படும் [1]. அணுக்களுக்கு இடையில் வேதிப்பிணைப்புகள் உடையும் போதும், உருவாகும் போதும் எலக்ட்ரான்கள் தங்கள் இருப்பிடத்தை மாற்றிக் கொள்ளும் செயல் வேதிவினையில் உள்ளடங்குகிறது. இத்தகைய இடமற்றத்தின் போது அணுவின் உட்கருவில் எந்த மாற்றமும் ஏற்படுவதில்லை. வினையில் ஈடுபடும் தனிமங்களிலும் எந்தவிதமான மாற்றமும் நிகழ்வதில்லை. இச்செயல்முறை பெரும்பாலும் வேதிச்சமன்பாட்டின் மூலம் விவரிக்கப்படுகிறது. நிலையற்ற மற்றும் கதிரியக்கத் தனிமங்களின் வேதிவினையில் எங்கெல்லாம் மின்னணு மற்றும் அணுக்கரு மாற்றங்கள் இரண்டும் நிகழ்கிறதோ, அத்தகைய வினைகளை உள்ளடக்கிய வேதியியல் துணைப்பிரிவு அணுக்கரு வேதியியல் எனப்படுகிறது.
வேதிவினையில் தொடக்கத்தில் ஈடுபடும் பொருள்கள் வினைபடு பொருள்கள் எனப்படுகின்றன. வேதிவினைகள் அனைத்திலும் ஒரு வேதிமாற்றம் நிகழ்தல் ஓர் அடையாளமாகக் கருதப்படுகிறது. இம்மாற்றம் வேதி வினையின் முடிவில் ஒன்று அல்லது அதற்கு மேற்பட்ட புதிய பொருட்கள் விளைகின்றன. இவை வினைபடு பொருட்களின் பண்புகளிலிருந்து வேறுபடுகின்றன. ஒரேபடிநிலையில் வினைபடு பொருட்கள் வினையில் ஈடுபட்டு இடைநிலை விளைபொருட்கள் எதையும் உருவாக்காமல் நேரடியாக வினைவிளை பொருட்களைக் கொடுத்தால் அவ்வினைகள் தொடக்க வினைகள் எனப்படும். சில வினைகள் இத்தகைய தொடக்க வினைகளுடன் தொடர்ச்சியாக மேலும் சில துணை-படிநிலைகளிலும் நிகழ்கின்றன. தொடக்க வினையில் தொடங்கி இறுதி வினைவிளை பொருள் உருவாகும் வரையிலான வினை நடவடிக்கைகளை துல்லியமாகக் கூறுதல் வினைவழிமுறை எனப்படுகிறது. வேதிவினைகள் வேதிச் சமன்பாடுகளால் விவரிக்கப்படுகின்றன, இச்சமன்பாடுகளில் வினைபடு பொருட்கள், வினை விளைபொருட்கள், சிலசமயங்களில் இடைநிலைப் பொருட்கள் மற்றும் வினைக்கான நிபந்தனைகள் முதலானவை இடம்பெறுகின்றன.
கொடுக்கப்படும் வெப்பநிலை, அடர்த்தி ஆகியனவற்றுக்கு ஏற்ப வேதிவினைகளின் வினைவேகம் அடையாளப்படுத்தப்படுகிறது. குறிப்பாக வெப்பநிலை அதிகரிக்க அதிகரிக்க வினைவேகம் அதிகரிக்கிறது. ஏனெனில் அணுக்களுக்கு இடையில் இருக்கும் பிணைப்புகளை உடைப்பதற்குத் தேவையான வினையூக்க ஆற்றலைப் பெற அதிக அளவு வெப்ப ஆற்றல் அவசியமாகும்.
வேதிச்சமநிலையை அடையும் வரை அல்லது வினை நிறைவடையும் வரை வேதிவினைகள் முன்னோக்கியோ அல்லது பின்னோக்கியோ நிகழ்கின்றன. சமநிலையை அணுகுவதற்காக முன்னோக்கு திசையில் நிகழும் வினைகள் பெரும்பாலும் தன்னிச்சையான வினைகள் என விவரிக்கப்படுகின்றன, இவ்வினைகள் முன்னோக்கிச் செல்ல கட்டற்ற ஆற்றல் எதுவும் உள்ளிடத் தேவையில்லை. தன்னிச்சையற்ற வேதி வினைகள் முன்னோக்கி நிகழ ஆற்றலை உள்ளிட வேண்டியது அவசியமாகும். மின்கலனுக்கு மின்னேற்ற அதையொரு மின் ஆற்றல் மூலத்துடன் இணைப்பது அல்லது ஒளிச்சேர்க்கை மூலம் மின்காந்த கதிரியக்கத்தை சூரிய ஒளி வடிவில் ஈர்த்துக் கொள்வதும் உதாரணமாகும்.
தேவையான ஒரு குறிப்பிட்ட பொருளை தயாரிப்பதற்காக மேற்கொள்ளப்படும் வேதித் தொகுப்பு வினைகளில் பல்வேறுவகையான வேதிவினைகளை ஒன்றாக இணைத்தும் தொகுக்கப்படுகின்றன. உயிர்வேதியியல் தொகுப்பு வினைகளில் ஒரு வினையின் விளைபொருள் அடுத்தவினையின் வினைபடு பொருளாகச் செயல்படும்படியாக வளர்சிதைமாற்ற வழிமுறைகள் உதவுகின்றன. புரத நொதிகள் இவ்வினைகளை ஊக்குவித்து வினைவேகத்தை அதிகரிக்கின்றன. எனவே சாதாரண நிபந்தனைகளில் வளர்சிதைமாற்ற தொகுப்பு வினைகளுக்கு சாத்தியம் இருப்பதில்லை. செல்லினுள் உள்ள வெப்பநிலை மற்றும் அடர்த்தியினால் மட்டுமே இத்தொகுப்பு வினைகள் தோன்றுகின்றன.
அணுக்களை விட சிறியதாக இருக்கும் கூறுகளுக்கிடையிலான அணுக்கரு வினைகள், கதிரியக்கச் சிதைவுகள், மற்றும் குவாண்டம் புலக்கோட்பாடு மூலம் விவரிக்கப்படும் அடிப்படைத் துகள்களுக்கிடையில் நடைபெறும் வினைகள் போன்றவற்றையும் வேதி வினைகள் என்றே குறிப்பிடுகின்றனர்.
வரலாறு
[தொகு]
நெருப்பில் எரிதல், நொதித்தல் மற்றும் தாதுக்களை உலோகங்களாகக் குறைத்தல் போன்ற இரசாயன வினைகள் பழங்காலத்தில் இருந்தே அறியப்பட்டன. பொருட்களின் உருமாற்றம் பற்றிய தொடக்கநிலைக் கோட்பாடுகள் கிரேக்க தத்துவவாதிகளால் உருவாக்கப்பட்டன, அனைத்துப் பொருட்களும் தீ, நீர், காற்று மற்றும் மண் ஆகிய நான்கு கூறுகளால் ஆனவை என்று சாக்ரடீசுக்கு முற்பட்ட தத்துவ அறிஞரான எம்பெடோக்களசு என்பவர் தன்னுடைய நான்கு-உறுப்புக் கோட்பாட்டின் மூலம் விளக்கினார். இடைக்காலத்தில் இரசவாதிகள் வேதி மாற்றங்களைப் பற்றி ஆய்வு செய்தனர். குறிப்பாக அவர்கள் ஈயத்தை தங்கமாக மாற்றுவதற்கான முயற்சிகளில் ஈடுபட்டனர். இதற்காக கந்தகத்துடன் ஈயம், செப்பு உலோகக் கலவைகளை பயன்படுத்தி வினைகளை உருவாக்கி ஆய்வு மேற்கொண்டனர் [2].
கந்தக மற்றும் நைட்ரிக் அமிலங்களின் தொகுப்பு போன்ற பொதுவாக இயற்கையில் தோன்றாத இரசாயன பொருட்களை உற்பத்தி செய்ய நீண்டகாலமாக முயற்சிகள் மேற்கொள்ளப்பட்டன. சர்ச்சைக்குரிய இரசவாதியான யபீர் இபின் அய்யான் இம்முயற்சிகளை மேற்கொண்டதாக அறியப்படுகிறது. சல்பேட்டு மற்றும் நைட்ரேட்டு கனிமங்களான தாமிர சல்பேட்டு, படிகாரம், பொட்டாசியம் நைட்ரேட்டு போன்றவற்றை சூடாக்குவது இச்செயல்முறையில் அடங்கும். 17 ஆம் நூற்றாண்டில் யோகான் ருடால்பு கிளௌபர் சோடியம் குளோரைடையும் கந்தக அமிலத்தையும் வினைபுரியச் செய்து ஐதரோகுளோரிக் அமிலத்தையும் சோடியம் சல்பேட்டையும் தயாரித்தார். 1746 இல் காரீய கோபுரச் செயல்முறையும், லெப்லாங்கு முறையும் மேம்பாடு அடைந்தவுடன் பெருமளவில் முறையே கந்தக அமிலமும், சோடியம் கார்பனேட்டும் தயாரிக்கப்பட்டன. இரசாயன வினைகள் தொழிற்துறையில் படிப்படியாக நடைமுறைக்கு கொண்டுவரப்பட்டன. கந்தக அமிலத் தயாரித்தல் தொழில்நுட்பம் மேலும் ஏற்புடையதாக மாறியதால் 1880 களில் தொடுகைச் செயல்முறை தோன்றியது [3]. 1909-1910 களில் அமோனியா தயாரிக்க உதவும் ஏபர் செயல்முறையும் வளர்ச்சியடைந்தது [4].
16 ஆம் நூற்றாண்டு முதல் யான் பாப்டிசுட் வேன் எல்ல்மோண்ட், ராபர்ட் பாயல் மற்றும் ஐசக் நியூட்டன் உள்ளிட்ட ஆய்வாளர்கள், சோதனைக்குட்படுத்தப்பட்ட வேதியியல் மாற்றங்களின் கோட்பாடுகளை நிறுவ முயன்றனர். புளோக்கிசுட்டன் கோட்பாடு 1667 ஆம் ஆண்டில் யோகான் யோயாச்சிம் பெச்சரால் முன்மொழியப்பட்டது. புளோக்கிசுடன் என்றழைக்கப்படும் நெருப்பு-போன்ற உறுப்பு எரியத்தக்க பொருட்களில் அடங்கியிருக்கிறது. அது எரியும்போது வெளியிடப்படுகிறது என்பதை அக்கோட்பாடு முன்மொழிந்தது. இது 1785 ஆம் ஆண்டில் அந்துவான் லவாய்சியரால் தவறு என நிருபிக்கப்பட்டது, காற்றில் இருந்து கிடைக்கும் ஆக்சிசனுடன் எரிபொருள் வினைபுரிவதே எரிதல் என்று சரியான விளக்கத்தை கண்டுபிடித்தார் [5]. யோசப் இலூயிசு கே லூசக் 1808 இல் வாயுக்கள் ஒன்றுடன் ஒன்று வினைபுரியும் போதெல்லாம் அவற்றுக்கிடையே ஒரு குறிப்பிட்ட வகையான தொடர்புகள் இருப்பதைக் கண்டறிந்தார். இதனடைப்படையில் யான் டால்டன் அணுக்கொள்கையையும், யோசப் பிரௌசுட்டு அறுதி விகிதசம விதியையும் உருவாக்கினர். பின்னர் இதுவே விகிதவியல் அளவுகளுக்கும் வேதிச்சமன்பாடுகளுக்கும் வழி வகுத்தது [6].
கரிம வேதியியலைப் பொறுத்தவரை, உயிரினங்களில் இருந்து பெறப்பட்ட சேர்மங்களை செயற்கை முறையில் தயாரிப்பது மிகவும் சிக்கலானதாக இருக்கும் என்று நீண்ட காலமாக நம்பப்பட்டது. உயிர்வாழ்தல் என்ற கோட்பாட்டின்படி கரிமப் பொருட்கள் அனைத்தும் உயிர் விசை எனப்படும் சக்தியால் ஆக்கப்பட்டு கனிம மூலங்களிலிருந்து வேறுபடுத்தப்படுகின்றன. 1828 ஆம் ஆண்டில் பிரடெரிக் வோலார் யூரியாவைத் தயாரித்ததன் மூலம் இந்த பிரிவும் முடிவடைந்தது. ஈதர்களை தொகுத்த அலெக்சாண்டர் வில்லியம் வில்லியாம்சன், பல கண்டுபிடிப்புகளை நிகழ்த்திய கிறிசுடோபர் கெல்க் இங்கோல்ட முதலானோர் கரிம வேதியியலுக்கு முக்கிய பங்களிப்புகளை வழங்கிய பிற வேதியியலாளர்கள் ஆவர். பதிலீட்டு வினைகளுக்கான வினைவழிமுறைகளும் இக்காலத்தில் நிறுவப்பட்டன.
சமன்பாடுகள்
[தொகு]
4 + 2 O
2 → CO
2 + 2 H
2O, என்ற சமன்பாட்டில் வினைபடு பொருட்கள் பகுதியிலுள்ள ஆக்சிசனுக்கு முன்னாலும், தண்ணீர் மூலக்கூறுக்கு முன்பாகவும் 2 என்ற எண் குணகம் கண்டிப்பாக இடப்படவேண்டும். இதனால் விளைபொருட்கள் பகுதியிலுள்ள ஆக்சிசன் அணுக்களின் எண்ணிக்கை சமனடைகிறது. வினையில் ஈடுபடும் பொருட்களின் எண்ணிக்கை விளைபொருட்களின் எண்னிக்கைக்கு சமமாக இருக்க வேண்டும் என்பது நிறை அழிவின்மை விதியாகும்.
வேதியியற் சமன்பாடுகள் வேதியியல் வினைகளை ஒரு வரைபடம் போலத் தெளிவாக எடுத்துக் காட்டுகின்றன. வேதி வாய்ப்பாடு அல்லது வேதிக் கட்டமைப்பு மூலம் வினைபடும் பொருட்கள் இடது புறத்திலும், வினை விளை பொருட்கள் வலது புறத்திலும் காட்டப்படுகின்றன[7]. இவை இரண்டையும் ஒரு முன்னோக்கு அம்புக்குறி (→) பிரிக்கிறது. கொடுக்கிறது என்ற பொருளுடன் இந்த அம்புக்குறி வினையின் திசையையும் வகையையும் காட்டுகிறது[8]. அம்புக்குறியின் முனை எந்த திசையில் வினை நிகழ்கிறது என்பதைச் சுட்டிக் காட்டுகிறது. எதிரெதிர் திசைகளைச் சுட்டும் இரட்டை அம்புக்குறி (⇌) சமநிலை வினைகளைச் சுட்டிக் காட்ட பயன்படுகிறது. சமன்பாட்டின் இடதுபுறத்தில் வினையில் ஈடுபடும் ஒவ்வொரு இனத்தின் அணுக்களின் எண்ணிக்கையும், வலப்புறத்தில் வினையில் விளையும் பொருட்களிலும் அதற்குச் சமமானதாய் இருக்கவேண்டும் என்பது விகிதவியல் விதியாகும். வினையில் பங்கேற்கும் மூலக்கூறுகளின் முன்பு எண்ணிடுதல் மூலமாக ஒரு சமன்பாட்டைச் சமப்படுத்தமுடியும். ( மற்றும் என்பவை ஓர் உதாரணச் சமன்பாட்டுத் திட்டத்தில் கீழே தரப்பட்டுள்ளன. அவை தோராயமான முழு எண்களால் a, b, c மற்றும் d. சமப்படுத்தப்பட்டுள்ளன [9]
மேலும் விரிவான வினைகளை இதுபோன்ற வினைத்திட்டங்களில் பிரதியிட்டுக் காட்டமுடியும். வினைபடு பொருட்கள் மற்றும் வினை விளைபொருட்களைத் தாண்டி கூடுதலாக வினை இடைநிலைப் பொருட்களையும் குறித்துக் காட்டவியலும். இவைதவிர இடையிலுள்ள அம்புக்குறிக்கு மேலாக வினையூக்கி, வெப்பம், தண்ணீர், ஒளியூட்டல் போன்ற சில சிறுசிறு நிபந்தனைகளையும் எழுதிக் காட்டலாம்.அம்புக்குகுறிக்கு கீழாக வினையில் நீக்கப்படும் சிறுபான்மை விளைபொருட்கள் எதிர்குறியான கழித்தல் குறியிட்டும் காட்டப்படுகின்றன.

பின்னோக்கு பகுப்பாய்வை சிக்கலான தொகுப்பு வினையை வடிவமைக்க பயன்படுத்த முடியும். இங்கே விளைபொருட்களிலிருந்து பகுப்பாய்வு தொடங்குகிறது, உதாரணமாக தேர்ந்தெடுக்கப்பட்ட வேதிப்பிணைப்புகளை பிரிப்பதன் மூலமாக நம்பத்தகுந்த தொடக்க வினைப்பொருட்களை அறியலாம். இவ்வகை வினைகளில் சிறப்பு அம்புக்குறி (⇒) பயன்படுத்தப்படுகிறது [10].
அடிப்படை வினைகள்
[தொகு]அடிப்படை வினை என்பது ஒரு இரசாயன வினையின் சிதைக்கப்படக்கூடிய மிகச்சிறிய பிரிவு ஆகும், இவ்வினையில் இடைநிலை விளைபொருட்கள் உருவாவதில்லை [11]. கவனிக்கப்பட்ட பெரும்பாலான வினைகள் அடிப்படை வினைகளுக்கு இணையாக அல்லது அவற்றின் தொடர்ச்சியாகவே நிகழ்கின்றன. தனித்தனியாகத் தொடரும் இந்த்தகைய அடிப்படை வினைகளின் தொடர்ச்சியை வினைவழிமுறை என்கின்றனர். எளிய அடிப்படை வினையில் ஒன்று அல்லது இரண்டு மூலக்கூறுகள் பங்கேற்கின்றன. ஏனெனில் ஒரு குறிப்பிட்ட நேரத்தில் பல மூலக்கூறுகள் சந்திப்பதற்கான நிகழ்தகவு குறைவாகும் [12].

மிக முக்கியமான அடிப்படை வினைகள் ஒற்றை மூலக்கூற்று வினையாகவும் இரு மூலக்கூற்று வினையாகவும் உள்ளன. ஒற்றை மூலக்கூற்று வினையில் ஒரேவொரு மூலக்கூறு மட்டுமே வினையில் பங்கேற்கிறது அதுவே மாற்றீயம் அல்லது மறுசீரமைப்பு மூலமாக அல்லது பிரிகையடைந்து ஒன்று அல்லது அதற்கு மேற்பட்ட மூலக்கூறுகளாக பிரிந்து வேதிமாற்றம் அடையும். இவ்வகை வினைகளுக்குக் கூடுதலாக வெப்பம் அல்லது ஆற்றல் சூரிய ஒளி அல்லது வெப்பம் மூலம் தேவைப்படுகிறது. ஒருபக்க-மறுபக்க மாற்றீயமாதல் (cis– trans) வினைகள் ஒற்றைமூலக்கூற்று வினைகளுக்கு எடுத்துக்காட்டாகும். ஒருபக்க மாற்றீய சேர்மம் இவ்வினையில் மறுபக்க மாற்றீய சேர்மமாகவோ அல்லது மறுபக்க மாற்றீய சேர்மம் ஒருபக்க மாற்றீய சேர்மமாகவோ மாற்றமடைகின்றன.
ஒரு குறிப்பிட்ட பிரிகை வினையில் ஒரு மூலக்கூறில் உள்ள பிணைப்பு பிளவுபடுகிறது. இதன் விளைவாக இரண்டு தனித்தனி மூலக்கூறு துண்டுகள் உருவாகின்றன. இப்பிளவு ஒரேவகை அல்லது பல்வகைப் பிளவு என்பனவற்றில் ஒன்றாக இருக்கலாம். முதல்வகை பிளவில் வேதிப்பிணைப்பு பிரிகிறது. ஒவ்வொரு விளைபொருளும் ஓர் எலக்ட்ரானை தக்கவைத்துக் கொள்கின்றன. எனவே அம்மூலக்கூறு நடுநிலை இயங்குறுப்பாக மாறுகிறது. இரண்டாவது வகை பிளவில் வேதிப்பிணைப்பிலுள்ள இரண்டு எலக்ட்ரான்களும் ஒரே விளைபொருளில் தங்கி அம்மூலக்கூறை மின்சுமையேற்ற அயனியாக்குகிறது. ஐதரசன் – ஆக்சிசன் அல்லது பலபடியாக்கல் வினைகள் போன்ற தொடர்வினைகளைத் தூண்டுவதில் பிரிகை வினைகள் முக்கியபங்கு வகிக்கின்றன.
- AB என்ற மூலக்கூறு A மற்றும் B என்று தனித்தனியாக பிரிகையடைகிறது.
இருமூலக்கூறு வினைகளில் இரண்டு மூலக்கூறுகள் ஒன்றுடன் ஒன்று மோதி வினைபுரிந்து ஒன்றாக இணைகின்றன. இவ்விணைப்பு வேதியியலில் வேதித் தொகுப்பு அல்லது கூட்டு வினை எனப்படுகிறது.
ஒருமூலக்கூறின் ஒரு பகுதி மட்டும் மற்றொரு மூலக்கூறுக்கு மாற்றமடையும் சாத்தியமும் உண்டு. இவ்வகை வினைகள் உதாரணமாக ஏற்ற ஒடுக்க வினைகளிலும், அமிலக் கார வினைகளிலும் நிகழ்கின்றன. ஏற்ற ஒடுக்க வினைகளில் மாற்றப்படும் துகள் ஓர் எலக்ட்ரானாகும். அதேவேளையில் அமிலக்கார வினைகளில் மாற்றப்படுவது மூலக்கூறின் ஒரு பகுதியாகும். இவ்வகையை மெய் இடம்பெயர் வினைகள் என்பர்.
உதாரணமாக,
வேதியியற் சமநிலை
[தொகு]பெரும்பாலான இரசாயன வினைகள் மீளமைக்கப்படும் வினைகளாக உள்ளன. அவை முன்னோக்கு மற்றும் பின்னோக்கு என்ற இரு திசைகளிலும் நிகழ முடியும். முன்னோக்கு விசையும் தலைகீழ் பின்னோக்கு வினையும் ஒன்றுக்கொன்று எதிரெதிர் திசைகளில் போட்டியிடுகின்றன மற்றும் வினை வேகத்தில் வேறுபடுகின்றன. வினைபடு பொருள்களின் அடர்த்தியைச் சார்ந்து வினையின் வேகம் இருப்பதால் வேதி மாற்றம் நேரத்தைப் பொறுத்தே நிகழ்கிறது. தலைகீழ் மீட்சி படிப்படியாக அதிகரித்து ஒரு நிலையில் முன்னோக்கு விசையின் வினைவேகத்துடன் சமநிலையை அடைகிறது. முன்னோக்கு வினை வேகமும் பின்னோக்கு வினை வேகமும் சமநிலையை அடையும்போது வினைபடு மற்றும் வினைவிளை பொருட்களின் செறிவுகள் வினை நேரத்தைப் பொறுத்து மாறாமல் இருக்கும். 0 பாகை வெப்பநிலையில் பனிக்கட்டி உருகுதல் மற்றும் நீர் உறைதல் இரண்டும் நடைபெறுகிறது.
வெப்பம், அழுத்தம், பயன்படுத்தப்படும் பொருட்கள் முதலிய அளவுகோல்கள் ஒரு வினை வேதிச்சமநிலையை அடைவதற்கான நேரத்தை நிர்ணயிக்கின்றன. சமநிலையில் உள்ள வினையில் கிப்சின் ஆற்றல் சுழியாகும். வேதிவினையின் வெப்பநிலை, வேதிவினையின் அழுத்தம், வேதிப் பொருட்களின் செறிவு ஆகிய மூன்றும் மாறும் போது வேதிச்சமநிலை மாறும் விதத்தை லீ சாட்லியர் தத்துவம் விளக்குகிறது. எடுத்துக்காட்டாக, கன அளவு குறைவதால் வேதியியல் அமைப்பின் அழுத்தம் அதிகரிக்கப்படுமாயின் வேதிச்சமநிலை குறைவான அழுத்தம் உள்ள திசையில் நகரும் [13]. சமநிலையில் உருவாகும் விளைபொருள் நிலைத்திருக்கும், ஆனால் வினை கலவையிலிருந்து விளைபொருளை பிரித்தெடுத்து அல்லது வெப்பநிலை அல்லது அழுத்தத்தை அதிகரித்து இதை மாற்றலாம். வினைகளின் செறிவுகளில் ஏற்படும் மாற்றம் சமநிலை மாறிலியைப் பாதிக்காது, ஆனால் சமநிலை நிலையின் இடத்தைப் பாதிக்கும்.
வெப்ப இயக்கவியல்
[தொகு]இரசாயன வினைகள் வெப்பவியக்கவியல் விதிகளால் தீர்மானிக்கப்படுகின்றன. வினைகள் ஆற்றலை வெளியிடும் வினைகளாக இருந்தால் அவை தன்னிச்சையாக முன்னோக்கி நிகழ்கின்றன. வினைகளுடன் தொடர்புடைய ஆற்றலானது என்தால்பி மற்றும் எண்ட்ரோப்பி என்ற இரண்டு வெவ்வேறு வெப்பமண்டல அளவுகளால் ஆனது:[14]
- .
- G: கட்டற்ற ஆற்றல், H: என்தால்பி, T: வெப்பம், S: எண்ட்ரோப்பி, Δ: வேறுபாடு (அசலுக்கும் வினைபொருளுக்குமுள்ள மாற்றம் .
வினைகள் வெப்ப உமிழ்வினைகளாக இருக்கலாம், அங்கு ΔH எதிர்மறையாக இருக்கும் மற்றும் ஆற்றல் இங்கு வெளியிடப்படுகிறது. வீழ்படிவாக்கல் வினைகளும் படிகமாக்கல் வினைகளும் வெப்ப உமிழ் வினைகளுக்கு குறிப்பிடத்தக்க எடுத்துக்காட்டுகளாகும். இதில் சீர்குலைந்த வாயு அல்லது நீர்ம கட்டங்களிலிருந்து சீரான திண்மங்கள் உருவாகின்றன. மாறாக வெப்பங்கொள் வினைகளில் சூழலிலிருந்து வெப்பம் ஈர்க்கப்படுகிறது. அமைப்பின் எண்ட்ரோப்பியை அதிகரிப்பதன் மூலம் இந்நிலை தோன்றுகிறது. பெரும்பாலும் அதிக எண்ட்ரோப்பி மதிப்பைக் கொண்ட வாயுநிலை வினை விளை பொருட்கள் மூலம் இந்த அதிகரிப்பு மேற்கொள்ளப்படுகிறது. எண்ட்ரோப்பி வெப்பநிலையுடன் அதிகரிக்கும் என்பதால் பல வெப்பங்கொள் வினைகள் அதிக வெப்பநிலையில் நிகழ்கின்றன. அதேபோல படிகமாக்கல் போன்ற வெப்ப உமிழ்வினைகள் தாழ்வெப்பநிலையில் நிகழ்கின்றன. வெப்பநிலையில் தோன்றும் மாற்றங்கள் சிலவேளைகளில் மாலிப்டினம் டையாக்சைடு கார்பன் மோனாக்சைடாக ஒடுக்கமடையும் வினை போன்ற நிகழ்வுகளில் வினையின் என்தால்பியை தலைகீழாக்குகின்றன.
:;
கார்பன் டை ஆக்சைடும் மாலிப்டினமும் உருவாவதற்கான இவ்வினை தாழ்வெப்பநிலையில் ஒரு வெப்பங்கொள் வினையாகும். வெப்பநிலை அதிகரிக்கும்போது [15] இது மேலும் குறைந்து 1885 கெல்வின் வெப்பநிலையில் ΔH° சுழியாகிறது. இவ்வெப்பநிலைக்கு மேல் வினை வெப்ப உமிழ்வினையாக மாறுகிறது. வெப்பநிலையில் ஏற்படும் மாற்றம் வினை நிகழும் திசையின் போக்கை தலைகீழாக மாற்ற முடியும். உதாரணமாக, நீர்வாயு பெயர்ச்சி வினையைக் கூறலாம்.
தாழ்வெப்பநிலையில் இது சாத்தியமாகிறது. ஆனால் இதன் தலைகிழி உயர் வெப்பநிலைகளில் நிகழ்கிறது. வினையின் திசையில் இடம்பெயரும் போக்கு 1100 K வெப்பநிலையில் தோன்றுகிறது.[15] உள்ளக ஆற்றலைக் கொண்டும் வினைகள் அடையாளப்படுத்தப்படுகின்றன. எண்ட்ரோப்பி மாற்றம், கண அளவு, வேதிப்பண்பு முதலானவை இங்கு கணக்கில் கொள்ளப்படுகின்றன. இங்கு வேதிப்பண்பி என்பது வினையில் ஈடுபடும் பொருட்களின் வேதிப்பண்புகளைக் குறிக்கிறது [16].
- U: உள்ளக ஆற்றல், S: எண்ட்ரோப்பி, p: அழுத்தம், μ: வேதியல் பண்பு, n: மூலக்கூறுகளின் எண்ணிக்கை, d: சிறிய மாற்றத்தின் குறியீடு
வினை இயக்கவியல்
[தொகு]எந்த வேகத்தில் வினைகள் நிகழ்கின்றன என்பது வினை இயக்கவியல் மூலம் ஆய்வு செய்யப்படுகிறது. வினைவிகிதம் பல்வேறு அளவுருக்களைச் சார்ந்துள்ளது. அவை,
- வினைக் கலவையில் உள்ள வினைபடு பொருள்களின் தொடக்கச் செறிவை அதிகரித்தால் வினையில் ஈடுபடும் மூலக்கூறுகளின் எண்னிக்கை அதிகரிக்கும். வினையில் ஈடுபடும் பொருள்கள் ஒன்றுடன் ஒன்று நெருங்கி வந்து மோதுவதால் வேதிவினை நிகழ்கிறது. ஓர் அலகு நேரத்தில் செறிவு அதிகரிக்கும்போது மோதல்களின் எண்ணிக்கையும் அதிகரிக்கும். இதனால் வினையின் வேகம் அதிகரிக்கின்றது. சில வினைகள் வினைபடு பொருள்களின் செறிவிலேயே தன்னிச்சையாக நிகழ்கின்றன. இவ்வகை வினைகளை சுழிநிலை வினைகள் என்கிறார்கள்.
- வினைபடு பொருள்களின் பரப்பு: திண்ம வினைபடு பொருள்களிலும், பலபடித்தான வினைகளிலும் வினைபடு பொருள்களின் பரப்பு முக்கிய பங்கை வகிக்கிறது. பரப்பில் இடம்பெற்றுள்ள அதிக எண்ணிக்கையிலுள்ள மூலக்கூறுகள் வினையில் ஈடுபடுவதால் வினைவேகம் அதிகரிக்கும்.
- அழுத்தம்: அழுத்தம் அதிகரிக்கும்போது மூலக்கூறுகளுக்கிடையே கன அளவு குறைகிறது. எனவே மோதுகைகளின் எண்ணிக்கை அதிகரித்து வினைவேகம் அதிகரிக்கிறது.
- வினையூக்கியின் விளைவு: வினையூக்கியானது ஒரு வேதிவினையின் வினைவேகத்தை மாற்றக்கூடிய ஒரு சேர்மமாகும். வினை நிகழ்வதற்கு முன்பும் வினை நிறைவுற்ற பிறகும் வினையூக்கியின் செறிவு மாறாமல் இருக்கும். பொதுவாக ஒரு வினையில் சேர்க்கப்படும் வினையூக்கி வினையின் வேகத்தை அதிகரிக்கும்.
- வெப்பத்தின் விளைவு: அமைப்பின் வெப்பநிலையை உயர்த்தும்போது வினைவேகம் அதிகரிக்கும். வெப்பநிலை உயரும்போது மூலக்கூறுகளின் இயக்க ஆற்றல் அதிகரிப்பதால் ஓர் அலகு நேரத்தில் நிகழும் மோதல்களின் எண்ணிக்கையும் அதிகரிக்கும். வினைவேகம் உயருவதற்கு இந்த ஆற்றல் அதிகரிப்பு காரணமாகும். வெப்பம் கொள் வினையில் வினையின் வேகம் உயரும். வெப்ப உமிழ் வினைகளில் வினையின் வேகம் குறையும்.
- செயலாற்றும் ஆற்றல்: தன்னிச்சையாக ஒரு வினையைத் தொடங்கி நிகழ்த்துவதற்குத் தேவையான ஆற்றல் செயலாற்றும் ஆற்றல் என வரையறுக்கப்படுகிறது. அதிக அளவு செயலாற்றும் ஆற்றல் கொண்ட வினைபடு பொருள்களைக் காட்டிலும் குறைந்த அளவு செயலாற்றும் ஆற்றல் கொண்ட வினைபடுபொருள்களின் வினையைத் தொடங்க அதிக ஆற்றல் அவசியமாகிறது.
- சில வேதிவினைகளுக்கு வேதிப்பிணைப்புகளை உடைத்து வினையைத் தொடங்குவதற்கு மின்காந்த கதிர்வீச்சு, குறிப்பாக புற ஊதா ஒளி கதிர் அவசியமாகிறது, முக்கியமாக இயங்குறுப்பு பங்கேற்கும் வினைகளுக்கு இவ்வொளி மிகவும் முக்கியமானதாகும்.
மூலக்கூற்று நிலையில் வினை வேகத்தைக் கணக்கிட பல கோட்பாடுகள் அனுமதிக்கின்றன. இத்துறை வினை இயங்கியல் எனப்படுகிறது. முதல் வகை வினையில் வினையின் வேகம் v ஆனது பொருள் A இன் சிதைவு ஆகும். இதை,
இதன் தொகையீடு தருவது:
வினைவேக மாறிலி k இன் அலகானது வினையின் வினைவேகம், வினைபடு பொருள்களின் அடர்த்தி, வினைவகை ஆகியவற்றை பொருத்து அமைகிறது. முதல்வகை வினையின் பரிமாணம் 1/நேரம் [A](t) ஆனது ஓர் அலகு நேரம் t மற்றும் [A]0 இல் இருந்த தொடக்க செறிவு ஆகும். வினைவேக மாறிலியின் வெப்பநிலைச் சார்பானது பொதுவாக அரீனியசுச் சமன்பாட்டுக்குக் கட்டுப்படுகிறது.
இங்கு Ea செயலாற்றும் ஆற்றல் ஆகும்.
kB போல்ட்சுமான் மாறிலியாகும்.
வினை வகைகள்
[தொகு]நான்கு அடிப்படை வகைகள்
[தொகு]
தொகுப்பு வினைகள்
[தொகு]இரண்டு அல்லது அதற்கு மேற்பட்ட எளிய பொர்ட்கள் இணைந்து புதிய மேலும் சிக்கலான பொருள்கள் உருவாகும் வினைகள் இவ்வகையாகும். பொதுவாக வினைகளின் பொது அமைப்பு கீழ்கண்ட வடிவில் இருக்கும்.
இரண்டு அல்லது அதற்கு மேற்பட்ட பொருள்கள் இணைந்து ஒரே வினைவிளை பொருளைக் கொடுக்கும் வினைகளை தொகுப்பு வினைகள் என்று அடையாளம் காணலாம். இரும்பும் கந்தகமும் சேர்ந்து இரும்பு(II) சல்பைடு உருவாகும் வினையை இதற்கு உதாரணமாகக் கூறலாம்.
எளிமையான ஐதரசன் வாயுவும் எளிமையான ஆக்சிசன் வாயுவும் இணைந்து சிக்கலான கூட்டு விளைபொருளான தண்ணீர் உருவாகின்ற வினையையும் தொகுப்பு வினைக்கு ஓர் உதாரணமாகக் கூறலாம்.[17]
வேதிச் சிதைவு என்பது ஒரு சிக்கலான கூட்டுச்சேர்மம் ஒன்று அல்லது அதற்கு மேற்பட்ட இரண்டு எளிய பொருள்களாகப் பிரியும் வினையைக் குறிக்கும் [18]. வேதியியலில் மூன்று வகையான சிதைவு வினைகள் உள்ளதாக வகைப்படுத்தப்படுகிறது. வெப்பச் சிதைவு, மின்பகுச் சிதைவு, வினையூக்கச் சிதைவு என்பன அம்மூன்று வகைச் சிதைவு வினைகளாகும்.
வேதிச் சிதைவின் பொதுவான அமைப்பு வாய்ப்பாடு இவ்வாறு அமையும்:
- AB → A + B
தண்ணீரின் நீராற்பகுப்பு வினையை சிதைவு வினைக்கு சரியான உதாரணமாகக் குறிப்பிடலாம். இங்கு நீர்ம நிலையிலுள்ள நீர் மூலக்கூறு வாயு நிலையில் உள்ள ஐதரசன் மற்றும் ஆக்சிசனாகச் சிதைவடைகிறது.
- 2 H2O(I) → 2 H2 + O2
ஐதரசன் பெராக்சைடு, மெல்ல தண்ணீர் மற்றும் ஆக்சிசனாகச் சிதைவதைத் தன்னிச்சையானச் சிதைவடைதலுக்கு ஒரு உதாரணமாகக் கூறலாம்.
- 2 H2O2 → 2 H2O + O2
கார்பனேட்டுகளைச் சூடாக்கும்போது அவை சிதைவடைகின்றன. கார்பானிக் அமிலம், H2CO3 இதற்கு விதிவிலக்காகும். கார்பானிக் அமிலம் மட்டும் தன்னிச்சையாகச் சிதைவடைந்து கார்பன் டை ஆக்சைடு மற்றும் தண்ணீரராக பிரிகிறது. சோடா உடைக்கும்பொழுது வெளிப்படும் ஓசை மற்றும் மதுபானங்கள் திறக்கும்போது வெளிப்படும் ஓசைகள் சிதைவடைந்த வாயுவின் வெளிப்பாடு ஆகும்.
- H2CO3 → H2O + CO2
மற்ற கார்பனேட்டுகளைச் சூடுபடுத்தினால் அவை அவற்றின் உலோகம் மற்றும் ஆக்சைடுகளாகச் சிதைவடைகின்றன.
- MCO3 → MO + CO2
வினையில் உள்ள M ஓர் உலோகத்தைக் குறிக்கிறது.
குறிப்பிட்டுச் சொல்ல வேண்டுமென்றால், கால்சியம் கார்பனேட்டு சிதைவடைதலைச் சொல்லலாம்.:
- CaCO3 → CaO + CO2
உலோக குளோரேட்டுகளும் சூடாக்கும் போது சிதைவடைகின்றன. இச்சிதைவு வினையில் ஓர் உலோக குளோரைடும் ஆக்சிசனும் விளைகின்றன.
- 2 MClO3 → 2 MCl + 3 O2
பொதுவாக குளோரேட்டுகள் ஆக்சிசனை வெளிவிட்டு சிதைகின்றன. உதாரணமாக பொட்டாசியம் குளோரேட்டு ஆக்சிசனை வெளியிட்டு பொட்டாசியம் குளோரைடாக மாறுகிறது.
- 2 KClO3 → 2 KCl + 3 O2
சிதைவு வினைகள் தொகுப்பு வினைகளுக்கு நேரெதிர் வினைகளாகக் காணப்படுகின்றன [17][19].
ஒற்றை இடப்பெயர்ச்சி வினைகள்
[தொகு]தனித்த நிலையில் காணப்படும் ஒரு வினைபடு பொருள், வினையில் ஈடுபட்டு உருவாகும் ஒரு விளைபொருள் சேர்மத்தில் இடம்பெயர்ந்து காணப்படும் வினை ஒற்றை இடப்பெயர்ச்சி வினை எனப்படுகிறது. ஒரு தனிமம் ஒரு சேர்மத்திற்கு இடம்பெயரும் வினை என்று சுருக்கமாகக் கூறலாம். இவ்வகை வினையின் பொது அமைப்பு இவ்வாறு அமைகிறது.
மக்னீசியம் ஐதரசனை இடப்பெயர்ச்சி செய்து மக்னீசியம் ஐதராக்சைடாகவும் ஐதரசன் வாயுவாகவும் மாறும் வினையை ஒற்றை இடப்பெயர்ச்சி வினைக்கு உதாரணமாகக் கூறலாம்.
இரட்டை இடப்பெயர்ச்சி வினைகள்
[தொகு]இரண்டு சேர்மங்களின் நேர்மின் அயனிகளும் எதிர்மின் அயனிகளும் தங்களுடைய இடங்களை மாற்றிக்கொண்டு முற்றிலும் புதிய சேர்மங்களாக மாறுகின்ற வினையை இரட்டை இடப்பெயர்ச்சி வினை என்கின்றனர்.[17] These reactions are in the general form:[19]
உதாரணமாக, பேரியம் குளோரைடு [[(BaCl2) மற்றும் மக்னீசியம் சல்பேட்டு (MgSO4) இரண்டும் வினைபுரியும் போது SO42− எதிர்மின் அயனி 2Cl− எதிர்மின் அயனியின் இடத்திற்கு இடம்பெயர்ந்து புதிய சேர்மங்கள் BaSO4 மற்றும் MgCl2 உருவாகின்றன.
ஈய(II) நைட்ரேட்டு மற்றும் பொட்டாசியம் அயோடைடு சேர்ந்து ஈய(II) அயோடைடு மற்றும் பொட்டாசியம் நைட்ரேட்டுகள் உருவாகும் வினையையும் இரட்டை இடப்பெயர்ச்சி வினைக்கு உதாரணமாகக் கூறலாம்.
ஆக்சிசனேற்றமும் ஒடுக்க வினையும்
[தொகு]

வினையில் ஈடுபடும் ஒரு ஒடுக்கும் முகவரிடமிருந்து மற்றொரு ஆக்சிசனேற்றும் முகவருக்கு எலக்ட்ரான்கள் மாற்றமடையும் வினைகள் ஆக்சிசனேற்ற ஒடுக்க வினைகள் எனப்படுகின்றன. இச்செயல்முறையில் முதலாவதாகக் கூறப்பட்ட ஒடுக்கும் முகவர் ஆக்சிசனேற்றம் அடைந்ததாகவும், இரண்டாவதாகக் கூறப்பட்ட ஆக்சிசனேற்ற முகவர் ஒடுக்கம் அடைந்ததாகவும் கருதப்படுகிறது. பெரும்பாலான நிகழ்வுகளில் இவ்வரையறை சரியென்றாலும் இது மிகச் சரியான வரையறையல்ல. ஆக்சிசனேற்றம் என்பது ஆக்சிசனேற்ற நிலை அதிகரிப்பு என்றும் ஒடுக்கம் என்பது ஆக்சிசனேற்ற நிலையில் ஏற்படும் குறைவு என்றும் கொள்ளப்படுகிறது. எலக்ட்ரான்கள் மாற்றமடையும் போதெல்லாம் ஆக்சிசனேற்ற நிலையில் மாற்றம் அடைகிறது என்பது நடைமுறையாகும். ஆனால் சகப்பிணைப்புகள் பங்கேற்பது போன்ற பல வினைகளில் எலக்ட்ரான்கள் மாற்றம் இல்லையென்றாலும் அவ்வினைகள் ஆக்சிசனேற்ற ஒடுக்க வினைகள் என அழைக்கப்படுகின்றன[20][21].
கீழ்கண்ட ஆக்சிசனேற்ற ஒடுக்க வினையில், சோடியம் உலோகம் குளோரின் வாயுவுடன் இணைந்து அயனச் சேர்மமான சோடியம் குளோரைடு அல்லது சாதாரண உப்பு உருவாகிறது.
இவ்வினையில் தூய்மையான சோடியம் உலோகம் ஆக்சிசனேற்ற நிலை பூச்சியத்திலிருந்து ஆக்சிசனேற்ற நிலை ஒன்றுக்குச் செல்கிறது. வேறுமுறையில் சொல்வதென்றால் சோடியம் ஒரு எலக்ட்ரானை இழந்து ஆக்சிசனேற்றம் அடைந்தது என்று சொல்லலாம். மறுபுறத்தில் குளோரின் வாயு ஆக்சிசனேற்ற நிலை பூச்சியத்திலிருந்து ஆக்சிசனேற்ற நிலை -1 என மாறுகிறது. வேறுமுறையில் சொல்வதென்றால் குளோரின் ஒரு எலக்ட்ரானைப் பெற்று ஒடுக்கம் அடைந்தது என்று சொல்லலாம். ஏனெனில் குளோரின் ஓர் எலக்ட்ரான் ஏற்பியாகும். இது சோடியத்தின் ஆக்சிசனேற்றத்தைத் தூண்டுகிறது. எனவே குளோரினை ஓர் ஆக்சிசனேற்ற முகவர் என்பர். அதேபோல சோடியம் ஓர் எலக்ட்ரான் வழங்கியாகும். இது குளோரினின் ஒடுக்கத்தைத் தூண்டுகிறது. எனவே சோடியம் இங்கு ஒடுக்கும் முகவராகக் கருதப்படுகிறது.
தனிமங்களின் எலக்ட்ரான் கவர் திறனைக் கொண்டு அவற்றில் ஆக்சிசனேற்ற முகவர் மற்றும் ஒடுக்கும் முகவர்களை கண்டறியலாம். குறைந்த எலக்ட்ரான் கவர் திறன் கொண்ட, எலக்ட்ரான்களை வழங்கி ஆக்சிசனேற்றமடையும் உலோகங்கள் ஒடுக்கும் முகவர்களாகும். அதேபோல உயர் ஆக்சிசனேற்ற நிலைகளைக் கொண்ட H2O2, MnO−4, CrO3, Cr2O2−7, OsO4 போன்ற அயனிகள் ஒன்று அல்லது இரண்டு எலக்ட்ரன்களை ஏற்று ஆக்சிசனேற்றும் முகவர்கள் என அழைக்கப்படுகின்றன. ஆக்சிசனேற்ற ஒடுக்க வினைகளில் ஏற்கப்படும் அல்லது இழக்கப்படும் எலக்ட்ரான்களின் எண்ணிக்கையை வினைபடு பொருளின் எலக்ட்ரான்களின் அமைப்பு முறையிலிருந்து கணிக்கமுடியும். தாழ்ந்த ஆற்றல் மந்தவாயுக்களின் எலக்ட்ரான் அமைப்பு முறையை அடைய முயலும் தனிமங்களான கார உலோகங்கள் எலக்ட்ரான் வழங்கிகளாகவும், இவ்வகை ஆலசன்கள் எலக்ட்ரான் ஏற்பிகளாகவும் இருக்கின்றன. மந்தவாயுக்கள் வேதிவினைகளில் மந்தமான வினையையே வெளிப்படுத்துகின்றன [22]
மின் வேதியியல் வினைகள் ஒரு முக்கியமான வகை ஆக்சிசனேற்ற ஒடுக்க வினைகளாகும். செலுத்தப்படும் மின்னாற்றலில் உள்ள் எலக்ட்ரான்கள் இங்கு ஒடுக்கும் முகவராகச் செயல்படுகின்றன. இவ்வகை வினைகள் குளோரின், அலுமினியம் போன்ற தனிமங்களை உற்பத்தி செய்யும் வினைகளில் முக்கியத்துவம் பெறுகின்றன[23]. இதன் தலைகீழ் ஆக்சிசனேற்ற ஒடுக்க செயல்முறையில் எலக்ட்ரான்கள் விடுவிக்கப்படுகின்றன. இவற்றை மின்கலன்களில் மின்னாற்றலாகப் பயன்படுத்த முடியும்.
ஒருங்கிணைவு வினைகள்
[தொகு]
பல ஈந்தணைவிகள் உலோக அணுவுடன் வினைபுரிந்து ஒருங்கிணைவுச் சேர்மங்களைத் தருகின்றன. இவ்வினையில் உலோக அணுவின் காலி ஆர்பிட்டால்களுக்கு ஈந்தணைவிகளின் தனி இணை எலக்ட்ரான்கள் வழங்கப்பட்டு இருமுனைய பிணைப்புகள் உருவாகின்றன. கார்பன் ஓராக்சைடு, அமோனியா. தண்ணிர் போன்றவை இங்கு ஈந்தணைவிகளாகும். இவை அயனிகளாகவும் நடுநிலை மூலக்கூறுகளாகவும் இருக்கவியலும். மைய அணுவுடன் வினைபுரியும் ஈந்தணைவிகளின் எண்ணிக்கையை 18 எலக்ட்ரான் விதியின் மூலம் அறியமுடியும். தாண்டல் உலோகங்களின் இணைதிறன் கூடுகளில் 18 எலக்ட்ரான்கள் இடம்பிடிக்கும். அதேபோல உருவாகும் ஒருங்கிணைவுச் சேர்மத்தின் சீர்மை ஒழுங்கை படிகப்புலக் கோட்பாடு மற்றும் ஈனிப்புலக் கோட்பாடுகளின் மூலம் கணிக்க முடியும். ஒருங்கிணைவு வினைகளில் ஈந்தணைவி மற்றொரு ஈந்தனைவியால் பரிமாற்றஞ் செய்யப்படுகிறது. ஆக்சிசனேற்ற ஒடுக்க வினை மைய உலோக அணுவின் ஆக்சிசனேற்ற நிலையை மாற்றுகிறது[24].
அமிலக் கார வினைகள்
[தொகு]புரோட்டான்கள் (H+) ஓர் அமில இனத்திலிருந்து மற்றொரு கார இனத்திற்கு மாற்றப்படும் வினைகள் அமிலக் கார வினைகள் என்று பிரான்சிடெட்டு அமிலக் கார கோட்பாடு வரையறை செய்கிறது. ஓர் அமிலத்திலிருந்து ஒரு புரோட்டான் நீக்கப்பட்டவுடன் உருவாகும் இனம் அவ்வமிலத்தின் இணைகாரம் என பெயரிடப்படுகிறது. பொதுவாக அமிலங்கள் புரோட்டான் வழங்கிகள் என்றும் காரங்கள் புரோட்டான் ஏற்பிகள் என்றும் அறியப்படுகின்றன. இதற்கான சமன்பாடு கீழே தரப்பட்டுள்ளது[25]
இவ்வினைக்கான தலைகீழ் எதிர் வினை நிகழவும் சாத்தியமுண்டு. இதனால் அமிலம்/காரம் மற்றும் இணைகாரம்/இணை அமிலம் வினையானது எப்போதும் சமநிலையிலேயே இருக்கும். இச்சமநிலையை வினையில் பங்கேற்கும் பொருட்களின் அமிலக் கார பிரிகை மாறிலிகளைக் (Ka மற்றும் Kb) கொண்டு உறுதி செய்ய முடியும். நடுநிலையாக்கல் வினை அமிலக் கார வினைகளில் நிகழும் ஒரு சிறப்பான வினையாகும். நடுநிலை உப்பிலிருந்து சம அளவில் அமிலமும் காரமும் ஒரு வினைக்காக எடுத்துக் கொள்ளப்படுகின்றன.
அமிலக் கார கோட்பாடுகளின் அடிப்படையில் அமிலக் கார வினைகள் வெவ்வேறு வகையான வரையறைகளைக் கொண்டுள்ளன. அவற்றுள் சில பொதுவான வரையறைகள் இங்கு தரப்படுகின்றன.
- அர்ரீனியசு வரையறை: அமிலங்கள் தண்ணீரில் பிரிகையடைந்து H3O+ அயனிகளை வெளிவிடும். காரங்கள் தண்ணீரில் பிரிகையடைந்து OH− அயனிகளைத் தருகின்றன.
- பிரான்சிடெட்டு லௌரி வரையறை: அர்ரீனியசு வரையறையுடன் அமிலங்கள் புரோட்டான் (H+) வழங்கிகளாகும். காரங்கள் புரோட்டான் ஏற்பிகளாகும்.
- இலூயிசு வரையறை: பிரான்சிடெட்டு லௌரி வரையறையுடன் அமிலங்கள் என்பவை எலக்ட்ரான் சோடியை வழங்குபவை மற்றும் காரங்கள் என்பவை எலக்ட்ரான் சோடியை ஏற்பவைகளாகும்.
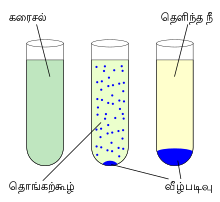
ஒரு வேதி வினையின் போது ஒரு கரைசலில் அல்லது ஒரு திண்மத்தில் திண்மம் ஒன்று உருவாகின்ற வினையைக் குறிக்கும். வழக்கமாக கரைசலில் கரைந்துள்ள அயனிகளின் செறிவு கரைதல் திறனின் எல்லையைத் தாண்டும் போது வீழ்படிவாகல் நிகழ்ந்து கரையாத உப்பு உருவாகிறது [26].
இந்தச் செயல் முறையானது வினைக் கரைசலுடன் ஒரு வீழ்படிவாக்கும் முகவரைச் சேர்ப்பதன் மூலம் அல்லது அக்கரைசலில் உள்ள கரைப்பானை நீக்குவதன் மூலம் நிகழ்த்தப்படுகிறது. விரைவு விழ்படிவாக்கல் முறையின் மூலம் படிகவடிவமற்ற திண்மம் அல்லது நுண்படிகங்களின் எச்சம் மட்டுமே உருவாகிறது. இயல்பான வீழ்படிவாக்கல் வினையினால் ஒற்றைப்படிகங்கள் கிடைக்கின்றன. நுண்படிகங்களை மீள்படிகமாக்கல் முறையில் படிகமாக்கி ஒற்றைப்படிகங்களைத் தயாரிக்கலாம் [27].
திண்மநிலை வினைகள்
[தொகு]இரண்டு திடப்பொருட்களுக்கு இடையிலும் வினைகள் நிகழ முடியும். எனினும், திடப்பொருட்களில் பரவல் வேகம் சிறிய அளவில் காணப்படுவதால் தொடர்புடைய இரசாயன வினைகள் திரவ மற்றும் வாயு நிலை வினைகளுடன் ஒப்பிடுகையில் மிகவும் மெதுவாகவே நிகழ்கின்றன. வினையின் வெப்பநிலையை அதிகரிப்பதன் மூலமும், வினைபடு பொருள்களின் தொடும் மேற்பரப்பை அதிகரிக்கச் செய்வதன் மூலம் இவ்வினையின் வினை வேகத்தை அதிகரிக்கச் செய்யலாம் [28].
திண்மவாயு இடைமுகப்பு வினைகள்
[தொகு]திண்மவாயு இடை முகப்பிலும் வேதி வினைகள் நிகழ்கின்றன. மீவுயர் வெற்றிடம் போன்ற தாழ் அழுத்த மேற்பரப்புகளில் இவ்வினைகள் நிகழ்கின்றன. வருடி ஊடுறுவும் நுண்ணோக்கி வாயிலாக அறியமுடியும். வினையின் அளபுருக்கள் சரியாக இருக்கும் பட்சத்தில் வினைகளை நிகழ்விண்வெளியில் கவனிக்க இயலும் [29][30]. சில திண்மவாயு இடை முகப்பு வேதி வினைகள் வினையூக்கிகளுடன் தொடர்பு கொண்டவையாகும்.
ஒளிவேதியியல் வினைகள்
[தொகு]
ஒளிவேதியியல் வினைகளில் அணுக்கள் மற்றும் மூலக்கூறுகள் ஒளிரும் விளக்கிலிருந்து ஆற்றலை (ஒளியன்கள்) உறிஞ்சி கிளர்வு நிலைக்கு மாற்றுகின்றன. பின்னர் வேதியியல் பிணைப்புகளை உடைப்பதன் மூலம் இந்த ஆற்றல் வெளியிடப்படுகிறது. இதன்மூலம் இயங்குறுப்புகள் உற்பத்தி செய்யப்படுகின்றன. ஐதரசன் - ஆக்சிசன் வினைகள், இயங்குறுப்பு பலபடியாதல் வினைகள், சங்கிலி வினைகள் மற்றும் மறுசீரமைப்பு வினைகள் உள்ளிட்டவை ஒளிவேதியியல் வினைகளில் அடங்கும் [31].
ஒளிவேதியியலுடன் பல முக்கியமான செயல்முறைகள் தொடர்பு கொண்டுள்ளன. ஒளிச்சேர்க்கை இவற்றில் முதன்மையான இடத்தைப் பிடிக்கிறது. பல தாவரங்கள் சூரிய ஒளியைப் பயன்படுத்தி கார்பன் டை ஆக்சைடையும் நீரையும் குளுக்கோசாக மாற்றிப் பயன்படுத்துகின்றன. ஆக்சிசனை உடன் விளைபொருளாக வெளிவிடுகின்றன. மனிதர்களுக்குத் தேவையான வைட்டமின் டி சூரிய ஒளியிலிருந்தே கிடைக்கிறது. ரோடோப்சின் என்ற வேதிப்பொருளின் ஒளிவேதியியல் வினையினாலேயே பார்வைத் திறன் கிடைக்கிறது[32]. மின்மினிப்பூச்சிகளின் வயிற்றுப்பகுதியிலுள்ள நொதி ஒளிவேதியியல் வினைக்கு உட்பட்டு உயிரொளிர்வெளிச்சத்தைக் கொடுக்கிறது[33]. ஓசோன் உருவாக்கம் போன்ற குறிப்பிடத்தக்க ஒளிவேதியியல் வினைகள் மூலமாக சுற்றுச்சூழலும் அது தொடர்பான வேதியியல் பிரிவும் உருவாகின்றன.
வினைவேகமாற்றம்
[தொகு]ஒரு சேர்மம் எத்தகைய வினைவேக மாற்றத்திற்கும் உட்படாமல் ஒரு வேதிவினையின் வேகத்தை மாற்றினால் அதற்கு வினைவேக மாற்ரி எனப்பெயர். இத்தகைய செயல்முறை வினைவேக மாற்றம் எனப்படும்.
வினைவேகமாற்ற வினைகளீல் வேதிவினைகள் நேரடியாக நிகழ்வதில்லை. ஆனால் வினையின் வேகத்தை கூட்டுவதற்காக மூன்றாவதாக சேர்க்கப்படும் வினையூக்கி என்ற பொருளின் மூலம் நிகழ்கின்றன. வினைவேக மாற்ரிகள் வினையைத் தொடங்குவதில்லை. ஆனால் குறிப்பிட்ட வேகத்தில் நிகழ்ந்து கொண்டிருக்கும் வினையின் வேகத்தை மாற்றுகின்றன. வினையூக்கிகள் வினையில் பங்கு பெறுகின்றன என்றாலும் வினையின் முடிவில் அவை தங்களுடைய அசல் நிலையிலேயே திரும்பக் கிடைக்கின்றன. இருப்பினும் இரண்டாம் நிலை செயல்முறைகளால் இவற்றை தடை செய்யவோ, செயலிழக்கச்செய்யவோ அல்லது அழிக்கவோ முடியும். வினைவேக மாற்றி வினைகளை பலபடித்தான வினைவேக மாற்றம், ஒருபடித்தான வினைவேக மாற்றம் என இரண்டு வகைகளாகப் பிரிக்கலாம்.
ஒரு படித்தான வினைவேக மாற்ற வினைகளில் வினைபடு பொருள்கள் மற்றும் வினைவேக மாற்றி ஆகியவை ஒரே நிலைமையில் இருக்கும். பலபடித்தான வினைவேக மாற்ற வினைகளில் இவை வெவ்வேறு நிலைமைகளில் இருக்கும். பண்புகள் மற்றும் செயல்படும் தன்மை ஆகியவற்றைப் பொறுத்து வினைவேக மாற்றிகளை வெவ்வேறு பிரிவுகளாக வகைப்படுத்தலாம். வினையின் வேகத்தை அதிகப்படுத்தும் வினைவேக மாற்றிகள் ஊக்க வினைவேக மாற்றிகள் எனப்படுகின்றன. மாறாக வினையின் வேகத்தைக் குறைக்கின்ற வினைவேக மாற்றிகள் தளர்வு வினைவேக மாற்றிகள் அல்லது குறைப்பான்கள் எனப்படுகின்றன [34][35]. சில வகை வினைகளில் வினையில் உருவாகும் விளைபொருள் வினைவேக மாற்றியாகச் செயல்படுகிறது. இத்தகையவை தன் வினைவேக மாற்றிகள் எனப்படுகின்றன. சாதாரண நிலையில் நிகழாத ஒரு வினையின் வேகத்தை வினைபடு பொருள் ஒன்று மாற்றினால் அவ்வினை தூண்டப்பட்ட வினை எனப்படுகிறது. வினைவேக மாற்றியின் செயல்திறனை இழக்கச் செய்யும் சேர்மம் வினைவேக மாற்றி நச்சு எனப்படுகிறது.
பலபடித்தான வினையூக்கிகள் பொதுவாக திண்மங்களாகும். இவற்றை தூளாக்கி பயன்படுத்தினால் வினையின் பரப்பளவை அதிகரித்துக் கொள்ள முடியும். பலபடித்தான வினைவேக மாற்ற வினைகளில் குறிப்பாக பிளாட்டினம் குழு தனிமங்களும் தாண்டல் உலோகங்களும் முக்கியத்துவம் பெறுகின்றன. நைட்ரிக் அமிலம், அமோனியா தயாரிப்பு மற்றும் ஐதரசனேற்றம் போன்ற வினைகளில் இவை பயன்படுத்தப்படுகின்றன. அமிலங்கள் பொதுவாக ஒரு படித்தான வினையூக்கிகளாகும். இவற்றை வினைபடு பொருட்களுடன் சேர்ப்பது எளிது ஆனால் விளைபொருட்களிலிருந்து பிரிப்பது கடினம். எனவே பலபடித்தான வினைவேக மாற்றிகளை தொழில்துறையில் பயன்படுத்துவது பரிந்துரைக்கப்படுகிறது[36].
கரிமவேதியியலில் வேதிவினைகள்
[தொகு]ஆக்சிசனேற்றம், ஒடுக்கம் அல்லது அமிலக் கார வினைகளுடன் கூடுதலாக கரிம வேதியியலில் எண்ணற்ற பல வினைகள் நிகழ்கின்றன. கார்பன் அணுக்கள் அல்லது ஆக்சிசன், நைட்ரசன், ஆலசன்கள் போன்ற மற்ற அணுக்களுக்கிடையில் சகப்பிணைப்புகள் இவ்வினைகளில் பங்கேற்கின்றன. கரிம வேதியியலில் பல வினைகள் அவற்றைக் கண்டுபிடித்த அறிஞர்களின் பெயர் சூட்டப்பட்டு பெயர் வினைகளாக அழைக்கப்படுகின்றன.
பதிலீட்டு வினைகள்
[தொகு]ஒரு குறிப்பிட்ட வேதிச் சேர்மத்தின் கார்பனுடன் இணைக்கப்பட்டுள்ள ஓர் அணு அல்லது ஓரு தொகுதி நீக்கப்பட்டு அதற்குப் பதிலாக வேறொரு அணு அல்லது தொகுதி அவ்விடத்தை அடைந்து கார்பனுடன் பிணைப்பு ஏற்படுமாயின் அவ்வினை பதிலீட்டு வினை எனப்படும்[37]. பதிலீடு செய்யப்படும் காரணிகளை அடிப்படையாகக் கொண்டு இவ்வினைகள் மூன்று வகைகளாகப் பிரிக்கப்படுகின்றன. அவை கருக்கவர் பதிலீட்டு வினைகள், எலக்ட்ரான் கவர் பதிலீட்டு வினைகள், தனி உறுப்பு பதிலீட்டு வினைகள் என்பன அம்மூன்று வகைகளாகும்.
முதல் வகையில் எலக்ட்ரானை மிகையாகக் கொண்டு எதிர்மின் சுமையை அல்லது பகுதி மின்சுமையுடன் உள்ள ஒரு கருக்கவர் அணு அல்லது மூலக்கூறு மற்றொரு அணுவை அல்லது அடிமூலக்கூறை இடப்பெயர்ச்சி செய்கிறது. கருக்கவரியில் உள்ள எலக்ட்ரான் இணை அடிமூலக்கூறைத் தாக்கி ஒரு புதிய பிணைப்பாக உருவாகிறது. விடுவிக்கும் தொகுதி அதேவேளையில் ஒரு எலக்ட்ரான் இணையை விடுவித்து வெளியேறுகிறது. கருக்கவரி அநேகமாக மின்சுமையற்று அல்லது எதிர்மின் சுமையுடன் காணப்படும். அடிமூலக்கூறு குறிப்பாக மின்சுமையற்று அல்லது நேர்மின் சுமையுடன் காணப்படும். ஐதராக்சைடு அயனி, ஆல்காக்சைடுகள், அமீன்கள், ஆலைடுகள் போன்றவை கருக்கவரிகளுக்கு உதாரணங்களாகும். அலிபாட்டிக் ஐதரோகார்பன்களில் இவ்வினை பிரதானமாகவும் அரோமாட்டிக் ஐதரோகார்பன்களில் அரிதாகவும் இவ்வினை நிகழ்கிறது.
பதிலீட்டு வினை ஒரு கருகவர் கரணியால் ஏற்படுமாயின் அது கருக்கவர் பதிலீட்டு வினை எனப்படுகிறது. இதை SN என்று குறித்துக் காட்டுகிறோம். SN வகை வினை வழிமுறைகளை மேலும் இரண்டு வகையாகப் பிரிக்கலாம். அவை SN1 மற்றும் SN2. வழிமுறைகளாகும். SN1 இல் உள்ள S பதிலீடு என்பதையும் N என்பது கருக்கவர் என்பதையும் 1 என்ற எண் வினையில் பங்குபெறும் மூலக்கூற்றின் எண்ணிக்கையையும் குறிக்கின்றன[38].
SN1 வினை இரண்டு படிநிலைகளில் நிகழ்கிறது. முதலில் விடுபடும் தொகுதி விடுவிக்கப்பட்டு ஒரு கார்பன்நேர்மின்னயனி உருவாகிறது. பின்னர் இது கருக்கவரியுடன் விரைவுவினைக்கு உட்படுகிறது [39].
SN2 வழிமுறையில் கருகவரியானது தாக்கப்பட்ட மூலக்கூறுடன் சேர்ந்து ஒரு வினையிடை பொருளாக உருவாகிறது. இதன்பிறகே விடுபடும் தொகுதி பிளவுபடுகிறது. விளைபொருட்களின் முப்பரிமாண வேதியியலில் இவ்விருவழிமுறைகளும் வேறுபடுகின்றன. SN1 வினை முப்பரிமாணச் சிறப்புக் கட்டுமாணமல்லாத கூட்டுவினைக்குச் செல்கிறது. நாற்தொகுதி மையத்தில் இவ்வழிமுறை முடிவதில்லை. ஆனால் ஒருபக்க/மாறுபக்க வடிவவியல் மாற்றியங்கள் உருவாகின்றன. மாறாக SN2 வழிமுறையில் வால்டன் தலைகிழி உருவாகிறது [40].
எலக்ட்ரான் கவர் பதிலீட்டு வினையானது கருக்கவர் பதிலீட்டு வினையை ஒத்த எதிர்வினையாகும். இப்பதிலீட்டுவினை எலக்ட்ரான் கவர் கரணியால் துவக்கப்படுகிறது. காபனைல் குழுக்களின் கார்பன் அணுக்கள், கார்பன்நேர்மின்னயனிகள் அல்லது கந்தகம் அல்லது நைட்ரோனியம் நேர்மின்னயனிகள் போன்றவை முக்கியமான எலக்ட்ரான் கவரிகளாகும். அரோமாட்டிக் ஐதரோகார்பன்களில் எலக்ட்ரான் கவர் பதிலீட்டு வினைகள் முக்கியபங்கு வகிக்கின்றன. இங்கு இவை அரோமாட்டிக் எலக்ட்ரான் கவர் பதிலீட்டு வினைகள் எனப்படுகின்றன. கருக்கவர் பதிலீட்டு வினைகள் போலவே இவ்வினையிலும் இரண்டு வகைகள் உண்டு. அவை SE1 மற்றும் SE2 எலக்ட்ரான் கவர் வினைகளாகும் [41]

.
தனி உறுப்புகளால் துவக்கப்பட்டு நிகழும் வினைகள் தனி உறுப்பு பதிலீட்டு வினைகள் எனப்படுகின்றன [37]. இவை பெரும்பாலும் தொடர் வினைகளாகவே நிகழ்கின்றன. உதாரணமாக ஆல்க்கேன்கள் ஆலைடுகளுடன் ஈடுபடும் வினையைக் கூறலாம். முதல்படிநிலையில் ஒளியால் அல்லது வெப்பத்தால் தூண்டப்பட்டு தனி உறுப்பு உருவாகி வினை தொடர்கிறது [42]
- தனி உறுப்பு பதிலீட்டு வினையின்போது நிகழும் வினைகள் .
கூட்டு மற்றும் நீக்கல் வினைகள்
[தொகு]இரட்டைப் பிணைப்பு அல்லது முப்பிணைப்பு உடைய சேர்மங்கள் இத்தகைய வினைகளில் ஈடுபடுகின்றன. இவ்வகையில் இரண்டு மூலக்கூறுகள் கூடி ஒரே சேர்மத்தைத் தருகின்றன.
கூட்டு வினையும் இதனையொத்த எதிர்வினையான நீக்கல்வினையும் கார்பன் அணுவில் பதிலீடுகளின் எண்ணிக்கையை மாற்றிக் கொண்டு உருவாகின்றன அல்லது சகப்பிணைப்புகளாக பிளவுறுகின்றன. பொருத்தமான விடுபடும் குழுவை நீக்குவதன் மூலம் இரட்டைப் பிணைப்பும், முப்பிணைப்பும் வினையில் உருவாகின்றன. கருகவர் பதிலீட்டு வினைகளைப் போல பலவிதமான வினைவழிமுறைகள் இங்கும் சாத்தியமாகின்றன. வினைவகையின் அடிப்படையில் நிகழும் வினைகளுக்கு உரிய பெயரிடப்படுகின்றன. E1 வினைவழிமுறையில் முதலில் விடுபடும் குழு விடுவிக்கப்பட்டு கார்பன்நேர்மின்னயனி உருவாகிறது. அடுத்த கட்டத்தில் ஒரு புரோட்டான் நீக்கப்பட்டு இரட்டைப் பிணைப்பு தோன்றுகிறது. E1cb வினைவழிமுறையில் இவ்விடுபடல் தலைகீழாக நிகழ்கிறது. அதாவது முதலில் புரோட்டானும் பின்னர் விடுபடும் குழுவும் நீக்கப்படுகின்றன. இணைகாரம் பங்கேற்பது இவ்வினைவழிமுறையின் முக்கியத் தேவையாகும் [43]. ஒரே மாதிரியான நிபந்தனைகள் என்பதால் E1 அல்லது E1cb நீக்க வினைகள் SN1 வழிமுறைக்கு போட்டியாக உள்ளன [44]

.
E2 வினைவழிமுறை வினைக்கும் ஓர் இணை காரம் தேவைப்படுகிறது. ஆனால் இங்கு காரம் தாக்கப்படுவதும் விடுபடும் குழு நீக்கமும் ஒரே நேரத்தில் நிகழ்கின்றன. அயன இடைநிலைகள் ஏதும் உருவாவதில்லை. E1 நீக்குதல்களுக்கு மாறாக E2 வினைவழி முறையில் உருவாகும் வினை விளைபொருளுக்கு வெவ்வேறு முப்பரிமான கட்டமைப்புகள் சாத்தியமாகின்றன, ஏனென்றால் வெளியேறும் குழுவிற்கு எதிர் அமைப்பில் முன்னுரிமையுடன் காரம் தாக்கப்படுகிறது. அதே நிபந்தனைகளும் வினைப்பொருள்களும் தேவை என்பதால் E2 நீக்கம் எப்போதும் SN2 பதிலீட்டு வினைக்கு போட்டியாக நிகழ்கிறது.

நீக்கல் வினையை ஒத்த எதிர்வினையான கூட்டுவினையில் இரட்டை அல்லது முப்பிணைப்புகள் ஒற்றைப் பிணைப்புகளாக மாற்றப்படுகின்றன. பதிலீட்டு வினைகள் போலவே கூட்டு வினைகளிலும் பல்வேறு வகையான வினைகள் வகைப்படுத்தப்படுகின்றன. தாக்கும் பொருளை அடிப்படையாகக் கொண்டே இவ்வினைகள் வகைப்படுத்தப்படுகின்றன. உதாரணமாக ஐதரசன் புரோமைடின் எலக்ட்ரான் கவர் கூட்டு வினையில் எலக்ட்ரான் கவரியான புரோட்டான் இரட்டைப் பிணைப்பைத் தாக்கி கார்பன்நேர்மின் அயனி தோன்றுகிறது. பின்னர் இது கருகவரியான புரோமினுடன் வினைபுரிகிறது. இரட்டைப் பிணைப்பின் இரு முனைகளிலும் அவற்றுடன் இணைந்துள்ள குழுக்களைப் பொறுத்து கார்பன்நேர்மின்னயனி உருவாக முடியும். இதன் எலக்ட்ரான் அமைப்பு முறையை மார்க்கோனிக்காவ் விதியின் மூலம் கணிக்க முடியும் [45]. ஆல்க்கீன் அல்லது ஆல்கைனுடன் ஒரு துருவ மூலக்கூறின் சமச்சீரற்ற கூட்டு வினையில், அதியுயர் மின்னெதிர் தன்மையுள்ள துருவ மூலக்கூறு குறைந்த எண்னிக்கையில் ஐதரசன் அணுக்கள் இணைந்துள்ள கார்பன் அணுவுடன் இணையும் என்று இவ்விதி கூறுகிறது[46].
ஒருவேளை குறைவாக பதிலீடு செயப்பட்ட ஓர் இரட்டைப் பிணைப்பின் கார்பன் அணுவுடன் ஒரு வேதிவினைக் குழு சேர்ந்தால், அமிலங்களுடன் எலக்ட்ரான் கவர் பதிலீட்டு வினைக்கு சாத்தியமில்லை. இந்நிகழ்வில் ஐதரோபோரனேற்ற-ஆக்சிசனேற்ற வினையைப் பயன்படுத்த வேண்டும். முதல்படி நிலையில் போரான் அணுஎலக்ட்ரான் கவரியாகச் செயல்பட்டு குறைவாக பதிலீடு செயப்பட்ட கார்பனுடன் சேர்கிறது.இரண்டாவது படிநிலையில் கருகவர் ஐதரோபெராக்சைடு அல்லது ஆலசன் எதிர்மின்னயனி போரான் அணுவைத் தாக்குகிறது [47].
அதேவேளையில் எலக்ட்ரான் மிகு ஆல்க்கீன்கள் மற்றும் ஆல்க்கைன்களுடன் சேர்வது பிரதானமாக எலக்ட்ரான் கவரி கூட்டு வினைகளாகும். கார்பன்-வேற்றணு பல் பிணைப்புகளில் கருகவர் கூட்டுவினைகள் முக்கியப்பங்கு வகிக்கின்றன. அதிலும் குறிப்பாக கார்பனைல் குழு இதன் மிக முக்கியமான பிரதிநிதியாகும். இச்செயல்முறை பெரும்பாலும் நீக்கல் வினைகளுடன் தொடர்பு கொண்டுள்ளது. எனவே வினை முடிந்தபிறகும் கார்பனைல் குழு மீண்டும் வினைகலவையில் இருக்கிறது. எனவேதான் இவ்வினையை கூட்டு-நீக்க வினை என்கிறார்கள். குளோரைடுகள், எசுத்தர்கள் அல்லது நீரிலிகள் போன்ற கார்பாக்சிலிக் அமில வழிப்பொருள்களில் இவ்வினை தோன்றுகிறது. மேலும் இவ்வினை பெரும்பாலும் அமிலம் அல்லது காரத்தால் வினையூக்கம் செய்யப்படுகிறது. அமிலங்களில் கார்பனைல் குழுக்கள் ஆக்சிசனுடன் பிணைந்து எலக்ட்ரான் கவர்தன்மை மிகுந்துள்ளது. அதேபோல காரங்கள் தாக்கும் கருக் கவரிகளின் கவரும் தன்மையை அதிகரிக்கின்றன [48]

.
கார்பன் எதிர்மின்னயனிகளின் கருகவர் கூட்டுவினை அல்லது ஆல்பா, பீட்டா நிறைவுறா கார்பனைல் சேர்மத்தின் இரட்டைப் பிணைப்புடன் மற்றொரு கருக்கவரி மைக்கேல் வினையின் மூலம் முன்னெடுப்பது முதலியன இணைக் கூட்டுவினைகளாகக் கருதப்படுகின்றன. C–C பிணைப்புகளின் இடை உருவாக்கத்திற்கு இம்முறை மிகுந்த பயனளிக்கும் முறையாக உள்ளது [49][50][51].
கருக்கவரிகள் மற்றும் எலக்ட்ரான் கவரிகளால் நிகழ்த்தப்படாத சில கூட்டு வினைகள் தனி உறுப்புகளால் நிகழ்த்தப்படுகின்றன, தனி உறுப்பு பதிலீடு மூலம் தனி உறுப்பு சேர்வதனால் தொடர் வினைகள் முன்னெடுக்கப்படுகின்றன. இத்தகைய வினைகள் தனி உறுப்பு பலபடியாக்கல் வினைகளுக்கு அடிப்படையாகும்.[52]
பிற கரிமவினை வினைவழிமுறைகள்
[தொகு]
மறுசீரமைப்பு வினையில் ஒரு மூலக்கூறின் கார்பன் கூடு மாறியமைந்து அசல் மூலக்கூறின் அமைப்பு மாற்றியனாக உருவாகிறது. வேக்னர் மீர்வெயின் மறுசீரமைப்பு வினைகள் போன்ற ஐதரைடு நகர்வு வினைகள் இதற்கு உதாரணமாகும். இவ்வினைகளில் ஒரு ஐதரசன், ஆல்க்கைல் அல்லது அரைல் குழு ஒரு கார்பனிலிருந்து அடுத்துள்ள கார்பனுக்கு நகர்கிறது. பெரும்பாலான மறுசீரமைப்பு வினைகளிலும் பழைய பிணைப்புகள் பிரிந்து புதிய கார்பன் – கார்பன் பிணைப்புகள் உருவாகின்றன. கோப் மறுசீரமைப்பு வினை போன்ற சிக்மா மின்னணு நகர்வு வினைகள் இதற்கு உதாரணமாகும் [53].
வளைய கூட்டுவினைகள், பெரிசைக்ளிக் என அழைக்கப்படும் சுற்று வளைய வினைகள் உள்ளிட்ட வினைகள் வளைய மறுசீரமைப்பு வினைகள் என்ற வகையில் அடங்கும். இவ்வகை வினைகளில் இரண்டு அல்லது அதற்கு மேற்பட்ட இரட்டைப் பிணைப்புகள் கொண்ட சேர்மங்கள் ஒரு வளைய மூலக்கூறாக உருவாகின்றன. டையீல்சு- ஆல்டர் வினை வளைய கூட்டு வினைக்கு ஒரு மிக முக்கியமான உதாரணமாகும். இணை டையீனும் பதிலீடு செய்யப்பட்ட ஆல்க்கீனும் சேர்ந்து வளைய எக்சேன் அமைப்பு [4+2] வளையக்கூட்டு என்ற இவ்வினையில் உருவாகிறது[54].
வினையில் ஈடுபடும் வேதி இனங்களின் மின்னணு ஆர்பிட்டல்களை அடிப்படையாகக் கொண்டே வளையக்கூட்டு வினைகள் நிகழ்கின்றன. ஒரேவகை மின்சுமை கொண்ட ஆர்பிட்டல்கள் மட்டுமே மேற்பொருந்தியும் இடைவினை புரிந்தும் புதிய பிணைப்புகளாக உருவாகின்றன. வழக்கமாக வளையக் கூட்டு வினைகளுக்கு வெப்பம் அல்லது ஒளி துணைபுரியும். இக்குழப்பச் செயல்முறையால் கிளர்வு நிலையில் வெவ்வேறு வகையான மறு சீரமைப்புகள் தோன்றுகின்றன. [4+2] டையீல்சு ஆல்டர் வினைக்கு வெப்பமும், [2+2] வளையக் கூட்டு வினைக்கு ஒளியும் துணையாக நிற்பதை இதற்கு உதாரணமாகக் கூறலாம்[55]. உட்வார்டு ஆப்மான் விதி வளையக் கூட்டு வினைகளில் ஆர்பிட்டல்களின் நிலையை விளக்குகிறது[56].
உயிர்வேதியியல் வினைகள்
[தொகு]
உயிர்வேதியியல் வினைகள் முக்கியமாக நொதிகளால் கட்டுப்படுத்தப்படுகின்றன. இந்தப் புரதங்கள் ஒற்றை வினைகளை குறிப்பாக வினையூக்கியாக செயலாற்றி நிகழ்த்துகின்றன. எனவே வினைகள் மிகவும் துல்லியமாக கட்டுப்படுத்தப்படுகின்றன. அமினோ அமில எச்சங்களின் வரிசையிலுள்ள ஒரு பிளவு அல்லது பையில் காணப்படும் நொதியின் ஒரு சிறிய பகுதியில் வினை நிகழ்கிறது. நொதியின் எஞ்சிய பகுதி நிலைநிறுத்துதலுக்கு பயன்படுத்தப்படுகிறது. நொதிகளின் வினையூக்க நடவடிக்கைகள் மூலக்கூறின் வடிவம், பிணைப்பின் திரிபு, புரோட்டான் நன்கொடை அல்லது திரும்பப்பெறுதல், மூலக்கூறுகளின் நோக்குநிலை போன்ற காரணிகளைச் சார்ந்தே நிகழ்கின்றன [57].
உயிர் வாழ்வனவற்றில் ஏற்படும் உயிர்வேதியியல் வினைகள் ஒட்டுமொத்தமாக வளர்சிதை மாற்றம் என்ற செயலால் அறியப்படுகின்றன. இதன் இயங்கமைப்பில் மிகவும் முக்கியமானதாகக் கருதப்படுவது உட்சேர்க்கையாகும். இதில் பல்வேறு டி.என்.ஏ மற்றும் நொதிகளால் கட்டுப்படுத்தப்படும் செயல்முறைகள் வழியாக சிறிய அலகுகளிலிருந்து புரதங்கள் மற்றும் கார்போவைதரேட்டுகள் போன்ற பெரிய மூலக்கூறுகள் உற்பத்தி செய்யப்படுகின்றன [58]. உயிரிய ஆற்றலியல் துறை இத்தகைய வினைகளுக்கான ஆற்றல் மூலத்தை ஆய்வு செய்கிறது. குளுக்கோசு ஒரு முக்கியமான ஆற்றல் மூலமாகக் கருதப்படுகிறது. இது தாவரங்களின் ஒளிச்சேர்க்கையால் உற்பத்தி செய்யப்படுகிறது. அல்லது உணவு செரித்தலால் தோன்றுகிறது. எல்லா உயிரினங்களும் இவ்வாற்றலைப் பயன்படுத்தி அடினோசின் டிரைபாசுபேட்டை உற்பத்தி செய்து மற்ற செயல்பாடுகளுக்கு தேவையான ஆற்றலாகப் பயன்படுத்துகின்றன.
பயன்பாடுகள்
[தொகு]
வேதியியல் வினைகள் யாவும் இரசாயனப் பொறியியல் துறைக்கு மையமாக இருக்கின்றன, அவை இயற்கை மூலப்பொருட்களான பெட்ரோலிய மற்றும் கனிம தாதுக்கள் போன்ற புதிய சேர்மங்களைத் தொகுப்பதற்கு பயன்படுத்தப்படுகின்றன. வினையை செயல்திறன் மிக்கதாகவும், விளைபொருட்களின் அளவை அதிகரிக்கவும், ஆற்றல் உள்ளீடுகள் மற்றும் கழிவுகளை குறைக்கவும் வேதிவினைகள் அவசியமாகின்றன. வினைத்திறனுக்குத் தேவைப்படும் ஆற்றலை குறைப்பதற்கும், வினை வேகத்தை அதிகரிக்கவும் வினையூக்கிகள் பெரிதும் உதவியாக இருக்கின்றன[59][60].
மேற்பார்வையிடுதல்
[தொகு]வினைவழிமுறைகளை மேற்பார்வையிடுவது வேதிவினைகளின் வினைவேகத்தைச் சார்ந்துள்ளது. ஒப்பீட்டளவில் மெதுவாக நிகழும் செயல்முறைகள் தனிப்பட்ட வேதிப் பொருட்களின் செறிவு மற்றும் அடையாளங்களை வினைத் தளத்திலேயே பகுப்பாய்வு செய்யமுடியும். உண்மையான நிகழ் நேரப் பகுப்பாய்வுகளுக்கு முக்கிய கருவிகள் pH அளவீடு மற்றும் ஒளியியல் உறிஞ்சுதல் (நிறம்) மற்றும் உமிழ்வு நிறமாலை பகுப்பாய்வு போன்ற முறைகள் பயனாகின்றன. கதிரியக்க ஐசோடோப்புகளை பயன்படுத்தி செய்யப்படும் பகுப்பாய்வுகள் மிகத்துல்லியமான அளவீடுகளை அளிக்கின்றன. வேகவினைகள் அதிவேக சிரொளி நிறமாலை நுட்பம் மூலமாக ஆராயப்படுகின்றன [61].
மேற்கோள்கள்
[தொகு]- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "chemical reaction". Compendium of Chemical Terminology Internet edition.
- ↑ Weyer, J. (1973). "Neuere Interpretationsmöglichkeiten der Alchemie". Chemie in unserer Zeit 7 (6): 177–181. doi:10.1002/ciuz.19730070604.
- ↑ Friedman, Leonard J.; Friedman, Samantha J. (2008). The History of the Contact Sulfuric Acid Process (PDF). Boca Raton, Florida: Acid Engineering & Consulting, Inc.
- ↑ Stranges, Anthony N. (2000). "The German Chemical Industry in the Twentieth Century".. Ed. Lesch, John E.. Kluwer Academic Publishers. பன்னாட்டுத் தரப்புத்தக எண் 0-7923-6487-2.
- ↑ Brock, pp. 34–55
- ↑ Brock, pp. 104–107
- ↑ IUPAC Compendium of Chemical Terminology
- ↑ Myers, Richard (2009). The Basics of Chemistry. Greenwood Publishing Group. p. 55. பன்னாட்டுத் தரப்புத்தக எண் 0313316643.
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "chemical reaction equation". Compendium of Chemical Terminology Internet edition.
- ↑ Corey, E. J. (1988). "Robert Robinson Lecture. Retrosynthetic thinking?essentials and examples". Chemical Society Reviews 17: 111. doi:10.1039/CS9881700111. https://archive.org/details/sim_chemical-society-great-britain-chemical-society-reviews_1988-06_17_2/page/111.
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "elementary reaction". Compendium of Chemical Terminology Internet edition.
- ↑ Frenking, Gernot (2006). "Römpp Chemie-Lexikon".. Thieme.
- ↑ Atkins, p. 114.
- ↑ Atkins, pp. 106–108
- ↑ 15.0 15.1 Reaction Web
- ↑ Atkins, p. 150
- ↑ 17.0 17.1 17.2 To react or not to react? பரணிடப்பட்டது 2015-01-10 at the வந்தவழி இயந்திரம் Utah State Office of Education. Retrieved 4 June 2011.
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "decomposition". Compendium of Chemical Terminology Internet edition.
- ↑ 19.0 19.1 The six types of reaction – The Cavalcade o' Chemistry. Retrieved 11 February 2016
- ↑ Glusker, Jenny P. (1991). "Advances in Protein Chemistry". 42. Ed. Christian B. Anfinsen. San Diego: Academic Press. பன்னாட்டுத் தரப்புத்தக எண் 0-12-034242-1.
- ↑ Guo, Liang-Hong (1991). "Advances in Inorganic Chemistry". 36. Ed. A. G. Sykes. San Diego: Academic Press. பன்னாட்டுத் தரப்புத்தக எண் 0-12-023636-2.
- ↑ Wiberg, pp. 289–290
- ↑ Wiberg, p. 409
- ↑ Wiberg, pp. 1180–1205
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "conjugate acid–base pair". Compendium of Chemical Terminology Internet edition.
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "precipitation". Compendium of Chemical Terminology Internet edition.
- ↑ Wingender, Jörg (July 2009). "Römpp Chemie-Lexikon".. Thieme.
- ↑ Meyer, H. Jürgen (2007). "Modern Inorganic Chemistry". (3rd). Ed. Erwin Riedel. de Gruyter. பன்னாட்டுத் தரப்புத்தக எண் 978-3-11-019060-1.
- ↑ Wintterlin, J. (1997). "Atomic and Macroscopic Reaction Rates of a Surface-Catalyzed Reaction". Science 278 (5345): 1931–4. doi:10.1126/science.278.5345.1931. பப்மெட்:9395392. Bibcode: 1997Sci...278.1931W.
- ↑ Waldmann, T.; Künzel, D.; Hoster, H. E.; Groß, A.; Behm, R. J. R. (2012). "Oxidation of an Organic Adlayer: A Bird's Eye View". Journal of the American Chemical Society 134 (21): 8817–8822. doi:10.1021/ja302593v. பப்மெட்:22571820.
- ↑ Atkins, pp. 937–950
- ↑ Kandori, Hideki (2006). "Cis-trans Isomerization in Biochemistry".. Ed. Dugave, Christophe. Wiley-VCH. பன்னாட்டுத் தரப்புத்தக எண் 3-527-31304-4.
- ↑ Saunders, David Stanley (2002). Insect clocks (Third ed.). Amsterdam: எல்செவியர். p. 179. பன்னாட்டுத் தரப்புத்தக எண் 0-444-50407-9.
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "catalyst". Compendium of Chemical Terminology Internet edition.
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "inhibitor". Compendium of Chemical Terminology Internet edition.
- ↑ Elschenbroich, Christoph (2008). Organometallchemie (6th ed.). Wiesbaden: Vieweg+Teubner Verlag. p. 263. பன்னாட்டுத் தரப்புத்தக எண் 978-3-8351-0167-8.
- ↑ 37.0 37.1 March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, பன்னாட்டுத் தரப்புத்தக எண் 0-471-85472-7
- ↑ Hartshorn, S. R. (1973). Aliphatic Nucleophilic Substitution. London: கேம்பிறிட்ஜ் பல்கலைக்கழகப் பதிப்பகம். p. 1. பன்னாட்டுத் தரப்புத்தக எண் 0-521-09801-7.
- ↑ Bateman, Leslie C.; Church, Mervyn G.; Hughes, Edward D.; Ingold, Christopher K.; Taher, Nazeer Ahmed (1940). "188. Mechanism of substitution at a saturated carbon atom. Part XXIII. A kinetic demonstration of the unimolecular solvolysis of alkyl halides. (Section E) a general discussion". Journal of the Chemical Society: 979. doi:10.1039/JR9400000979.
- ↑ Brückner, pp. 63–77
- ↑ Brückner, pp. 203–206
- ↑ Brückner, p. 16
- ↑ Brückner, p. 192
- ↑ Brückner, p. 183
- ↑ Wiberg, pp. 950, 1602
- ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "Markownikoff rule". Compendium of Chemical Terminology Internet edition.
- ↑ Brückner, p. 125
- ↑ Latscha, Hans Peter; Kazmaier, Uli; Klein, Helmut Alfons (2008). Organische Chemie: Chemie-basiswissen II (in German). Vol. 2 (6th ed.). Springer. p. 273. பன்னாட்டுத் தரப்புத்தக எண் 978-3-540-77106-7.
{{cite book}}: CS1 maint: unrecognized language (link) - ↑ Organic Reactions. 2004. doi:10.1002/0471264180. பன்னாட்டுத் தரப்புத்தக எண்:0-471-26418-0.
- ↑ Hunt, Ian. "Chapter 18: Enols and Enolates — The Michael Addition reaction". University of Calgary.
- ↑ Brückner, p. 580
- ↑ Lechner, Manfred; Gehrke, Klaus; Nordmeier, Eckhard (2003). Macromolecular Chemistry (3rd ed.). Basel: Birkhäuser. pp. 53–65. பன்னாட்டுத் தரப்புத்தக எண் 3-7643-6952-3.
- ↑ Fox, Marye Anne; Whitesell, James K. (2004). Organic chemistry (Third ed.). Jones & Bartlett. p. 699. பன்னாட்டுத் தரப்புத்தக எண் 0-7637-2197-2.
- ↑ Diels, O. .; Alder, K. . (1928). "Synthesen in der hydroaromatischen Reihe". Justus Liebig's Annalen der Chemie 460: 98–122. doi:10.1002/jlac.19284600106.
- ↑ Brückner, pp. 637–647
- ↑ Woodward, R. B.; Hoffmann, R. (1965). "Stereochemistry of Electrocyclic Reactions". Journal of the American Chemical Society 87 (2): 395–397. doi:10.1021/ja01080a054.
- ↑ Karlson, Peter; Doenecke, Detlef; Koolman, Jan; Fuchs, Georg; Gerok, Wolfgang (2005). Karlson Biochemistry and Pathobiochemistry (in German) (16th ed.). Thieme. pp. 55–56. பன்னாட்டுத் தரப்புத்தக எண் 978-3-13-357815-8.
{{cite book}}: CS1 maint: unrecognized language (link) - ↑ தனி மற்றும் பயன்பாட்டு வேதியியல் அனைத்துலக ஒன்றியம். "anabolism". Compendium of Chemical Terminology Internet edition.
- ↑ Emig, Gerhard; Klemm, Elias (2005). Technical Chemistry (in German) (5th ed.). Springer. pp. 33–34. பன்னாட்டுத் தரப்புத்தக எண் 978-3-540-23452-4.
{{cite book}}: CS1 maint: unrecognized language (link) - ↑ Trost, B. (1991). "The atom economy--a search for synthetic efficiency". Science 254 (5037): 1471–7. doi:10.1126/science.1962206. பப்மெட்:1962206. Bibcode: 1991Sci...254.1471T.
- ↑ Atkins, p. 987














![{\displaystyle v=-{\frac {d[{\ce {A}}]}{dt}}=k\cdot [{\ce {A}}].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12291760fcaff20a02ff74abd0dfcb922664cddb)
![{\displaystyle {\ce {[A]}}(t)={\ce {[A]}}_{0}\cdot e^{-k\cdot t}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/498c37558508e2f7297604f93bb5408dcd8c3fd4)

















