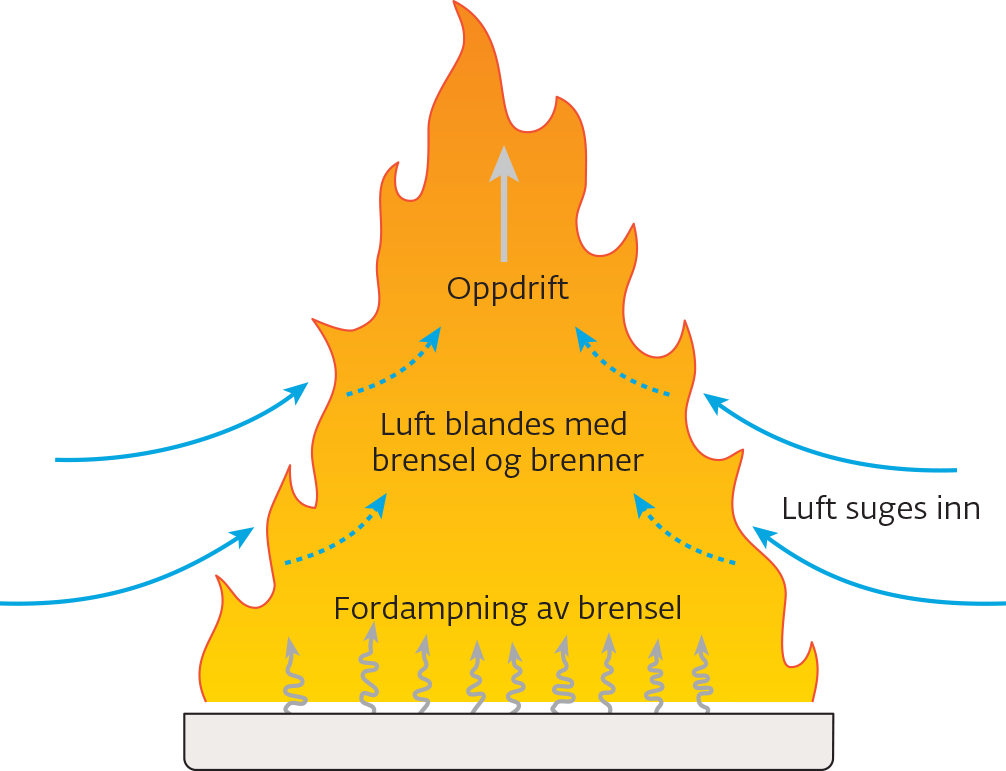
Ved eller koks i en ovn reagerer med oksygengass i luften i en rask forbrenningsprosess. Forbrenningen skjer raskere og mer voldsomt i oksygengass enn i luft. En trepinne som gløder i luft, vil flamme opp i ren oksygengass.
Med overskudd av oksygengass er forbrenningsproduktene vann og karbondioksid. Ved underskudd av oksygengass kan det dannes sot, karbonmonoksid og polysykliske aromatiske hydrokarboner (PAH).
For å få et stoff til å brenne, må det få en temperatur som er over tenntemperaturen for stoffet. Noen eksempler er gitt i tabellen nedenfor.
Tenntemperaturen for et stoff avhenger av hvor finfordelt stoffet er. Forbrenningen av sagspon starter lettere enn et stykke tre, og sagmugg tennes så lett at det kan tenne ved romtemperatur. Temperaturen som forbrenning til slutt foregår ved, er vesentlig høyere enn tenntemperaturen.
Er tenntemperaturen til et stoff lavere enn vanlig romtemperatur, tennes stoffet spontant når det kommer i berøring med luft. Slike stoffer sier man er selvantennelige (pyrofore). Et eksempel er fosfin. Finpulverisert jern kan begynne å gløde i luft ved romtemperatur. Det gjelder også flere andre metaller.
Eksplosjon og detonasjon er forbrenningsprosesser som foregår særlig raskt. Se sprengstoff.







Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.