ڪيميائي بانڊ
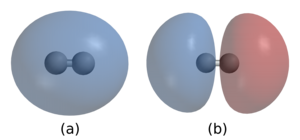
ڪيميائي بانڊ (Chemical Bond) اھا قوت يا ڪشش آهي جيڪا ماليڪيولن ۾ ائٽمن کي ملائي رکندي آهي.
هڪ ڪيميائي بانڊ (Chemical Bond) ائٽمن يا آئن جو اتحاد آهي جيڪو ماليڪيول، ڪرسٽل ۽ ٻيون اڏاوتون ٺاهين ٿا. بانڊ مخالف طور تي چارج ٿيل آئنز جي وچ ۾ برقياتي قوت جي نتيجي ۾، جيئن آئني بانڊ ۾ يا اليڪٽران جي حصيداري جي ذريعي جيئن ڪوويلنٽ بانڊ ۾، يا انهن اثرات جي ڪجهه ميلاپ جي ذريعي ٿي سگھي ٿو. ڪيميائي بانڊن کي مختلف طاقتن جي طور تي بيان ڪيو ويو آهي: هتي ”مضبوط بانڊ“ يا ”پرائمري بانڊ“ جهڙوڪ ڪوويلنٽ، آئني ۽ ڌاتي بانڊ ۽ ”ڪمزور بانڊ“ يا ”ثانوي بانڊ“ جهڙوڪ ڊيپول-ڊيپول تعامل، لنڊن ڊسپريشن فورس ۽ هائيڊروجن بانڊنگ.
جيئن ته مخالف برقي چارجز هڪ ٻئي جي طرف متوجه ٿين ٿا، ان ڪري مرڪز جي چوڌاري منفي چارج ٿيل اليڪٽران ۽ نيوڪليئس جي اندر مثبت طور تي چارج ٿيل پروٽان هڪ ٻئي کي متوجه ڪن ٿا. ٻن مرڪزن جي وچ ۾ ورهايل اليڪٽران انهن ٻنهي ڏانهن متوجه ٿيندا. "تعميراتي ڪوانٽم ميڪينيڪل موج فنڪشن مداخلت" [1] جوڙيل نيوڪلئيس کي مستحڪم ڪري ٿو (ڏسو ڪيميائي بانڊنگ جا نظريا). بانڊڊ نيوڪليئس هڪ بهترين فاصلو برقرار رکن ٿا (بانڊ جو فاصلو) جيڪا ڪشش ۽ رد ڪندڙ اثرن کي مقداري طور تي ڪوانٽم ٿيوري جي وضاحت سان، توازن ۾ رکي ٿو.[2][3]
ماليڪيولز، ڪرسٽل، ڌاتن ۽ مادي جي ٻين شڪلين ۾ ايٽم ڪيميائي بانڊن سان گڏ رکيل آهن، جيڪي مادي جي ساخت ۽ خاصيت کي طئي ڪن ٿا.
سڀ بانڊ ڪوانٽم ٿيوري ذريعي بيان ڪري سگھجن ٿا، پر عملي طور تي، سادا ضابطا ۽ ٻيا نظريا ڪيميادان کي اجازت ڏين ٿا ته هو بانڊن جي قوت، سمت ۽ قطبيت جي اڳڪٿي ڪن.[4] اٺ (octet) جو قاعدو ۽ VSEPR نظريو هن جي مثالون آهن. وڌيڪ نفيس نظريا ويلنس بانڊ ٿيوري، جن ۾ مداري هائيبرڊائيزيشن ۽ گونج شامل آهن ۽ ماليڪيولر آربيٽل ٿيوري، جنهن ۾ ايٽمي مدار ۽ ليگينڊ فيلڊ ٿيوري جو لڪيري ميلاپ شامل آهي، octet قاعدو ۽ VSEPR نظريو مثال آهن. وڌيڪ نفيس نظريا ويلنس بانڊ ٿيوري آهن، جن ۾ مداري هائيبرڊائيزيشن [5] ۽ گونج (Resonance) [6] شامل آهن، ۽ ماليڪيولر آربيٽل ٿيوري [7] جنهن ۾ ايٽمي مدار ۽ ليگينڊ فيلڊ ٿيوري جو لڪيري ميلاپ شامل آهي، آهن. برق سڪونيات (Electrostatics)، بانڊ جي قطبيت ۽ انهن جا اثر جيڪي ڪيميائي مادن تي آهن، کي بيان ڪرڻ لاءِ استعمال ڪيا ويا آهن.
ڪيميائي بانڊ جي مکيه قسمن جو جائزو
[سنواريو]تاريخ
[سنواريو]ڪيميائي فارمولن ۾ بانڊ
[سنواريو]مضبوط ڪيميائي بانڊ
[سنواريو]انٽر-ماليڪيولر بانڊ
[سنواريو]ڪيميائي بانڊ جا نظريا
[سنواريو]پڻ ڏسو
[سنواريو]خارجي لنڪس
[سنواريو]| وڪي قول ۾ ڪيميائي بانڊ جي متعلق قول موجود آھي۔ |
| وڪيميڊيا العام ۾ ڪيميائي بانڊ سان لاڳاپيل ابلاغي مواد ڏسو. |
- W. Locke (1997). Introduction to Molecular Orbital Theory. Retrieved May 18, 2005.
- Carl R. Nave (2005). HyperPhysics. Retrieved May 18, 2005.
- Linus Pauling and the Nature of the Chemical Bond: A Documentary History. Retrieved February 29, 2008.
حوالا
[سنواريو]- ↑ Levine, Daniel S.; Head-Gordon, Martin (2020-09-29). "Clarifying the quantum mechanical origin of the covalent chemical bond". Nature Communications (Springer Science and Business Media LLC) 11 (1): 4893. doi:. ISSN 2041-1723. PMID 32994392.
- ↑ Pauling, L., "The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules", Journal of the American Chemical Society (4): 1367–1400, doi:10.1021/ja01355a027
- ↑ Hund, F. (1928). "Zur Deutung der Molekelspektren. IV" (de ۾). Zeitschrift für Physik 51 (11–12): 759–795. doi:. ISSN 1434-6001. Bibcode: 1928ZPhy...51..759H. http://link.springer.com/10.1007/BF01400239.
- ↑ Frenking, Gernot; Krapp, Andreas (2007-01-15). "Unicorns in the world of chemical bonding models" (en ۾). Journal of Computational Chemistry 28 (1): 15–24. doi:. PMID 17109434.
- ↑ Jensen, Frank (1999). Introduction to Computational Chemistry. John Wiley and Sons. ISBN 978-0-471-98425-2.
- ↑ Pauling, Linus (1960). "The Concept of Resonance". The Nature of the Chemical Bond – An Introduction to Modern Structural Chemistry (3rd ed.). Cornell University Press. pp. 10–13. ISBN 978-0801403330. https://books.google.com/books?id=L-1K9HmKmUUC&pg=PA10.
- ↑ Gillespie, R.J., "Teaching molecular geometry with the VSEPR model", Journal of Chemical Education (3): 298–304, Bibcode:2004JChEd..81..298G, doi:10.1021/ed081p298 Unknown parameter
|doi-access=ignored (مدد)

