Metaal
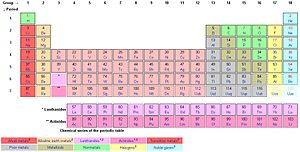

In de scheikunde is een metaal een van de 62 scheikundig elementen uit een van de volgende reeksen in het periodiek systeem der elementen:
- zes alkalimetalen (groep 1)
- zes aardalkalimetalen (groep 2)
- 38 overgangsmetalen (groep 3 t/m 12)
- twaalf hoofdgroepmetalen (gedeeltelijk groep 13 t/m 16)
In het periodiek systeem bevinden al deze elementen zich links van de semi-metalen, of metalloïden. De metalloïden liggen op een diagonale lijn, van boor (B) tot astaat (At).
In de materiaalkunde worden daarnaast ook metaalmengsels, met name intermetallische verbindingen en legeringen, als metaal aangeduid. Metalen zijn dan alle materialen met, in vaste of vloeibare vorm, de volgende vier karakteristieke materiaaleigenschappen:
- hoge elektrische geleiding, die afneemt met toenemende temperatuur;
- hoge warmtegeleiding;
- ductiliteit (vervormbaarheid);
- metaalglans.
Bekende metaalsoorten zijn: ijzer, aluminium, koper, chroom, nikkel, lood, zink, tin, goud, zilver en platina. Bekende legeringen: staal (bijvoorbeeld inox), brons, messing, elektrum en soldeersel.
Eigenschappen van metalen
[bewerken | brontekst bewerken]Chemische eigenschappen
[bewerken | brontekst bewerken]De belangrijkste metaaleigenschap is de lage elektronegativiteit. Door deze lage elektronegativiteit binden de in een kristalrooster gerangschikte metaalatomen hun elektronen niet sterk aan de atoomkern. Het kristalrooster van metalen bestaat daardoor uit positief geladen ionen met geleidingselektronen, de valentie-elektronen, die er los tussen bewegen. Dit verklaart de elektrische geleidbaarheid van metalen. Doordat ze gemakkelijk elektronen afstaan zijn metalen sterke reductoren: in redoxreacties staan metaalatomen hun vrije elektronen af aan oxidatoren, waarbij een zout gevormd wordt.
Alleen edelmetalen als goud en zilver komen door hun lage chemische reactiviteit in zuivere gedegen vorm in de natuur voor. De meeste andere metalen moeten uit hun mineraal gewonnen worden, bijvoorbeeld ijzer uit ijzerhoudende mineralen en koper uit koperhoudende mineralen; het werk van de metallurgie. Metalen uit de reeksen van de alkalimetalen (zoals natrium) en aardalkalimetalen (magnesium) zijn zeer reactief. Deze metalen vormen 1+ en 2+ positief geladen ionen die de elektronen uit hun s-schillen kwijt zijn. Zouten van deze metalen zijn over het algemeen goed oplosbaar in water, vooral de zouten van alkalimetalen. De ionen van cesium-137 en -135 en van strontium-90, die als bijproduct gevormd worden bij het radioactief verval tijdens de opwekking van kernenergie, verspreiden zich daarom gemakkelijk in het milieu als ze vrijkomen.
Metalen die niet reageren met zuurstof en water geen corrosie vertonen, noemt de metaalkunde edel. Onedele metalen vertonen corrosie. Zeer onedele metalen als natrium en kalium reageren zelfs heftig met water. In de materiaalkunde (metaalkunde) spelen ze dan ook geen rol.
De overgangsmetalen uit de platinagroep en kopergroep zijn relatief inert. De edelmetalen uit periode-5 en 6 van deze groepen, zoals goud, zilver en platina, zijn chemisch vrijwel volledig inert. Ze reageren net als de edelgassen met vrijwel geen enkele stof.
Een verschijnsel dat bij metalen op kan treden: metaalhaartjes, dit zijn zeer kleine haarvormige uitgroeiingen, monokristallen van bepaalde metalen, zoals tin, zink en cadmium.
Fysische en mechanische eigenschappen
[bewerken | brontekst bewerken]
Metalen hebben een aantal kenmerkende fysische en mechanische eigenschappen:
- meestal een glimmend oppervlak
- een hoge taaiheid en vervormbaarheid
- meestal een hoog smeltpunt; met uitzondering van kwik en gallium zijn alle metalen in vaste toestand bij kamertemperatuur
- ze zijn goede geleiders van warmte en elektriciteit
Deze eigenschappen zijn hoofdzakelijk het gevolg van het feit dat de elektronen op de buitenste elektronenschil zeer los gebonden zijn. In een metaalkristal worden deze valentie-elektronen dan ook gedeeld over de atomen in het volledige kristalrooster, zodat sprake is van een gemeenschappelijke elektronenwolk (valentieband).
IJzer, nikkel, kobalt en enkele metaallegeringen kunnen worden gemagnetiseerd.
Legeringen
[bewerken | brontekst bewerken]Een legering is een mengsel van metalen. Een legering kan ook wel niet-metalen bevatten. Legeringen worden geproduceerd om aan metalen de gewenste eigenschappen, zoals hardheid en smeedbaarheid te verschaffen. In de bronstijd (± 2000 - 1000 voor Chr.) wist men reeds hoe men van koper een legering kon maken die gemakkelijker te bewerken was door er tin aan toe te voegen. Deze legering heet brons.
Productie van metaal
[bewerken | brontekst bewerken]Met uitzondering van edelmetalen worden metalen in de natuur zelden in zuivere vorm gevonden. Zuiver aangetroffen metaal wordt ook wel gedegen metaal genoemd. Metalen worden meestal gedolven in de vorm van ertsen, die in de metallurgie worden omgezet in de zuivere metaalvorm. Voorbeelden hiervan zijn de winning van gietijzer uit ijzererts door middel van hoogovens of de elektrochemische omzetting van bauxiet in aluminium.
Ferro- en non-ferrometalen
[bewerken | brontekst bewerken]In de metaalhandel wordt onderscheid gemaakt tussen de ferrometalen en non-ferrometalen. IJzer en alle legeringen op basis van ijzer, waarvan staal de bekendste is, worden ferrometalen genoemd, de overige metalen, zoals aluminium, goud en koper, zijn de non-ferrometalen.
Ferromagnetisme
[bewerken | brontekst bewerken]Hoewel veel metalen magnetisch gedrag vertonen, worden er maar een paar soorten direct aangetrokken door een magneet. Dit verschijnsel heet ferromagnetisme ("ferro" van ijzer). Het bekendste ferromagnetische metaal is ijzer, maar ook metalen als kobalt en nikkel vertonen deze eigenschap.
Toepassingen
[bewerken | brontekst bewerken]
Metalen hebben zeer veel toepassingen. Onderstaande lijst dient enkel om een indruk te geven van de veelzijdigheid van metalen. Zo worden zij toegepast in:
- constructies, machines en vervoermiddelen (staal, aluminium, zink, magnesium)
- verpakkingsmateriaal zoals blik voor conserven, drank en verf (tin, aluminium)
- elektrische verbindingen (koper, goud, zilver)
- kwikbarometers en thermometers (kwik)
- magneten (ijzer, nikkel, neodymium, kobalt)
- pigmenten (lood, kwik, cadmium)
- ballast in de kiel van schepen, of als contragewicht (lood, wolfraam, uranium)
- projectielen en slagwapens (koper, lood, wolfraam, uranium)
- chemische katalysatoren (rodium, ruthenium, palladium)
- kunstvoorwerpen (goud, zilver, koper, tin)
- belegging (edelmetalen) en betaalmiddel (goud, zilver, nikkel, koper)
- geneesmiddel (lithium, technetium, platina)
- vergif (arseen, thallium)
Edele en onedele metalen
[bewerken | brontekst bewerken]De metalen die vooraan in groep 1 van het periodiek systeem staan zijn zeer onedel: ze reageren zeer gemakkelijk, worden vlot geoxideerd en komen daardoor ook alleen maar als chemische verbinding in de natuur voor. Natrium en kalium reageren zeer heftig met water onder vorming van waterstofgas en warmte (vaak met brand tot gevolg), en moeten in hun elementaire toestand bewaard worden onder petroleum of minerale olie. De metalen uit groep 1 worden de alkalimetalen genoemd.
De metalen uit groep 2 van het periodiek systeem zijn minder reactief: ze reageren veel minder uitgesproken met water, maar komen ook niet in elementaire vorm voor in de natuur. Voorbeelden zijn: magnesium, calcium, barium en strontium, waarvan calcium het minst edel uit die reeks is. Deze groep metalen worden aangeduid als de aardalkalimetalen. Ook aluminium is onedel en reageert gemakkelijk met zowel sterke als zwakke zuren en basen. IJzer is relatief onedel: in zuurstof- en waterrijke omgevingen wordt ijzer geoxideerd tot overeenkomstige ijzeroxide. Dit verschijnsel staat bekend als roest.
Metalen kunnen ook halfedel zijn, ze komen soms in de vrije natuur als element voor, maar kunnen ook nog redelijk makkelijk in ionaire toestand over gaan. Enkele voorbeelden van halfedele metalen zijn: koper, lood, nikkel, cadmium, kobalt en zink. Om deze metalen te doen overgaan in oplossing is een sterke (zure) oxidator (zoals zwavelzuur) nodig.
Zeer edele metalen komen meestal in de natuur als element voor, ze zijn relatief zeldzaam en vormen minder snel een zout. Om edele metalen te doen overgaan in een zout is een zeer sterke oxidator nodig, zoals nitrosylchloride in koningswater. Voorbeelden zijn: zilver, goud en platina. In deze reeks is zilver het minst en goud het meest edel.
Het edele dan wel onedele karakter van een metaal kan op elektrochemische wijze in verband worden gebracht met diens standaardelektrodepotentiaal: metalen met een sterk negatieve standaardelektrodepotentiaal, zoals lithium en kalium, worden zeer vlot geoxideerd, terwijl metalen met een positieve standaardelektrodepotentiaal, zoals goud en zilver, veel moeizamer geoxideerd worden.

