페닐알라닌
 L-페닐알라닌의 골격 구조식
| |||
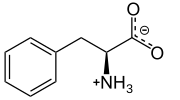 생리학적 pH에서의 L-페닐알라닌
| |||
| |||
| 이름 | |||
|---|---|---|---|
| 발음 | US: /ˌfɛnəlˈæləniːn/, UK: /ˌfiːnaɪl-/ | ||
| IUPAC 이름
phenylalanine
| |||
| 체계명
(S)-2-amino-3-phenylpropanoic acid | |||
| 식별자 | |||
3D 모델 (JSmol)
|
| ||
| ChEBI |
| ||
| ChEMBL |
| ||
| ChemSpider | |||
| DrugBank |
| ||
| ECHA InfoCard | 100.000.517 | ||
| |||
| KEGG |
| ||
PubChem CID
|
|||
| UNII |
| ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| C9H11NO2 | |||
| 몰 질량 | 165.192 g·mol−1 | ||
| 산성도 (pKa) | 1.83 (카복실기), 9.13 (아미노기)[2] | ||
| 위험 | |||
| NFPA 704 (파이어 다이아몬드) | |||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
페닐알라닌(영어: phenylalanine) (기호: Phe or F)[3]은 단백질의 생합성에 사용되는 α-아미노산이다. 페닐알라닌은 α-아미노기(생물학적 조건에서 양성자화된 −NH3+ 형태), α-카복실기(생물학적 조건에서 탈양성자화된 −COO− 형태) 및 곁사슬인 벤질기를 포함하고 있다. 페닐알라닌은 곁사슬인 벤질기의 불활성 및 소수성으로 인해 중성 및 비극성으로 분류되는 방향족 아미노산이다. L-페닐알라닌은 DNA에 의해 암호화되는 단백질을 생화학적으로 생성하는 데 사용된다. 페닐알라닌은 티로신, 모노아민 신경전달물질인 도파민, 노르에피네프린(노르아드레날린), 에피네프린(아드레날린) 및 피부 색소인 멜라닌의 전구체이다. 페닐알라닌은 UUU, UUC 코돈에 의해 암호화되어 있다.
페닐알라닌은 포유류의 젖에서 자연적으로 발견된다. 페닐알라닌은 식품 및 음료의 제조에 사용되며, 진통 및 항우울 효과를 위한 영양 보충제로 판매된다. 페닐알라닌은 일반적으로 사용되는 식이 보충제로 신경조절물질인 펜에틸아민의 직접적인 전구체이다. 필수 아미노산인 페닐알라닌은 페닐알라닌이나 페닐알라닌 함유 단백질을 섭취해야 하는 사람과 다른 동물들에서 신생합성되지 않는다.
역사
[편집]페닐알라닌에 대한 최초의 설명은 1879년에 에른스트 슐츠와 바르비에리(Barbieri)가 루피누스 루테우스(Lupinus luteus) 묘목에서 실험식이 C9H11NO2인 화합물을 확인했을 때 이루어졌다. 1882년에 에밀 에를렌마이어와 리프()는 페닐아세트알데하이드, 사이안화 수소 및 암모니아로부터 페닐알라닌을 최초로 합성했다.[4][5]
페닐알라닌의 코돈은 1961년에 요하네스 하인리히 마테이와 마셜 워런 니런버그에 의해 처음으로 발견되었다. 그들은 mRNA를 사용하여 대장균의 게놈에 유라실 염기를 반복적으로 삽입함으로써 대장균이 반복되는 페닐알라닌으로만 구성된 폴리펩타이드를 생성하도록 할 수 있음을 보여주었다. 이러한 발견은 게놈에 저장된 정보와 살아 있는 세포에서의 단백질 발현을 연결하는 암호화 관계의 본질을 확립하는 데 도움이 되었다.
식이 공급원
[편집]페닐알라닌의 좋은 식이 공급원으로는 계란, 닭고기, 간, 쇠고기, 우유 및 콩이 있다.[6] 페닐알라닌의 또 다른 일반적인 공급원으로는 다이어트 음료, 다이어트 식품, 약물과 같은 인공 감미료인 아스파르탐으로 단맛을 낸 모든 것들이 있다. 아스파르탐의 대사로 인해 화합물의 대사 산물 중 하나인 페닐알라닌이 생성된다.[7]
식이 권장사항
[편집]미국 의학 연구소의 식품 영양 위원회(FNB)는 2002년에 필수 아미노산에 대한 권장 식이 허용량(RDA)을 제정했다.19세 이상의 성인의 경우 매일 체중 1 kg당 33 mg의 페닐알라닌 및 티로신이 필요하다.[8]
기타 생물학적 역할
[편집]L-페닐알라닌은 생물학적으로 DNA에 의해 암호화되는 아미노산 중 하나인 L-티로신으로 전환된다. L-티로신은 차례로 L-도파로 전환되고, 이는 추가적으로 도파민, 노르에피네프린(노르아드레날린) 및 에피네프린(아드레날린)으로 전환된다. 후자의 세 가지 화합물은 카테콜아민으로 알려져 있다.
페닐알라닌은 트립토판과 동일한 능동 수송 운반체를 사용하여 혈액뇌장벽을 통과한다. 과량의 보충은 관련 보조 인자, 철 또는 테트라하이드로비오프테린의 남용(결국 제한된 가용성)으로 인해 세로토닌 및 다른 방향족 아미노산[9] 및 산화 질소의 생성을 방해할 수 있다. 이들 화합물에 상응하는 효소는 방향족 아미노산 하이드록실화효소 계열과 산화 질소 생성효소이다.
 |
식물에서
[편집]페닐알라닌은 플라보노이드의 생합성에 사용되는 출발 물질이다. 리그난은 페닐알라닌과 티로신으로부터 유도된다. 페닐알라닌은 페닐알라닌 암모니아-분해효소에 의해 신남산으로 전환된다.[10]
생합성
[편집]페닐알라닌은 시킴산 경로를 통해 생합성된다.
페닐케톤뇨증
[편집]유전 질환인 페닐케톤뇨증(PKU)은 페닐알라닌 하이드록실화효소의 결핍으로 인해 페닐알라닌을 대사할 수 없는 질환이다. 이러한 증상은 페닐케톤뇨증으로 알려져 있으며, 페닐알라닌의 섭취를 조절해야 한다. 페닐케톤뇨증에 대해서는 보통 혈액 검사를 통해 혈액 내의 페닐알라닌의 양을 모니터링한다. 검사 결과는 mg/dL 및 μmol/L를 사용하여 페닐알라닌의 수치를 보고할 수 있다. 페닐알라닌 1 mg/dL은 대략 60 μmol/L에 해당한다.
고페닐알라닌혈증이라고 하는 페닐케톤뇨증의 (희귀한) 변형은 보충될 수 있는 테트라하이드로비오프테린이라는 보조 인자를 합성할 수 없기 때문에 발생한다. 고페닐알라닌혈증이 있는 임산부는 장애와 유사한 증상(혈액 내 페닐알라닌의 수치가 높음)을 보일 수 있지만, 이러한 지표는 일반적으로 임신 말기에 사라진다. 페닐케톤뇨증이 있는 임산부는 태아가 질환 유전자에 대해 이형접합성인 경우에도 간의 미성숙으로 인해 태아에 악영향을 미칠 수 있으므로 혈중 페닐알라닌의 수치를 조절해야 한다.
페닐알라닌의 비식품 공급원으로는 인공 감미료인 아스파르탐이 있다. 이 화합물은 신체에서 페닐알라닌을 포함한 여러 화학적 부산물로 대체된다. 페닐케톤뇨증에서 체내에 페닐알라닌이 축적될 때 발생하는 문제는 아스파르탐을 섭취시에도 발생하지만 그 정도가 덜하다. 오스트레일리아, 미국, 캐나다에서 아스파르탐을 함유하고 있는 모든 제품에는 "페닐케톤뇨제: 페닐알라닌 함유"라는 문구가 붙어있어야 한다. 영국에서 아스파르탐을 함유하고 있는 식품은 "아스파르탐 또는 E951"의 존재를 나타내는 성분표를 표시해야 하며[11] "페닐알라닌 공급원을 함유함"이라는 경고 문구를 부착해야 한다. 브라질에서는 페닐알라닌이 포함된 제품에 "페닐알라닌 함유"라는 문구가 의무적으로 표시된다. 이러한 경고문은 사람들이 이러한 식품을 피하는 데 도움을 준다.
D-페닐알라닌, L-페닐알라닌 및 DL-페닐알라닌
[편집]입체 이성질체인 D-페닐알라닌은 단일 거울상 이성질체 또는 라세미 혼합물의 성분으로서 통상적인 유기 합성에 의해 생성될 수 있다. D-페닐알라닌은 소량의 단백질, 특히 노화된 단백질 및 가공된 식품 단백질에서 발견되지만 단백질 생합성에서는 참여하지 않는다. D-페닐알라닌이 니아신 수용체 2에 대해 약리학적 활성을 가지고 있지만, D-아미노산의 생물학적 기능은 불분명하다.[12]
DL-페닐알라닌은 진통 및 항우울 활성을 위한 식이 보충제로 판매된다.[13][14][15] DL-페닐알라닌은 D-페닐알라닌과 L-페닐알라닌의 혼합물이다. DL-페닐알라닌의 유명한 진통 활성은 카복시펩티데이스 A에 의한 D-페닐알라닌의 엔케팔린 분해에 의한 차단 가능성으로 설명될 수 있다.[16][17] DL-페닐알라닌의 추정되는 항우울제 활성의 메커니즘은 신경전달물질인 노르에피네프린과 도파민의 합성에서 L-페닐알라닌의 전구체 역할에 의해 설명될 수 있다. 엔케팔린은 뮤 및 델타 오피오이드 수용체의 작용제로 작용하며, 이러한 수용체의 작용제는 항우울 효과를 나타내는 것으로 알려져 있다.[18] DL-페닐알라닌의 추정되는 항우울제 활성의 메커니즘은 신경전달물질인 노르에피네프린과 도파민의 합성에서 L-페닐알라닌의 전구체 역할에 의해 설명될 수 있으나 임상 시험에서 L-페닐알라닌 단독으로는 항우울 효과를 발견하지 못했다.[13] 뇌에서 노르에피네프린과 도파민의 수치 증가는 항우울 효과를 가지는 것으로 생각된다. D-페닐알라닌은 소장에서 흡수되어 문맥 순환을 통해 간으로 운반된다. 소량의 D-페닐알라닌이 L-페닐알라닌으로 전환되는 것으로 보인다. D-페닐알라닌은 전신 순환을 통해 신체의 다양한 조직에 분포될 수 있다. D-페닐알라닌은 L-페닐알라닌보다 혈액뇌장벽을 덜 효율적으로 통과하는 것으로 보이며, 섭취한 소량의 D-페닐알라닌은 중추신경계를 통하지 않고 소변으로 배설된다.[19]
L-페닐알라닌은 Ki가 980 nM인 α2δ Ca2+ 칼슘 통로에서 길항제이다.[20]
뇌에서 L-페닐알라닌은 NMDA 수용체의 글리신 결합 부위와[21] AMPA 수용체의 글루탐산 결합 부위에서 경쟁적 길항제이다.[22] NMDA 수용체의 글리신 결합 부위에서 L-페닐알라닌은 실트 회귀에 의해 추정된 573 μM의 겉보기 평형 해리 상수(KB)를 가지며,[23] 이는 치료되지 않은 사람의 페닐케톤뇨증에서 관찰된 뇌의 L-페닐알라닌의 농도보다 상당히 낮다.[24] L-페닐알라닌은 또한 고전적인 페닐케톤뇨증에서 볼 수 있는 뇌에서의 농도인 980 μM의 IC50으로 해마와 대뇌 피질의 글루탐산작동성 시냅스에서 신경전달물질의 방출을 억제하는 반면, D-페닐알라닌은 이에 대한 효과가 훨씬 더 작다.[22]
상업적 합성
[편집]L-페닐알라닌은 페닐알라닌과 같은 방향족 아미노산을 자연적으로 생성하는 대장균을 이용하여 의료용, 사료용 및 아스파르탐과 같은 영양학적 용도로 대량 생산된다. 상업적으로 생산되는 L-페닐알라닌의 양은 조절 프로모터를 변경하거나 아미노산 합성을 담당하는 효소를 조절하는 유전자의 수를 증폭하는 것과 같이 대장균을 유전적으로 조작함으로써 증가될 수 있다.[25]
유도체
[편집]보로노페닐알라닌(BPA)은 중성자 포획요법에서 사용되는 페닐알라닌의 다이하이드록시보릴 유도체이다.
4-아지도-L-페닐알라닌은 화학생물학에서 생체접합을 위한 도구로 사용되는 단백질을 구성하는 비천연 아미노산이다.
같이 보기
[편집]각주
[편집]- ↑ 가 나 Ihlefeldt, Franziska Stefanie; Pettersen, Fredrik Bjarte; von Bonin, Aidan; Zawadzka, Malgorzata; Görbitz, Prof. Carl Henrik (2014). “The Polymorphs of L‐Phenylalanine”. 《Angew. Chem. Int. Ed.》 53 (49): 13600–13604. doi:10.1002/anie.201406886. PMID 25336255.
- ↑ Dawson RM, 외. (1959). 《Data for Biochemical Research》. Oxford: Clarendon Press.
- ↑ “Nomenclature and Symbolism for Amino Acids and Peptides”. IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. 2008년 10월 9일에 원본 문서에서 보존된 문서. 2018년 3월 5일에 확인함.
- ↑ Thorpe TE (1913). 《A Dictionary of Applied Chemistry》. Longmans, Green, and Co. 191–193쪽. 2012년 6월 4일에 확인함.
- ↑ Plimmer RH (1912) [1908]. Plimmer RH, Hopkins FG, 편집. 《The Chemical Composition of the Proteins》. Monographs on Biochemistry. Part I. Analysis 2판. London: Longmans, Green and Co. 93–97쪽. 2012년 6월 4일에 확인함.
- ↑ Ross, Harvey M.; Roth, June (1991년 4월 1일). 《The Mood Control Diet: 21 Days to Conquering Depression and Fatigue》. Simon & Schuster. 59쪽. ISBN 978-0-13-590449-7.
- ↑ Zeratsky, Katherine. “Phenylalanine in diet soda: Is it harmful?”. 《Mayo Clinic》. 2019년 4월 30일에 확인함.
- ↑ Institute of Medicine (2002). 〈Protein and Amino Acids〉. 《Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids》. Washington, DC: The National Academies Press. 589–768쪽. doi:10.17226/10490. ISBN 978-0-309-08525-0.
- ↑ Eriksson, Johan G; Guzzardi, Maria-Angela; Iozzo, Patricia; Kajantie, Eero; Kautiainen, Hannu; Salonen, Minna K (2017년 1월 1일). “Higher serum phenylalanine concentration is associated with more rapid telomere shortening in men”. 《The American Journal of Clinical Nutrition》 105 (1): 144–150. doi:10.3945/ajcn.116.130468. ISSN 0002-9165. PMID 27881392.
- ↑ Nelson DL, Cox MM (2000). 《Lehninger, Principles of Biochemistry》 3판. New York: Worth Publishing. ISBN 1-57259-153-6.
- ↑ “Aspartame”. UK: Food Standards Agency. 2012년 2월 21일에 원본 문서에서 보존된 문서. 2007년 6월 19일에 확인함.
- ↑ “D-phenylalanine: Biological activity”. 《The IUPHAR/BPS Guide to PHARMACOLOGY》. 2018년 12월 27일에 확인함.
- ↑ 가 나 Wood, David R.; Reimherr, Fred W.; Wender, Paul H. (1985). “Treatment of attention deficit disorder with DL-phenylalanine”. 《Psychiatry Research》 (Elsevier BV) 16 (1): 21–26. doi:10.1016/0165-1781(85)90024-1. ISSN 0165-1781.
- ↑ Beckmann, H.; Strauss, M. A.; Ludolph, E. (1977). “Dl-phenylalanine in depressed patients: An open study”. 《Journal of Neural Transmission》 (Springer Science and Business Media LLC) 41 (2-3): 123–134. doi:10.1007/bf01670277. ISSN 0300-9564.
- ↑ Beckmann, Helmut; Athen, Dieter; Olteanu, Margit; Zimmer, Reinhild (1979). “dl-Phenylalanine versus imipramine: A double-blind controlled study”. 《Archiv für Psychiatrie und Nervenkrankheiten》 (Springer Science and Business Media LLC) 227 (1): 49–58. doi:10.1007/bf00585677. ISSN 0003-9373.
- ↑ “D-phenylalanine: Clinical data”. 《The IUPHAR/BPS Guide to PHARMACOLOGY》. 2018년 12월 27일에 확인함.
- ↑ Christianson DW, Mangani S, Shoham G, Lipscomb WN (August 1989). “Binding of D-phenylalanine and D-tyrosine to carboxypeptidase A” (PDF). 《The Journal of Biological Chemistry》 264 (22): 12849–53. doi:10.1016/S0021-9258(18)51564-7. PMID 2568989.
- ↑ Jelen, Luke A.; Stone, James M.; Young, Allan H.; Mehta, Mitul A. (2022). “The opioid system in depression”. 《Neuroscience & Biobehavioral Reviews》 (Elsevier BV) 140: 104800. doi:10.1016/j.neubiorev.2022.104800. ISSN 0149-7634.
- ↑ Lehmann, W. D.; Theobald, N.; Fischer, R.; Heinrich, H. C. (1983년 3월 14일). “Stereospecificity of phenylalanine plasma kinetics and hydroxylation in man following oral application of a stable isotope-labelled pseudo-racemic mixture of L- and D-phenylalanine”. 《Clinica Chimica Acta; International Journal of Clinical Chemistry》 128 (2–3): 181–198. doi:10.1016/0009-8981(83)90319-4. ISSN 0009-8981. PMID 6851137.
- ↑ Mortell KH, Anderson DJ, Lynch JJ, Nelson SL, Sarris K, McDonald H, Sabet R, Baker S, Honore P, Lee CH, Jarvis MF, Gopalakrishnan M (March 2006). “Structure-activity relationships of alpha-amino acid ligands for the alpha2delta subunit of voltage-gated calcium channels”. 《Bioorganic & Medicinal Chemistry Letters》 16 (5): 1138–41. doi:10.1016/j.bmcl.2005.11.108. PMID 16380257.
- ↑ Glushakov AV, Dennis DM, Morey TE, Sumners C, Cucchiara RF, Seubert CN, Martynyuk AE (2002). “Specific inhibition of N-methyl-D-aspartate receptor function in rat hippocampal neurons by L-phenylalanine at concentrations observed during phenylketonuria”. 《Molecular Psychiatry》 7 (4): 359–67. doi:10.1038/sj.mp.4000976. PMID 11986979.
- ↑ 가 나 Glushakov AV, Dennis DM, Sumners C, Seubert CN, Martynyuk AE (April 2003). “L-phenylalanine selectively depresses currents at glutamatergic excitatory synapses”. 《Journal of Neuroscience Research》 72 (1): 116–24. doi:10.1002/jnr.10569. PMID 12645085. S2CID 42087834.
- ↑ Glushakov AV, Glushakova O, Varshney M, Bajpai LK, Sumners C, Laipis PJ, Embury JE, Baker SP, Otero DH, Dennis DM, Seubert CN, Martynyuk AE (February 2005). “Long-term changes in glutamatergic synaptic transmission in phenylketonuria”. 《Brain》 128 (Pt 2): 300–7. doi:10.1093/brain/awh354. PMID 15634735.
- ↑ Möller HE, Weglage J, Bick U, Wiedermann D, Feldmann R, Ullrich K (December 2003). “Brain imaging and proton magnetic resonance spectroscopy in patients with phenylketonuria”. 《Pediatrics》 112 (6 Pt 2): 1580–3. doi:10.1542/peds.112.S4.1580. hdl:11858/00-001M-0000-0010-A24A-C. PMID 14654669. S2CID 2198040.
- ↑ Sprenger, G. A. (2007). 〈Aromatic Amino Acids〉. 《Amino Acid Biosynthesis: Pathways, Regulation and Metabolic Engineering》 1판. Springer. 106–113쪽. ISBN 978-3-540-48595-7.