Proxesterona
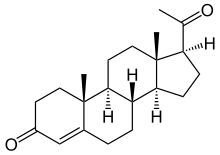
Nome IUPAC: Pregn-4-ene-3,20-diona.

Número CAS: 57-83-0.
A Proxesterona ou P4 (pregn-4-ene-3,20-diona) é unha hormona esteroide de 21 carbonos implicada no ciclo menstrual feminino, embarazo (mantén a xestación) e na embrioxénese nos humanos e noutras especies. A proxesterona pertence a unha clase de hormonas chamadas proxestáxenos, e é o principal proxestáxeno natural humano.
Igual que outros esteroides, a proxesterona consta de catro ciclos hidrocarbonados unidos. Contén grupos químicos oxixenados cun grupo cetona no C-3, e dúas ramificacións metilo. É hidrófoba.
A proxesterona obtense xeralmente da planta Dioscorea da familia do iñame. A Dioscorea produce grandes cantidades dun esteroide chamado diosxenina, que pode converterse en proxesterona no laboratorio.
Historia
[editar | editar a fonte]A proxesterona foi descuberta independentemente por catro grupos de investigación.[1][2][3][4]
Willard Myron Allen foi un codescubridor da proxesterona xunto co seu profesor de anatomía George Washington Corner na Universidade de Rochester Medical School en 1933. Allen determinou primeiro o seu punto de fusión, peso molecular, e estrutura molecular parcial. Tamén foi o que lle deu o nome de proxesterona derivado de Progestational Steroidal ketone (cetona esteroide proxestacional).[5]
Fontes
[editar | editar a fonte]Animais
[editar | editar a fonte]A proxesterona prodúcese nos ovarios (polo corpo lúteo), as glándulas adrenais ou suprarrenais, e, durante o embarazo, na placenta. A proxesterona almacénase tamén no tecido adiposo.
Nos humanos, aumenta a produción de proxesterona durante o embarazo:
- En primeiro lugar, a fonte é o corpo lúteo que é mantido activo pola gonadotropina coriónica humana (hCG) dos tecidos do embrión.
- Despois da 8ª semana, a produción de proxesterona pasa a facerse na placenta. A placenta utiliza o colesterol materno como o substrato inicial para a síntese da hormona, e a maioría da proxesterona producida entra na circulación sanguínea materna, pero unha parte pasa á circulación fetal e é utilizada como substrato para a síntese de corticosteroides fetais. Ao termo do embarazo a placenta produce uns 250 mg de proxesterona por día.
- Unha fonte adicional de proxesterona son os produtos lácteos. Despois do consumo de produtos lácteos o nivel de proxesterona biodispoñible aumenta.[6]
Plantas
[editar | editar a fonte]Detectouse a presenza de proxesterona polo menos nunha planta, a nogueira (Juglans regia).[7] Ademais, esteroides similares á proxesterona foron atopados na Dioscorea mexicana e outras Dioscorea. A Dioscorea mexicana forma parte da familia do iñame, nativa de México.[8] Esta planta contén un esteroide chamado diosxenina que se extrae da planta para convertelo en proxesterona no laboratorio.[9]
Outra planta que contén substancias doadamente convertibles en proxesterona é a Dioscorea pseudojaponica nativa de Taiwán. Este iñame taiwanés contén saponinas, esteroides que poden transformarse en diosxenina e despois en proxesterona.[10]
Outras das Dioscorea con este tipo de substancias esteroideas son principalmente a Dioscorea villosa e a Dioscorea polygonoides. A Dioscorea villosa contén o 3,5% de diosxenina.[11] A Dioscorea polygonoides contén o 2,64% de diosxenina.[12] A maioría destas especies viven en países tropicais e subtropicais.[13]
Síntese
[editar | editar a fonte]Biosíntese
[editar | editar a fonte]
Abaixo: A proxesterona é importante na síntese de aldosterona (mineralocorticoide), e a 17-hidroxiproxesterona é importante para sintetizar cortisol (glicocorticoide), e a androstenediona para a síntese dos esteroides sexuais.
Nos mamíferos, a proxesterona (6), igual que as outras hormonas esteroides, sintetízase a partir da pregnenolona (3), a cal á súa vez deriva do colesterol (1) (véxase a figura).
O colesterol (1) sofre unha dobre oxidación para producir o 20,22-dihidroxicolesterol (2). Este diol é despois oxidado coa perda da cadea lateral do C-22, producindo pregnenolona (3). Esta reacción é catalizada polo citocromo P450scc. A conversión da pregnenolona en proxesterona ten lugar en dous pasos. Primeiro, o grupo 3-hidroxilo oxídase a cetona (4) e segundo, o dobre enlace móvese de C-5 a C-4, por medio dunha reacción de tautomerización ceto/enol.[14] Esta reacción está catalizada pola 3beta-hidroxiesteroide deshidroxenase/delta(5)-delta(4)isomerase (ou 3-beta-hidroxiesteroide deshidroxenase).
A proxesterona á súa vez (ver a figura de máis abaixo) é o precursor do mineralocorticoide aldosterona, e despois de transformarse en 17-hidroxiproxesterona (outro proxestáxeno natural) orixina o cortisol e a androstenediona. A androstenediona pode converterse en testosterona, estrona e estradiol.
A pregenolona e a proxesterona poden tamén sintetizarse en lévedos modificados xeneticamente.[15]
Síntese no laboratorio
[editar | editar a fonte]
Unha semisíntese industrial da proxesterona a partir da disoxenina extraída dos iñames foi desenvolvida por Russell Marker en 1940 para unha compañía farmacéutica (ver figura da dereita).[16] Esta síntese denomínase degradación de Marker. Ideáronse outras semisínteses da proxesterona que empezan por outros esteroides. por exemplo, a cortisona pode ser simultaneamente desoxixenada en C-17 e C-21 por tratamento con iodotrimetilsilano en cloroformo para producir 11-ceto-proxesterona (cetoxestina), a cal á súa vez pode ser reducida na posición 11 para render proxesterona.[17]

Unha síntese total de proxesterona ideouna en 1971 W.S. Johnson (ver figura da dereita).[18] A síntese empeza facendo reaccionar o sal de fosfonio 7 con fenil litio para producir fosfonio iluro 8. O iluro 8 faise reaccionar cun aldehido para producir o alqueno 9. Os grupos protectores cetal de 9 son hidrolizados para producir a dicetona 10, a cal á súa vez cíclase para formar a ciclopentenona 11. A cetona de 11 reacciona con metil litio para render o alcohol terciario 12, o cal á súa vez é tratado con ácido para producir o catión terciario 13. O paso chave da síntese é a ciclación π-catiónica de 13 na cal os aneis B, C, e D do esteroide son producidos simultaneamente orixinando 14. Este paso parécese á reacción de ciclación catiónica utilizada na biosíntese de esteroides e por iso se denomina biomimética. No seguinte paso o enol ortoéster é hidrolizado para producir a cetona 15. O anel A ciclopentano é despois aberto ao oxidalo con ozono para producir 16. Finalmente, a dicetona 17 sofre unha condensación aldólica intramolecular ao tratala con hidróxido de potasio acuoso para orixinar a proxesterona.[18]
Niveis
[editar | editar a fonte]Nas mulleres, os niveis de proxesterona son relativamente baixos durante a fase preovulatoria do ciclo menstrual, aumentan despois da ovulación, e son elevados durante a fase lútea, como se mostra no diagrama de máis abaixo. Os niveis de proxesterona tenden a ser < 2 ng/ml antes da ovulación, e > 5 ng/ml despois da ovulación. Se se produce embarazo, libérase gonadotropina coriónica humana, que mantén o corpo lúteo e permite que este manteña os niveis de proxesterona. Arredor das 12 semanas de xestación a placenta empeza a producir proxesterona en lugar do corpo lúteo; este proceso denomínase cambio lúteo-placentario. Despois do cambio lúteo-placentario os niveis de proxesterona empezan a subir máis e poden atinguir 100-200 ng/ml ao termo do embarazo. Discútese se un descenso nos niveis de proxesterona é crítico para a iniciación do parto e pode ser específico de especie. Despois da expulsión da placenta e durante a lactación, os niveis de proxesterona son moi baixos.
Os niveis de proxesterona son relativamente baixos en nenos e mulleres menopáusicas.[19] Os homes adultos teñen niveis semellantes aos que teñen as mulleres durante a fase folicular do ciclo menstrual.
| Tipo de persoa | Rango de referencia para as análises de sangue | ||
|---|---|---|---|
| Límite inferior | Límite superior | Unidade | |
| Muller - ciclo menstrual | (véxase o diagrama de abaixo) | ||
| Muller - posmenopáusica | <0,2[20] | 1[20] | ng/mL |
| <0,6[21] | 3[21] | nmol/L | |
| Muller tomando contraceptivos orais | 0,34[20] | 0,92[20] | ng/mL |
| 1,1[21] | 2,9[21] | nmol/L | |
| Homes ≥ 16 anos | 0,27[20] | 0,9[20] | ng/mL |
| 0,86[21] | 2,9[21] | nmol/L | |
| Nenas ou nenos de 1-9 anos | 0,1[20] | 4,1[20] ou 4,5[20] | ng/mL |
| 0,3[21] | 13[21] | nmol/L | |

- Os rangos denominados na figura By biological stage (por fase biolóxica) poden ser usados en ciclos menstruais estritamente monitorizados en relación con outros marcadores da súa progresión biolóxica, coa escala de tempo comprimida ou estirada segundo o rapidamente ou lentamente que, respectivamente, progrese o ciclo comparado cun ciclo medio.
- Os rangos denominados na figura Inter-cycle variability (variabilidade entre ciclos) son máis apropiados para usalos en ciclos non monitorizados nos que só se coñece o inicio da menstruación, pero nos que a muller sabe con precisión a duración do seu ciclo medio e o momento da ovulación, e que son máis ben regulares como media, coa escala de tempo comprimida ou estirada segundo o ciclo medio da muller sexa máis curto ou máis longo, respectivamente, ca o ciclo medio da poboación.
- Os rangos denominados na figura Inter-woman variability (variabilidade entre mulleres) son máis apropiados para utilizalos cando a duración do ciclo medio e o momento da ovulación non se coñecen, e só se sabe o comezo da menstruación.
Efectos
[editar | editar a fonte]
A proxesterona exerce as súas principais accións por medio dun receptor intracelular chamado receptor da proxesterona aínda que tamén se postulou a existencia dun receptor de membrana para a proxesterona.[23][24] Ademais, a proxesterona é un antagonista moi potente do receptor de mineralocorticoides (MR, o receptor da aldosterona e outros mineralocorticoides). A proxesterona impide a activación do MR ao unirse a dito receptor cunha afinidade que mesmo supera á da propia aldosterona e outros corticosteroides como o cortisol e a corticosterona.[25]
A proxesterona ten varios efectos fisiolóxicos que son amplificados en presenza de estróxeno. O estróxeno por medio dos receptores dos estróxenos aumenta a expresión do xene dos receptores da proxesterona.[26] Ademais, os niveis elevados de proxesterona reducen potentemente a actividade de retención de sodio da aldosterona, tendo como resultado natriurese (sodio na urina) e redución do volume do fluído extracelular. A redución da proxesterona, por outra parte, está asociada cun incremento temporal na retención de sodio (redúcese a natriurese, e increméntase o volume do fluído extracelular) debido ao incremento compensatorio na produción de aldosterona, o cal combate o bloqueo do receptor dos mineralocorticoides polos niveis previamente elevados de proxesterona.[27]
Sistema reprodutor
[editar | editar a fonte]A proxesterona ten efectos moi importantes por sinalización non xenómica sobre o esperma humano cando migra a través do tracto xenital feminino antes de que ocorra a fertilización, que se exercen seguramente a través de receptores que aínda non foron identificados.[28] A caracterización detallada dos eventos que ocorren no esperma en resposta á proxesterona serviron para aclarar varios fenómenos como os cambios transitorios e sostidos no calcio intracelular,[29] oscilacións lentas do calcio,[30] que agora se cre que posiblemente regulan a motilidade do espermatozoide.[31] A proxesterona tamén mostrou ter efecto sobre os espermatozoides do polbo.[32]
A proxesterona modula a actividade das canles catiónicas do esperma (CatSper ou canles de Ca2+ de apertura por voltaxe). Como o óvulo libera proxesterona, o esperma pode usar a proxesterona como un sinal diana para nadar en busca do óvulo (quimiotaxe). Por tanto, as substancias que bloquean os lugares de unión da proxesterona nas canles CatSper poderían utilizarse potencialmente como un método de contracepción masculina.[33][34]
A proxesterona denomínase ás veces "hormona do embarazo",[35] e exerce moitas funcións relacionadas co desenvolvemento do feto:
- A proxesterona fai que o endometrio evolucione ao seu estado secretor para preparar ao útero para a implantación. Ao mesmo tempo a proxesterona afecta ao epitelio vaxinal e ao moco cervical, facéndoo máis mesto e impenetrable para o esperma. Se non hai embarazo, os niveis de proxesterona decrecen, o que producirá no ser humano a menstruación. O sangrado menstrual normal é producido pola ausencia de proxesterona. Se non hai ovulación e o corpo lúteo non se desenvolve, os niveis de proxesterona poden ser baixos, o que produce un sangrado uterino disfuncional anovulatorio (hemorraxia uterina disfuncional).
- Durante a implantación e xestación, a proxesterona parece facer diminuír a resposta inmunitaria materna para permitir a aceptación do embarazo.
- A proxesterona fai diminuír a contractilidade do músculo liso uterino.[35]
- Ademais, a proxesterona inhibe a lactación durante o embarazo. A caída nos niveis de proxesterona despois do parto é un dos causantes do comezo da produción de leite.
- Unha caída dos niveis de proxesterona é posiblemente un dos eventos que facilita o comezo do parto.
O feto metaboliza a proxesterona placentaria na produción de esteroides adrenais.
Sistema nervioso
[editar | editar a fonte]A proxesterona, igual que a pregnenolona e a deshidroepiandrosterona, pertence ao grupo dos neuroesteroides. Pode sintetizarse no sistema nervioso central e tamén serve como precursor para outro neuroesteroide importante, a alopregnanolona.
Os neurosteroides afectan á sinapse, son neuroprotectores, e afectan á mielinización dos nervios.[36] Están investigándose polo seu potencial de mellorar a memoria e capacidade cognitiva. A proxesterona afecta á regulación dos xenes apoptóticos.
O seu efecto como neuroesteroide funciona predominantemente a través da vía beta GSK-3 (glicóxeno sintase quinase 3), como un inhibidor. (Outros inhibidores beta GSK-3 son estabilizadores do estado de ánimo bipolar, o litio e o ácido valproico.)
Outras síndromes
[editar | editar a fonte]- Eleva os niveis do factor de crecemento epidérmico 1, un factor que se utiliza a miúdo para inducir a proliferación e manter cultivos de células nai ou troncais.
- Incrementa a temperatura corporal basal (función termoxénica) durante a ovulación.
- Reduce os espasmos e relaxa o músculo liso. Os bronquios alárganse e a produción de moco regúlase. (O receptor de proxesterona é abundante no tecido submucoso.)
- Actúa como un axente antiinflamatorio e regula a resposta inmunitaria.
- Reduce a actividade da vesícula biliar.[37]
- Normaliza a coagulación sanguínea e o ton vascular, os niveis de cinc e cobre, os niveis celulares de O2, e o uso das graxas almacenadas para a produción de enerxía.
- Pode afectar á saúde das enxivas, incrementando o risco de xenxivite, e aos dentes.
- Parece impedir o cáncer de endometrio ao regular os efectos do estróxeno.
Efectos secundarios
[editar | editar a fonte]Os tratamentos con doses altas de proxesterona poden ter efectos secundarios graves. Para que funcione a pílula de "proxesterona" (que non é verdadeira proxesterona, senón unha proxestina sintética patentada), necesita tomarse a doses altas non naturais; e por esta razón pode ter importantes efectos secundarios. Por exemplo, 400 mg poden causar un incremento na retención de fluídos, o cal pode ocasionar epilepsia, migrañas, asma, e trastornos cardíacos e renais. Os coágulos de sangue que se poden formar poden orixinar ataques de corazón e apoplexías, que poden levar á morte ou a quedar permanentemente impedido, e poden orixinar émbolos pulmonares ou cancro de mama. Por tanto, as altas doses de proxesterona están asociadas cun incremento do risco de trastornos trombóticos como a tromboflebite, trastornos cerebrovasculares, embolismo pulmonar, e trombose retinal.[38]
Os efectos adversos comúns da proxesterona inclúen cambras, dor abdominal, dor esquelético, dor perineal, dor de cabeza, dor das articulacións, entrinximento, dispareunia (dor nas relacións sexuais), micción nocturna, diarrea, náuseas, vomitos, crecemento do peito, flatulencia, calores, decrecemento da libido, sede, aumento do apetito, nerviosismo, e adormecemento. Os efectos psiquiátricos son depresión, cambios de humor, inestabilidade emocional, agresión, insomnio, perda de memoria e trastornos do sono.[38]
Investigacións recentes suxiren que a proxesterona xoga un importante papel na sinalización para a liberación de insulina e na función pancreática, e pode afectar á susceptibilidade á diabetes.[39] As mulleres con altos niveis de proxesterona durante o embarazo é máis probable que desenvolvan anormalidades na utilización da glicosa.[40]
Aplicacións médicas
[editar | editar a fonte]O uso da proxesterona e os seus análogos ten moitas aplicacións médicas, tanto para tratar situacións agudas coma para tratar o declive a longo prazo da produción natural de proxesterona. A causa da escasa biodispoñibilidade da proxesterona que se toma oralmente, utilízanse proxestinas sintéticas de mellor biodispoñibilidade.[41] Tamén existen xeles vaxinais de proxesterona,[42] e cápsulas de uso oral [43] inxeccións [44] e insertos vaxinais.[45] En Italia e España a proxesterona véndese co nome comercial Progeffik.
Biodispoñibilidade
[editar | editar a fonte]O modo de administración inflúe moito nos efectos do produto. Administrada oralmente ten unha gran variación dunha persoa a outra en canto á súa absorción e biodispoñibilidade, pero as proxestinas sintéticas son absorbidas rapidamente e teñen unha vida media máis longa ca a proxesterona, e manteñen niveis estables no sangue.[46]
A proxesterona non se disolve na auga é absórbese mal oralmente a non ser que sexa micronizada en aceite. As cápsulas conteñen proxesterona micronizada en aceite. A proxesterona pode tamén ser administrada por medio de supositorios vaxinais ou rectais ou pesarios, ou por xeles ou cremas transdérmicas,[47] ou por inxeccións (aínda que con estas últimas ten unha curta vida media e requiren unha administración diaria).
Os produtos de "proxesterona natural" derivados de iñames non requiren prescrición médica, pero non hai evidencia de que o corpo humano poida converter o seu ingrediente activo (diosxenina, o esteroide desas plantas que é transformado industrialmente en proxesterona [16]) en proxesterona.[48][49]
Usos específicos
[editar | editar a fonte]- A proxesterona utilízase para manter o embarazo nas Tecnoloxías de Reprodución Asistida como a fertilización in vitro. Unha metaanálise recente demostrou que a administración intravaxinal é equivalente á administración por inxección diaria de proxesterona en aceite, a cal ademais non está permitida durante o embarazo.[50][51]
- A proxesterona utilízase para controlar as hemorraxias persistentes anovulatorias. Tamén se usa para preparar o revestimento uterino nas terapias de infertilidade e para manter o embarazo. Os pacientes con casos de abortos recorrentes debidos a unha produción inadecuada de proxesterona poden recibir proxesterona.
- A proxesterona utilízase en mulleres non preñadas que teñen un atraso na súa menstruación dun mes ou máis, para permitir que o revestimento endometrial engrosado se desprenda. A proxesterona tómase oralmente durante un curto período (xeralmente unha semana), despois do cal detense a administración de proxesterona e empeza o sangrado, polo que este método denomínase sangrado por retirada da proxesterona.
- A proxesterona está sendo investigada polos seus potenciais efectos beneficiosos no tratamento da esclerose múltiple, xa que a deterioración característica nesa doenza do illamento de mielina dos nervios cesa durante o embarazo (cando os niveis de proxesterona aumentan); a deterioración recomeza de novo cando os niveis de proxesterona baixan.
- A proxesterona administrada vaxinalmente está sendo investigada como un tratamento potencialmente beneficioso na prevención dos nacementos prematuros en mulleres con ese risco.[52][53] Aínda que algúns estudos mostraron resultados beneficiosos a este respecto, outros indican que a proxesterona administrada vaxinalmente non é mellor ca o placebo neses casos,[54] ou que era beneficioso só para as mulleres con cérvix curto.[55][56] Algúns traballos expoñen a utilidade da lonxitude cervical sonográfica na identificación de pacientes que se poidan beneficiar do tratamento con proxesterona.[57][58][59]
- A proxesterona ten tamén un papel na elasticidade da pel e na resistencia dos ósos, na respiración, nos tecidos nerviosos e na sexualidade feminina, e a presenza de receptores de proxesterona en certos tecidos musculares e adiposos suxire un papel no dimorfismo sexual nas proporcións de ditos tecidos.[60]
- Os antagonistas dos receptores da proxesterona, ou moduladores dos receptores da proxesterona selectivos (SPRM)s, como o RU-486, poden utilizarse par previr a concepción ou inducir o aborto médico. (Pero téñase en conta que os métodos de contracepción hormonal non conteñen proxesterona senón unha proxestina).
- A proxesterona pode afectar ao comportamento masculino.[61]
Envellecemento
[editar | editar a fonte]Como nos machos a maior parte da proxesterona se crea durante a produción testicular de testosterona, e a das femias nos ovarios, o cesamento de produción destes órganos (por medios naturais ou químicos) ou a súa eliminación inevitablemente causa unha considerable redución nos niveis de proxesterona. A atención que se lle deu inicialmente aos proxestáxenos (como a proxesterona) na función reprodutora feminina, fixo que a proxesterona fose considerada unha "hormona feminina", e isto escureceu o papel xeral que ten a proxesterona en ambos os sexos.
Os efectos regulatorios da proxesterona, a presenza dos seus receptores en moitos tecidos, e patrón de deterioración (ou formación de tumores) en moitos tecidos increméntanse na vellez cando os niveis de proxesterona baixan, o cal está motivando moitas investigacións sobre o valor potencial de manter os niveis de proxesterona tanto en homes coma en mulleres.
Danos cerebrais
[editar | editar a fonte]Estudos previos mostraran que a proxesterona mantén o desenvolvemento normal das neuronas do cerebro, e que a hormona ten un efecto protector sobre os tecidos cerebrais danados. Observouse en modelos animais que as femias teñen unha susceptibilidade reducida aos danos traumáticos cerebrais e propúxose que este efecto protector está causado por un incremento dos niveis circulantes de estróxeno e proxesterona nas femias.[62] Varios estudos adicionais en animais confirmaron que a proxesterona ten efectos neuroprotectores cando se administra pouco despois dun dano cerebral.[63] Tamén se obtiveron resultados esperanzadores en ensaios clínicos en humanos.[64][65]
O mecanismo polo que a proxesterona exerce estes efectos protectores pode ser a redución da inflamación que segue ao trauma cerebral.[66]
Outras imaxes
[editar | editar a fonte]
Notas
[editar | editar a fonte]- ↑ Allen WM (1935). "The isolation of crystalline progestin". Science 82 (2118): 89–93. PMID 17747122. doi:10.1126/science.082.2118.89.
- ↑ Butenandt A, Westphal U (1934). "Zur Isolierung und Charakterisierung des Corpusluteum-Hormons". Berichte Deu0tsche chemische Gesellschaft 67 (8): 1440–1442. doi:10.1002/cber.19340670831.
- ↑ Hartmann M, Wettstein A (1934). "Ein krystallisiertes Hormon aus Corpus luteum". Helvetica Chimica Acta 17: 878–882. doi:10.1002/hlca.193401701111.
- ↑ Slotta KH, Ruschig H, Fels E (1934). "Reindarstellung der Hormone aus dem Corpusluteum". Berichte Deutsche chemische Gesellschaft 67 (7): 1270–1273. doi:10.1002/cber.19340670729.
- ↑ Allen WM (1970). "Progesterone: how did the name originate?". South. Med. J. 63 (10): 1151–5. PMID 4922128. doi:10.1097/00007611-197010000-00012.
- ↑ Goodson III WH, Handagama P, Moore II DH, Dairkee S (2007-12-13). "Milk products are a source of dietary progesterone". 30th Annual San Antonio Breast Cancer Symposium. pp. abstract # 2028. Arquivado dende o orixinal o 20 de setembro de 2008. Consultado o 2008-03-12.
- ↑ Pauli GF, Friesen JB, Gödecke T, Farnsworth NR, Glodny B (2010). "Occurrence of Progesterone and Related Animal Steroids in Two Higher Plants". J Nat Prod 73 (3): 338–45. PMID 20108949. doi:10.1021/np9007415.
- ↑ Applezweig N (1969). "Steroids". Chem Week 104: 57–72. PMID 12255132.
- ↑ Noguchi E, Fujiwara Y, Matsushita S, Ikeda T, Ono M, Nohara T (2006). "Metabolism of tomato steroidal glycosides in humans". Chem. Pharm. Bull. 54 (9): 1312–4. PMID 16946542. doi:10.1248/cpb.54.1312.
- ↑ Yang DJ, Lu TJ, Hwang LS (2003). "Isolation and identification of steroidal saponins in Taiwanese yam cultivar (Dioscorea pseudojaponica Yamamoto)". J. Agric. Food Chem. 51 (22): 6438–44. PMID 14558759. doi:10.1021/jf030390j.
- ↑ Hooker E (2004). "Final report of the amended safety assessment of Dioscorea Villosa (Wild Yam) root extract". Int. J. Toxicol. 23 Suppl 2: 49–54. PMID 15513824. doi:10.1080/10915810490499055.
- ↑ Niño J, Jiménez DA, Mosquera OM, Correa YM (2007). "Diosgenin quantification by HPLC in a Dioscorea polygonoides tuber collection from colombian flora". Journal of the Brazilian Chemical Society 18 (5): 1073–1076. doi:10.1590/S0103-50532007000500030.
- ↑ Myoda T, Nagai T, Nagashima T (2005). Current Topics in Food Science and Technology, ed. Properties of starches in yam (Dioscorea spp.) tuber. pp. 105–114. ISBN 81-308-0003-9.
- ↑ Dewick, Paul M. (2002). Wiley, ed. Medicinal natural products: a biosynthetic approach. New York. pp. 244. ISBN 0-471-49641-3.
- ↑ Duport C, Spagnoli R, Degryse E, Pompon D (1998). "Self-sufficient biosynthesis of pregnenolone and progesterone in engineered yeast". Nat. Biotechnol. 16 (2): 186–9. PMID 9487528. doi:10.1038/nbt0298-186.
- ↑ 16,0 16,1 16,2 Marker RE, Krueger J (1940). "Sterols. CXII. Sapogenins. XLI. The Preparation of Trillin and its Conversion to Progesterone". J. Am. Chem. Soc. 62 (12): 3349–3350. doi:10.1021/ja01869a023.
- ↑ Numazawa M, Nagaoka M, Kunitama Y (1986). "Regiospecific deoxygenation of the dihydroxyacetone moiety at C-17 of corticoid steroids with iodotrimethylsilane". Chem. Pharm. Bull. 34 (9): 3722–6. PMID 3815593. doi:10.1248/cpb.34.3722. Arquivado dende o orixinal o 09 de decembro de 2012. Consultado o 31 de marzo de 2009.
- ↑ 18,0 18,1 18,2 Johnson WS, Gravestock MB, McCarry BE (1971). "Acetylenic bond participation in biogenetic-like olefinic cyclizations. II. Synthesis of dl-progesterone". J. Am. Chem. Soc. 93 (17): 4332–4. PMID 5131151. doi:10.1021/ja00746a062.
- ↑ NIH Clinical Center (2004-08-16). "Progesterone Historical Reference Ranges". United States National Institutes of Health. Arquivado dende o orixinal o 09 de xaneiro de 2009. Consultado o 2008-03-12.
- ↑ 20,0 20,1 20,2 20,3 20,4 20,5 20,6 20,7 20,8 Progesterone Reference Ranges Arquivado 13 de agosto de 2011 en Wayback Machine., Performed at the Clinical Center at the National Institutes of Health, Bethesda MD, 03Feb09
- ↑ 21,0 21,1 21,2 21,3 21,4 21,5 21,6 21,7 Convertido a partir dos valores de masa utilizando unha masa molar de 314,46 g/mol
- ↑ References and further description of values are given in image page in Wikimedia Commons at Commons:File:Progesterone during menstrual cycle.png.
- ↑ Luconi M, Bonaccorsi L, Maggi M, Pecchioli P, Krausz C, Forti G, Baldi E (1998). "Identification and characterization of functional nongenomic progesterone receptors on human sperm membrane". J. Clin. Endocrinol. Metab. 83 (3): 877–85. PMID 9506743. doi:10.1210/jc.83.3.877.
- ↑ Jang S, Yi LS (2005). "Identification of a 71 kDa protein as a putative non-genomic membrane progesterone receptor in boar spermatozoa". J. Endocrinol. 184 (2): 417–25. PMID 15684349. doi:10.1677/joe.1.05607.
- ↑ Rupprecht R, Reul JM, van Steensel B, Spengler D, Söder M, Berning B, Holsboer F, Damm K (1993). "Pharmacological and functional characterization of human mineralocorticoid and glucocorticoid receptor ligands". Eur J Pharmacol 247 (2): 145–54. PMID 8282004. doi:10.1016/0922-4106(93)90072-H.
- ↑ Kastner P, Krust A, Turcotte B, Stropp U, Tora L, Gronemeyer H, Chambon P (1990). "Two distinct estrogen-regulated promoters generate transcripts encoding the two functionally different human progesterone receptor forms A and B". EMBO J. 9 (5): 1603–14. PMC 551856. PMID 2328727.
- ↑ Landau RL, Bergenstal DM, Lugibihl K, Kascht ME. (1955). "The metabolic effects of progesterone in man". J Clin Endocrinol Metab 15 (10): 1194–215. PMID 13263410. doi:10.1210/jcem-15-10-1194.
- ↑ Correia JN, Conner SJ, Kirkman-Brown JC (2007). "Non-genomic steroid actions in human spermatozoa. "Persistent tickling from a laden environment"". Semin. Reprod. Med. 25 (3): 208–19. PMID 17447210. doi:10.1055/s-2007-973433.
- ↑ Kirkman-Brown JC, Bray C, Stewart PM, Barratt CL, Publicover SJ (2000). "Biphasic elevation of [Ca(2+)](i) in individual human spermatozoa exposed to progesterone". Developmental Biology 222 (2): 326–35. ISSN 0012-1606. PMID 10837122. doi:10.1006/dbio.2000.9729.
- ↑ Kirkman-Brown JC, Barratt CL, Publicover SJ (2004). "Slow calcium oscillations in human spermatozoa". The Biochemical Journal 378 (Pt 3): 827–32. PMC 1223996. PMID 14606954. doi:10.1042/BJ20031368.
- ↑ Harper CV, Barratt CL, Publicover SJ (2004). "Stimulation of human spermatozoa with progesterone gradients to simulate approach to the oocyte. Induction of [Ca(2+)](i) oscillations and cyclical transitions in flagellar beating". The Journal of Biological Chemistry 279 (44): 46315–25. PMID 15322137. doi:10.1074/jbc.M401194200.
- ↑ Tosti E, Di Cosmo A, Cuomo A, Di Cristo C, Gragnaniello G (2001). "Progesterone induces activation in Octopus vulgaris spermatozoa". Mol. Reprod. Dev. 59 (1): 97–105. PMID 11335951. doi:10.1002/mrd.1011.
- ↑ Strünker T, Goodwin N, Brenker C, Kashikar ND, Weyand I, Seifert R, Kaupp UB (2011). "The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm". Nature 471 (7338): 382–6. PMID 21412338. doi:10.1038/nature09769. Resumo divulgativo – Nature News.
- ↑ Lishko PV, Botchkina IL, Kirichok Y (2011). "Progesterone activates the principal Ca2+ channel of human sperm". Nature 471 (7338): 387–91. PMID 21412339. doi:10.1038/nature09767.
- ↑ 35,0 35,1 Bowen R (2000-08-06). "Placental Hormones". Arquivado dende o orixinal o 17 de maio de 2007. Consultado o 2008-03-12.
- ↑ Schumacher M, Guennoun R, Robert F; et al. (2004). "Local synthesis and dual actions of progesterone in the nervous system: neuroprotection and myelination". Growth Horm. IGF Res. 14 Suppl A: S18–33. PMID 15135772. doi:10.1016/j.ghir.2004.03.007.
- ↑ Hould FS, Fried GM, Fazekas AG, Tremblay S, Mersereau WA (1988). "Progesterone receptors regulate gallbladder motility". J. Surg. Res. 45 (6): 505–12. PMID 3184927. doi:10.1016/0022-4804(88)90137-0.
- ↑ 38,0 38,1 Columbia Laboratories, Inc. (2004). "Prometrium(progesterone)". (require subscrición (?)).
- ↑ Picard F, Wanatabe M, Schoonjans K, Lydon J, O'Malley BW, Auwerx J (2002). "Progesterone receptor knockout mice have an improved glucose homeostasis secondary to beta -cell proliferation" (PDF).
- ↑ Brănişteanu DD, Mathieu C (2003). "Progesterone in gestational diabetes mellitus: guilty or not guilty?".
- ↑ Schindler AE, Campagnoli C, Druckmann R, Huber J, Pasqualini JR, Schweppe KW, Thijssen JH (2008). "Classification and pharmacology of progestins". Maturitas 61 (1–2): 171–80. PMID 19434889. doi:10.1016/j.maturitas.2003.09.014.
- ↑ "Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations: 020701". Food and Drug Administration. 2010-07-02. Consultado o 2010-07-07.
- ↑ "Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations: 019781". Food and Drug Administration. 2010-07-02. Consultado o 2010-07-07.
- ↑ "Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations: 075906". Food and Drug Administration. 2010-07-02. Consultado o 2010-07-07.
- ↑ "Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations: 022057". Food and Drug Administration. 2010-07-02. Consultado o 2010-07-07.
- ↑ Schindler, A. E.; Campagnoli, C.; Druckmann, R.; Huber, J.; Pasqualini, J. R.; Schweppe, K. W.; Thijssen, J. H. (2003). "Classification and pharmacology of progestins". Maturitas 46 Suppl 1: S7–S16. PMID 14670641.
- ↑ Susan Lark (1999). McGraw-Hill Professional, ed. Making the Estrogen Decision. p. 22. ISBN 9780879836962.
- ↑ Zava DT, Dollbaum CM, Blen M (1998). "Estrogen and progestin bioactivity of foods, herbs, and spices". Proc. Soc. Exp. Biol. Med. 217 (3): 369–78. PMID 9492350.
- ↑ Komesaroff PA, Black CV, Cable V, Sudhir K (2001). "Effects of wild yam extract on menopausal symptoms, lipids and sex hormones in healthy menopausal women". Climacteric 4 (2): 144–50. PMID 11428178. doi:10.1080/713605087.
- ↑ Zarutskiea PW, Phillips JA (2007). "Re-analysis of vaginal progesterone as luteal phase support (LPS) in assisted reproduction (ART) cycles". Fertility and Sterility 88 (supplement 1): S113. doi:10.1016/j.fertnstert.2007.07.365.
- ↑ Khan N, Richter KS, Blake EJ, et al. Case-matched comparison of intramuscular versus vaginal progesterone for luteal phase support after in vitro fertilization and embryo transfer. Presented at: 55th Annual Meeting of the Pacific Coast Reproductive Society; April 18–22, 2007; Rancho Mirage, CA.
- ↑ da Fonseca EB, Bittar RE, Carvalho MH, Zugaib M (2003). "Prophylactic administration of progesterone by vaginal suppository to reduce the incidence of spontaneous preterm birth in women at increased risk: a randomized placebo-controlled double-blind study". Am. J. Obstet. Gynecol. 188 (2): 419–24. PMID 12592250. doi:10.1067/mob.2003.41.
- ↑ Harris, Gardiner. "Hormone Is Said to Cut Risk of Premature Birth". New York Times. Consultado o 5 May 2011.
- ↑ O'Brien JM, Adair CD, Lewis DF, Hall DR, Defranco EA, Fusey S, Soma-Pillay P, Porter K, How H, Schackis R, Eller D, Trivedi Y, Vanburen G, Khandelwal M, Trofatter K, Vidyadhari D, Vijayaraghavan J, Weeks J, Dattel B, Newton E, Chazotte C, Valenzuela G, Calda P, Bsharat M, Creasy GW (2007). "Progesterone vaginal gel for the reduction of recurrent preterm birth: primary results from a randomized, double-blind, placebo-controlled trial". Ultrasound Obstet Gynecol 30 (5): 687–96. PMID 17899572. doi:10.1002/uog.5158.
- ↑ DeFranco EA, O'Brien JM, Adair CD, Lewis DF, Hall DR, Fusey S, Soma-Pillay P, Porter K, How H, Schakis R, Eller D, Trivedi Y, Vanburen G, Khandelwal M, Trofatter K, Vidyadhari D, Vijayaraghavan J, Weeks J, Dattel B, Newton E, Chazotte C, Valenzuela G, Calda P, Bsharat M, Creasy GW (2007). "Vaginal progesterone is associated with a decrease in risk for early preterm birth and improved neonatal outcome in women with a short cervix: a secondary analysis from a randomized, double-blind, placebo-controlled trial". Ultrasound Obstet Gynecol 30 (5): 697–705. PMID 17899571. doi:10.1002/uog.5159.
- ↑ Fonseca EB, Celik E, Parra M, Singh M, Nicolaides KH (2007). "Progesterone and the risk of preterm birth among women with a short cervix". N. Engl. J. Med. 357 (5): 462–9. PMID 17671254. doi:10.1056/NEJMoa067815.
- ↑ Romero R (2007). "Prevention of spontaneous preterm birth: the role of sonographic cervical length in identifying patients who may benefit from progesterone treatment". Ultrasound Obstet Gynecol 30 (5): 675–86. PMID 17899585. doi:10.1002/uog.5174.
- ↑ Hassan SS, Romero R, Vidyadhari D, Fusey S, Baxter JK, Khandelwal M, Vijayaraghavan J, Trivedi Y, Soma-Pillay P, Sambarey P, Dayal A, Potapov V, O'Brien J, Astakhov V, Yuzko O, Kinzler W, Dattel B, Sehdev H, Mazheika L, Manchulenko D, Gervasi MT, Sullivan L, Conde-Agudelo A, Phillips JA, Creasy GW (2011). "Vaginal progesterone reduces the rate of preterm birth in women with a sonographic short cervix: a multicenter, randomized, double-blind, placebo-controlled trial". Ultrasound Obstet Gynecol 38 (1): 18–31. PMID 21472815. doi:10.1002/uog.9017. Resumo divulgativo – WebMD.
- ↑ "Progesterone helps cut risk of pre-term birth". Women's health. msnbc.com. 2011-12-14. Arquivado dende o orixinal o 15 de decembro de 2011. Consultado o 2011-12-14.
- ↑ D. Sriram (2007). Dorling Kindersley India Pvt. Ltd. - New Delhi, ed. Medicinal Chemistry. p. 432. ISBN 81-317-0031-3.
- ↑ Schneider JS, Stone MK, Wynne-Edwards KE, Horton TH, Lydon J, O'Malley B, Levine JE (2003). "Progesterone receptors mediate male aggression toward infants". Proc. Natl. Acad. Sci. U.S.A. 100 (5): 2951–6. PMC 151447. PMID 12601162. doi:10.1073/pnas.0130100100.
- ↑ Roof RL, Hall ED (2000). "Gender differences in acute CNS trauma and stroke: neuroprotective effects of estrogen and progesterone". J. Neurotrauma 17 (5): 367–88. PMID 10833057. doi:10.1089/neu.2000.17.367.
- ↑ Gibson CL, Gray LJ, Bath PM, Murphy SP (2008). "Progesterone for the treatment of experimental brain injury; a systematic review". Brain 131 (Pt 2): 318–28. PMID 17715141. doi:10.1093/brain/awm183.
- ↑ Wright DW, Kellermann AL, Hertzberg VS, Clark PL, Frankel M, Goldstein FC, Salomone JP, Dent LL, Harris OA, Ander DS, Lowery DW, Patel MM, Denson DD, Gordon AB, Wald MM, Gupta S, Hoffman SW, Stein DG (2007). "ProTECT: a randomized clinical trial of progesterone for acute traumatic brain injury". Ann Emerg Med 49 (4): 391–402, 402.e1–2. PMID 17011666. doi:10.1016/j.annemergmed.2006.07.932.
- ↑ Xiao G, Wei J, Yan W, Wang W, Lu Z (2008). "Improved outcomes from the administration of progesterone for patients with acute severe traumatic brain injury: a randomized controlled trial". Crit Care 12 (2): R61. PMC 2447617. PMID 18447940. doi:10.1186/cc6887.
- ↑ Pan DS, Liu WG, Yang XF, Cao F (2007). "Inhibitory effect of progesterone on inflammatory factors after experimental traumatic brain injury". Biomed. Environ. Sci. 20 (5): 432–8. PMID 18188998.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- MeshName - Progesterone [1]
- Kimball JW (2007-05-27). "Progesterone". Kimball's Biology Pages. Arquivado dende o orixinal o 18 de xuño de 2008. Consultado o 2008-06-18.
- "Progesterone Resource Center". PMS, Menopause, and Progesterone Resource Center. Oasis Advanced Wellness, Inc. Arquivado dende o orixinal o 04 de marzo de 2016. Consultado o 2008-06-18.
- General discussion document on Progesterone, its uses and applications



