Transposition pinacolique
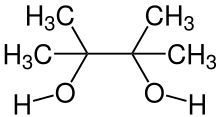

La transposition pinacolique ou réarrangement pinacolique est une réaction de chimie organique au cours de laquelle un diol vicinal est transformé en composé carbonylé sous catalyse acide[1].
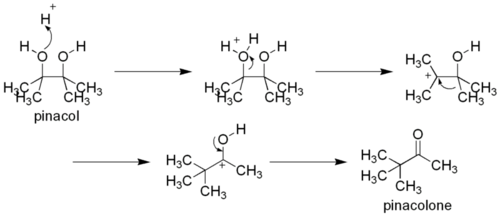
La réaction tient son nom du premier substrat sur lequel elle a été observée, le pinacol, transformé en pinacolone. Elle a été découverte en 1860 par le chimiste allemand Rudolph Fittig[1].
Mécanisme
[modifier | modifier le code]Dans un premier temps, l'un des deux groupes hydroxyle est protoné, puis est éliminé, formant un carbocation. Si les deux groupes hydroxyles ne sont pas similaires, c'est celui qui produira à terme le carbocation le plus stable qui réagira. Par la suite, un groupe alkyle du carbone adjacent migre vers le carbocation. On suppose que la force derrière cette étape de réarrangement est la production d'un ion oxonium plus stable, pour lequel tous les centres ont une configuration en octet (ce qui n'est pas le cas du précédent carbocation). Cette migration se produit selon la règle habituelle de l'aptitude migratoire des groupes, c'est-à-dire hydrure > carbanion phényle > carbanion tertiaire (si formé par la migration) > carbanion secondaire (si formé par la migration) > carbanion méthyle, le groupe partant étant celui qui stabilisera le mieux le carbocation. Enfin, le groupe hydroxyle restant se déprotone pour former un groupe carbonyle.
Exemple de réarrangement asymétrique :
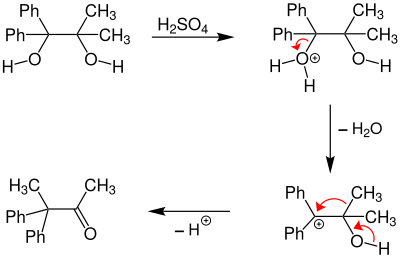
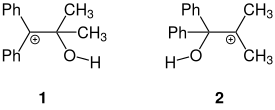
Dans le cas ci-dessus, les deux groupes -OH ne sont pas équivalents. Celui porté par le groupe portants des groupes phényles aura plus de chances de partir, car le carbocation ainsi produit sera plus stable que celui produit par le départ de l'autre groupe. En effet, la carbocation (1) est plus stable car les groupes phényles sont plus volumineux, et qu'ils peuvent en plus stabiliser le carbocation par effet mésomère, ce qui va orienter la réaction dans le sens de la migration d'un groupe méthyle plutôt que phényle.
Stéréochimie du réarrangement
[modifier | modifier le code]Cette réaction présente plus d'intérêt dans les systèmes cycliques. Dans ces réactions, la stéréochimie du diol joue un rôle crucial dans la détermination du produit majoritaire. Seul un groupe alkyle en position trans- par rapport au groupe –OH partant peut migrer. Dans le cas contraire, il se produit une expansion de cycle, c'est-à-dire que le cycle lui-même migre vers le centre carbocation. Ceci révèle un autre aspect de la réaction, à savoir que le mécanisme est largement concerté.
De plus, si l'atome-clé du groupe alkyle migrant est un centre stéréogène, sa configuration reste la même après la migration.
Histoire
[modifier | modifier le code]Si Fittig est le premier à avoir publié à propos du réarrangement pinacolique, c'est Alexandre Boutlerov qui a correctement identifié les produits de réaction[2].
Dans un article de 1859, Fittig décrit la réaction de l'acétone avec le potassium métallique[3], mais il part d'une mauvaise formule pour l'acétone, (C3H3O)n (une conséquence d'un débat bien plus large sur la masse atomique, question finalement tranchée lors du congrès de Karlsruhe en 1860). Il croyait également à tort que l'acétone était un alcool, ce qu'il espérait prouver en formant un sel métallique d'alcoolate. À la place, il obtint un produit qu'il nomma « paracétone », qu'il pensait être un dimère d'acétone (en fait le pinacol, produit de la réaction de couplage pinacolique de l'acétone). Dans une seconde publication en 1860, il fait réagir cette « paracétone » avec de l' acide sulfurique (c'est-à-dire le réarrangement pinacolique en tant que tel).
De nouveau, Fittig est incapable de donner une structure moléculaire au produit de réaction qu'il pense être un autre isomère ou un polymère. Les chimistes contemporains qui s'étaient adapté à la nouvelle réalité de la masse atomique ne firent pas mieux. Charles Friedel, par exemple, croyait que le produit de réaction était un époxyde, l'oxyde de tétraméthyléthylène[4], par analogie avec les réactions de l'éthylène glycol. C'est finalement Boutlerov qui en 1873 identifie correctement les structures après avoir synthétisé de façon indépendante l'acide triméthylacétique (acide pivalique) que Friedel avait obtenu plus tôt par oxydation par le dichromate[5].
L'un des problèmes lors de la détermination de ces différentes structures était que les réarrangements du squelette carboné étaient inconnus à cette époque. La théorie de Boutlerov permettait ce réarrangement, et avec ce nouveau concept, permit de déterminer la structure de la pinacolone.
Synthèse de composés spiro
[modifier | modifier le code]Une possible application du réarrangement pinacolique est la synthèse de composés spiro. Cette méthode commence par le couplage pinacolique d'une cétone cyclique, par exemple la cyclopentanone (1), produisant un dimère diol vicinal qui réagit ensuite par réarrangement pinacolique pour former un composé spiro (2)[6], avec une expansion du cycle de la cétone initiale.

Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pinacol rearrangement » (voir la liste des auteurs).
- (en) László Kürti et Barbara Czakó, Strategic Applications of Named Reactions in Organic Synthesis, Academic Press, , 864 p. (ISBN 978-0-12-369483-6), p. 350
- Jerome A. Berson, « What Is a Discovery? Carbon Skeletal Rearrangements as Counter-Examples to the Rule of Minimal Structural Change », Angewandte Chemie International Edition, vol. 41, no 24, , p. 4655–60 (PMID 12481317, DOI 10.1002/anie.200290007)
- W. R. Fittig, « Ueber einige Metamorphosen des Acetons der Essigsäure », Annalen der Chemie und Pharmacie, vol. 110, no 1, , p. 23–45 (DOI 10.1002/jlac.18591100104)
- Charles Friedel, « Recherches sur les acétones et sur les aldéhydes », Annales de chimie et de physique, vol. 16, , p. 310 (lire en ligne)
- Alexandre Boutlerov, « Ueber Trimethylessigsäure », Justus Liebigs Annalen der Chemie und Pharmacie, vol. 170, nos 1–2, , p. 151–162 (DOI 10.1002/jlac.18731700114, lire en ligne)
- Stuart Warren, Designing Organic Syntheses – A programmed introduction to the Synthon Approach, John Wiley & Sons, , 285 p. (ISBN 978-0-471-99612-5, lire en ligne), p. 49


