Flamme (combustion)

Une flamme est le lieu de réactions de combustion vive se produisant dans une zone d'épaisseur faible : elle produit de la chaleur et émet en général de la lumière. Elle est à l'origine de la production du feu.
Une flamme est parfois qualifié de plasma[1], un état particulier de la matière.
Phénomène visuel
[modifier | modifier le code]
La lumière produite par une flamme résulte d'une réaction de combustion. Celle-ci est une réaction d'oxydo-réduction. Dans le cas des métaux - dans le cas de la combustion du magnésium par exemple - la combustion est bien décrite par un échange d'électrons qui produit des ions entre le métal (donneur) et l'oxygène (accepteur). Dans le cas des molécules (cas du méthane), la réaction est mieux décrite par un échange d'atomes d'oxygène. Dans tous les cas, l'exothermicité de la combustion porte le solide ou le gaz à une température élevée (parfois plusieurs milliers de kelvins).
Un solide à température élevée (par exemple le fer en brûlant) produit un rayonnement continu dont la longueur d'onde d'intensité maximale est bien décrite par la loi de Wien. Dans le cas des gaz (par exemple la flamme du sodium), la désexcitation résulte de transition électronique produisant des photons de longueur d'onde caractéristique du corps émetteur. La lumière possède alors un spectre de raies.
Typologie
[modifier | modifier le code]On distingue deux types de flamme :
- la flamme de diffusion : dans ce cas-là, les réactifs — combustible et comburant — sont séparés ;
- la flamme de prémélange : dans ce cas-là, les réactifs forment une phase homogène.
Flamme de diffusion
[modifier | modifier le code]
La flamme de diffusion est appelée ainsi car, les réactants étant séparés, ils doivent venir au contact l'un de l'autre, par le phénomène de diffusion. Les cas typiques sont :
- la combustion des solides (bois, bougie, papier, etc.) ;
- la combustion des liquides (essence, gazole, pétrole, etc.), sous forme « massive » (flaque, réservoir) ou de brouillard (moteur Diesel) ;
- le moteur-fusée utilise des flammes de diffusion, typiquement hydrogène/oxygène ou kérosène/oxygène ;
- la combustion des gaz non mélangés à l'air, par exemple un gaz sortant directement d'une bouteille ne contenant pas d'air, une fuite sur une canalisation qui s'enflamme tout de suite.
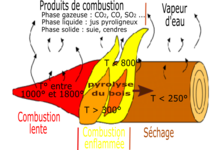
Dans le cas d'un feu de solides ou de liquides, la combustion produit de la chaleur ; cette chaleur provoque un phénomène de distillation, de pyrolyse ou simplement de fusion puis de vaporisation qui produit un gaz inflammable, qui vient alimenter la flamme. Que ce soit donc un feu de solide, de liquide ou de gaz, on a :
- au centre de la flamme : un gaz combustible ;
- la flamme elle-même est une mince couche de gaz au sein de laquelle se déroule la réaction de combustion ;
- à l'extérieur de la flamme : le gaz comburant, en général le dioxygène de l'air, et les produits de réaction (gaz et particules).
Ce phénomène peut être très complexe ; par exemple, la combustion du kérosène dans les moteurs d'avion peut être décrite par 3 500 réactions faisant intervenir 225 espèces chimiques[2].
Cette réaction est souvent incomplète, puisque sur le lieu de la réaction, la mince couche de la flamme, le rapport entre combustible et comburant n'est pas idéal (non-stœchiométrique). On a donc des gaz très divers — dioxyde de carbone (CO2) et vapeur d'eau (H2O), souvent monoxyde de carbone (CO), autres gaz de réaction et gaz imbrûlés — ainsi que des particules de suie qui brûlent à leur tour. De plus, la haute température atteinte grâce à la combustion provoque la formation d'oxydes d'azote.
Anatomie
[modifier | modifier le code]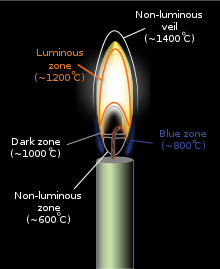
La flamme de diffusion se compose de plusieurs parties selon le niveau de température et de luminosité. Pour une bougie, on observe[3] :
- une zone non lumineuse : vaporisation de la cire aux alentours de 600 °C, l'absence d'émission de lumière expliquant cette luminosité ;
- une zone bleue : formation de radicaux libre (C2•, CH•) aux alentours de 800 °C, due à un phénomène, la chimiluminescence responsable de l'émission de lumière bleue provenant de la recombinaison de paires d'atomes très instables avec d'autres composés chimiques ;
- une zone sombre : début de pyrolyse dans une région pauvre en dioxygène, à une température de l'ordre de 1 000 °C. La formation de particules de suie par excès de combustible[note 1] réduit la luminosité ;
- une zone lumineuse : la pyrolyse se poursuit, formant des particules de suie plus grosses et qui sont portées à incandescence par combustion incomplète, émettant une flamme blanc-jaune à 1 200 °C (à 1 500 °C, les particules de suie émettent une lumière blanche, selon le modèle du rayonnement du corps noir), et orangée dans sa partie inférieure et haute (environ 700 °C à 1 000 °C)
- un voile non lumineux, zone aux alentours de 1 400 °C où se réalise une combustion complète (toute la cire s'est transformée en dioxyde de carbone et en eau).
La forme de cette flamme est en grande partie due aux mouvements de convection animés par la poussée d'Archimède (gaz chauds montant dans la flamme) et par les forces de gravité (molécules d'air froid redescendant par gravité). L'alimentation en comburant ne peut donc se faire que par les côtés.
Flamme en microgravité
[modifier | modifier le code]
En situation de microgravité (apesanteur), les différences de densité entre air chaud et air froid n'interviennent plus : la convection n'emporte pas les produits de la combustion (CO2 et H2O, par exemple) loin de la flamme. En conséquence, la flamme de diffusion adopte une forme sphérique et les produits de la combustion bloquent l'accès de l'oxygène à la flamme. En l'absence de mouvements d'air provoqués (souffle, par exemple), celle-ci tend à s'éteindre d'elle-même dans un délai assez bref.
Flamme de prémélange
[modifier | modifier le code]Dans le cas de la flamme de prémélange, le combustible est toujours un gaz, parfaitement mélangé au comburant. On parle aussi de flamme aérée.
Les exemples les plus courants sont :
- le bec Bunsen et le brûleur de la cuisinière : ces dispositifs présentent une entrée d'air permettant aux gaz de se mélanger avant de sortir ;
- le chalumeau : il est alimenté en gaz combustible et en dioxygène pur, le mélange se faisant avant la buse ;
- le moteur à allumage commandé (moteur essence), l'allumage des gaz prémélangés est réalisé par une bougie ;
- les explosions de gaz, et dans les incendies, les phénomènes de propagation rapide du feu (explosion de fumées, embrasement généralisé éclair, coup de grisou).
Même si le mélange n'est pas parfait, le mélange intime des réactants fait que la combustion est plus efficace, la flamme est donc plus chaude et produit peu de particules imbrûlées, elle est donc bleue.
-
Flamme de prémélange avec écoulement du gaz.
-
Flamme d'un bec Bunsen.
Anatomie
[modifier | modifier le code]La flamme est une mince couche de gaz, qui est la frontière entre deux milieux :
- les « gaz frais » (mélange combustible-comburant) d'un côté ;
- les gaz brûlés (produits de réaction) de l'autre.
Le schéma ci-dessus montre une flamme de bec Bunsen ; dans ce cas-là, les gaz frais arrivent avec une certaine vitesse, le front de flamme progresse en sens inverse, ce qui fait que globalement, la flamme est immobile.
Dans de nombreux cas, les gaz frais sont au repos par rapport au référentiel ; dans ce cas-là, le front de flamme se déplace. Selon sa vitesse de propagation, on parle de détonation (dans le cas supersonique) ou de déflagration (pour des vitesses de flamme subsoniques).
Propagation
[modifier | modifier le code]Les trois paramètres principaux de propagation de la flamme sont :
- les proportions du mélange : plus on est proche de la stœchiométrie, plus la flamme se propage vite ;
- la température des gaz frais : plus la température est élevée (proche de la température provoquant l'inflammation spontanée), plus la propagation est élevée ;
- l'écoulement des gaz : les obstacles et turbulences modifient la progression de la flamme.
Le refroidissement du gaz frais permet ainsi de ralentir la progression de la flamme de prémélange, voire de l'arrêter :
- dans un feu d'intérieur (local clos ou semi-clos), les sapeur-pompiers refroidissent la fumée en pulvérisant de l'eau (voir l'article Lutte contre l'incendie > Feu en lieu clos) ;
- une grille peut bloquer la flamme : la grille, du fait de sa grande surface spécifique, absorbe la chaleur de la flamme et l'empêche de se propager de l'autre côté ; cette propriété a été utilisée par Humphry Davy pour la conception des lampes de sûreté dans les mines, mais aussi pour protéger les machines fonctionnant dans un milieu potentiellement explosif.
Forme et cinétique
[modifier | modifier le code]La forme et la cinétique de la flamme sont étudiées dans l'article Front de flamme.
Notes et références
[modifier | modifier le code]Notes
[modifier | modifier le code]- Un dépôt de suie se fait sur une assiette au-dessus de la flamme.
Références
[modifier | modifier le code]- « flamme = plasma ? », sur forums.futura-sciences.com (consulté le )
- Boyer 2006, p. 57.
- (en) Robert de Hilster, « The candle, the light bulb and the radio » (conférence annuelle, Vancouver), CNPS Proceedings of the Natural Philosophy Society, ed. John Chappell, vol. 3, , p. 13-16 (lire en ligne [sur books.google.fr]). Voir p. 13.
Annexes
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- [Boyer 2006] Louis Boyer, Feu et flammes, Paris, Belin, coll. « Pour la science », , 189 p. (ISBN 2-7011-3973-2).
- [Valeur 2011] Bernard Valeur, La couleur dans tous ses éclats, Belin, , 224 p. (ISBN 978-2-7011-5876-1 et 2-7011-5876-1).
Articles connexes
[modifier | modifier le code]- Fondation de recherches internationales sur les flammes
- Feu
- Combustion
- Triangle du feu
- Classe de feux
- Incendie
- Front de flamme
Liens externes
[modifier | modifier le code]- Groupement français de combustion, « Dictionnaire de la combustion », sur combustioninstitute.fr




