Fenilalanina hidroxilasa
| Fenilalanina hidroxilasa | ||||
|---|---|---|---|---|
 | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolos | PAH (HGNC: 8582) PH, PKU | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 1.14.16.1 | |||
| Locus | Cr. 12 q22-24.2 | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
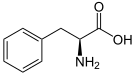
La Fenilalanina hidroxilasa (PAH) (EC 1.14.16.1) es la enzima que cataliza la conversión del aminoácido fenilalanina en tirosina
Reacción catalizada
[editar]La PAH cataliza la reacción
Estructura y características enzimáticas
[editar]La PAH pertenece a una familia de hidroxilasas de aminoácidos aromáticos que introducen grupos hidróxilo en anillos aromáticos; la tirosina hidroxilasa y la triptófano hidroxilasa pertenecen a esta familia. Estas enzimas comparten muchas características físicas, estructurales y catalíticas. Son monoxigenasas que requieren la presencia de oxígeno molecular y de una coenzima de tipo pteridina, la tetrahidrobiopterina (BH
4), y que reducen un átomo de oxígeno a agua en una reacción en que se forma 4α-carbinolamina; el otro átomo de oxígeno pasa a formar parte del grupo hidróxilo. La tetrahidrobiopterina que en el curso de la reacción se oxida, dando lugar a dihidrobiopterina.[1]
. Posteriormente se reduce a tetrahidrobiopterina nuevamente mediante la dihidropterina reductasa, que utiliza NADH como coenzima.
El gen PAH, que se localiza en el cromosoma 12 en la especie humana, codifica la fenilalanina hidroxilasa.
La enzima activa es un tetrámero compuesta de 4 subunidades idénticas. En cada subunidad se pueden apreciar tres dominios o regiones:
- El dominio regulador constituido por aproximadamente 115 aminoácidos del extremo N-terminal.
- El dominio catalítico consta de los 300 aminoácidos siguientes, y es responsable de la actividad catalítica de la enzima.
- El dominio de tetramerización constituido por el extremo C-terminal y permite la interacción con las otras subunidades para formar la estructura tetramerica de la holoenzima.
Cada subunidad contiene un átomo de hierro unido que es necasario para la catálisis.
Importancia clínica
[editar]Mutaciones en la PAH da lugar a una actividad enzimática menor y causa la enfermedad fenilcetonuria, o PKU.
Referencias
[editar]- ↑ Kaufman, D (1 de febrero de 1958). «A New Cofactor Required for the Enzymatic Conversion of Phenylalanine to Tyrosine.». J. Biol. Chem. 230 (230): 931-39. PMID 13525410. Archivado desde el original el 6 de octubre de 2008. Consultado el 5 de julio de 2010.
Léase también
[editar]- Eisensmith RC, Woo SL (1993). «Molecular basis of phenylketonuria and related hyperphenylalaninemias: mutations and polymorphisms in the human phenylalanine hydroxylase gene.». Hum. Mutat. 1 (1): 13-23. PMID 1301187. doi:10.1002/humu.1380010104.
- Konecki DS, Lichter-Konecki U (1991). «The phenylketonuria locus: current knowledge about alleles and mutations of the phenylalanine hydroxylase gene in various populations.». Hum. Genet. 87 (4): 377-88. PMID 1679029. doi:10.1007/BF00197152.
- Cotton RG (1991). «Heterogeneity of phenylketonuria at the clinical, protein and DNA levels.». J. Inherit. Metab. Dis. 13 (5): 739-50. PMID 2246858. doi:10.1007/BF01799577.
- Erlandsen H, Fusetti F, Martinez A, et al. (1998). «Crystal structure of the catalytic domain of human phenylalanine hydroxylase reveals the structural basis for phenylketonuria.». Nat. Struct. Biol. 4 (12): 995-1000. PMID 9406548. doi:10.1038/nsb1297-995.
- Waters PJ, Parniak MA, Nowacki P, Scriver CR (1998). «In vitro expression analysis of mutations in phenylalanine hydroxylase: linking genotype to phenotype and structure to function.». Hum. Mutat. 11 (1): 4-17. PMID 9450897. doi:10.1002/(SICI)1098-1004(1998)11:1<4::AID-HUMU2>3.0.CO;2-L.
- Waters PJ (2003). «How PAH gene mutations cause hyper-phenylalaninemia and why mechanism matters: insights from in vitro expression.». Hum. Mutat. 21 (4): 357-69. PMID 12655545. doi:10.1002/humu.10197.