Enlace simple


En química, un enlace simple consiste en una ligazón entre dos átomos que involucra dos electrones de valencia. Es decir, los átomos comparten un par de electrones donde se forma la ligazón.[1] Por tanto, un enlace sencillo es un tipo de enlace covalente. Cuando se comparte, cada uno de los dos electrones involucrados ya no está en posesión exclusiva del orbital en el que se originó. Más bien, los dos electrones pasan tiempo en cualquiera de los orbitales que se superponen en el proceso de enlazado. Como estructura de Lewis, un enlace simple se denota como AːA o AA, para el cual A representa un elemento.[2] En la primera interpretación, cada punto representa un electrón compartido, y en la segunda interpretación, la barra representa ambos electrones compartidos en el enlace simple.
Un enlace covalente también puede ser doble o triple. Un enlace sencillo es más débil que uno doble o que uno triple. Esta diferencia de fuerza puede explicarse examinando los enlaces componentes de los que consta cada uno de estos tipos de enlaces covalentes.[2]
Propiedades
[editar]Por lo general, un enlace sencillo es un enlace sigma. Una excepción es el enlace en diboron, que es un enlace pi. En contraste, el enlace doble consta de un enlace sigma y un enlace pi, y un enlace triple consta de un enlace sigma y dos enlaces pi. El número de enlaces de componentes es lo que determina la disparidad de fuerza. Es lógico pensar que el enlace simple es el más débil de los tres porque consiste únicamente en un enlace sigma, mientras que los enlaces doble y triple consisten no solo en este tipo de enlace componente, sino también en al menos una ligazón adicional.
El enlace simple tiene la capacidad de rotación, una propiedad que no poseen los enlaces doble y triple. La estructura de los enlaces pi no permite la rotación (al menos no a 298 K), por lo que los enlaces doble y triple que contienen enlaces pi se mantienen debido a esta propiedad. El enlace sigma no es tan restrictivo y el enlace simple puede rotar utilizando el enlace sigma como eje de rotación.[2]
Se puede hacer otra comparación de propiedades en la longitud de la ligazón. Los enlaces simples son los más largos de los tres tipos de enlaces covalentes, ya que la atracción interatómica es mayor en los otros dos tipos, doble y triple. El aumento en los enlaces de los componentes es la razón de este aumento de atracción a medida que se comparten más electrones entre los átomos enlazados.[2]
Los enlaces simples se dan a menudo en moléculas diatómicas, como en los ejemplos siguientes: H2, F2 y HCl.
Los enlaces simples también se observan en moléculas formadas por más de dos átomos. Ejemplos de este tipo incluyen:
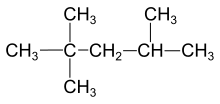
Los enlaces simples aparecen incluso en moléculas tan complejas como los hidrocarburos más grandes que el metano. El tipo de enlace covalente en los hidrocarburos es extremadamente importante en la nomenclatura de estas moléculas. Los hidrocarburos que contienen solo enlaces simples se denominan alcanos. Los nombres de moléculas específicas que pertenecen a este grupo terminan con el sufijo -ano. Los ejemplos incluyen etano, 2-metilbutano y ciclopentano.[2]
Véase también
[editar]Referencias
[editar]- ↑ «covalent bonding - single bonds». Chemguide.co.uk. Consultado el 12 de agosto de 2012.
- ↑ a b c d e Moore, John W.; Jurs, Peter C. (2011). Chemistry : the molecular science (4th ed edición). Brooks/Cole Cengage Learning. ISBN 978-1-4390-4930-3. OCLC 432983823.

