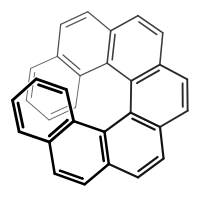
Helicene
Helicene sind eine vom Begriff Helix abgeleitete Stoffgruppe der Chemie.[1] Die Helicene sind aromatische Verbindungen, die formal aus Phenanthren (ein planares Molekül) durch winkelförmige ortho-Anellierung entstehen. Die Anzahl der kondensierten Benzolringe variiert. Es sind Helicene mit bis zu 16 anelierten Benzolringen bekannt, also [16]Helicene.[2]
Chiralität
[Bearbeiten | Quelltext bearbeiten]-
(P)-(+)-Heptahelicen weist Helizität im Uhrzeigersinn auf.
-
(M)-(–)-Heptahelicen weist Helizität entgegen dem Uhrzeigersinn auf.
-
Wendeltreppe im Vatican-Museum in Rom als Beispiel für einen schraubenförmigen Baukörper zum Vergleich. Die Symmetrie entspricht der von (P)-Heptahelicen
-
Die Schraubendrehung dieser Kletterpflanze entspricht dem Drehsinn von (M)-Heptahelicen
Aus räumlichen Gründen ist bereits Hexahelicen ([6]Helicen, C26H16) schraubenförmig angeordnet. Diese schraubenförmige Anordnung der Benzolringe führt dazu, dass [6]Helicen, [7]Helicen (C30H18), [8]Helicen (C34H20) und [9]Helicen (C38H22)[3] usw. notwendigerweise Dissymmetrie aufweisen und somit chirale aromatische Kohlenwasserstoffe sind.[4] Diese helixförmigen Moleküle besitzen axiale Chiralität, sie bilden eine eigene Gruppe innerhalb der Strukturen mit chiraler Achse.
Racemische Helicene – z. B. das 1:1-Gemisch aus (P)-(+)-Heptahelicen und (M)-(–)-Heptahelicen – lassen sich chromatographisch an einer chiralen stationären Phase trennen.[4]
Isomerie
[Bearbeiten | Quelltext bearbeiten]In den Helicenen sind die Benzolringen 1,2-anelliert, in den strukturisomeren Acenen liegt jedoch eine 3,4-Verknüpfung der Benzolringe vor, so dass eine lineare Struktur resultiert.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Über eine durch circular polarisiertes Licht induzierte Synthese lässt sich beispielsweise gezielt (–)-[6]Helicen synthetisieren.[5] Die Racematspaltung von (±)-[6]Helicen ist ebenfalls bekannt.[6]
Die Racemisierung von (–)-[6]Helicen erfordert nur einen geringen Energieaufwand.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Trotz ihrer interessanten chiralen, physikalischen, elektronischen und optischen Eigenschaften waren Helicene erst spät Gegenstand anwendungstechnischer Untersuchungen. Inzwischen beschäftigen sich die Materialwissenschaften, die Nanotechnologie, die Biochemie, die Flüssigkristallforschung, die Polymerchemie, die supramolekulare Chemie sowie die präparative Stereochemie mit der Suche nach praktisch relevanten Anwendungsgebieten für Helicene.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Bernhard Testa: Grundlagen der Organischen Stereochemie, Verlag Chemie, Weinheim 1983, S. 65–68, ISBN 3-527-25935-X.
- ↑ Marc Gingras: One hundred years of helicene chemistry. Part 1: non-stereoselective syntheses of carbohelicenes, Chem. Soc. Rev. 42 (2013), 968–1006.
- ↑ R. H. Martin, M. Flammang-Barbieux, J. P. Cosyn, M. Gelbcke, Tetrahedron Letters 1968, 3507.
- ↑ a b Marc Gingras, Guy Félix und Romain Peresutti: One hundred years of helicene chemistry. Part 2: stereoselective syntheses and chiral separations of carbohelicenes, Chem. Soc. Rev. 42 (2013), 1007–1050.
- ↑ O. Buchardt, Angewandte Chemie, 86, 1974, 222–228.
- ↑ M. S. Newman und D. Lednicer, Journal of the American Chemical Society, 78, 1956, 4765.
- ↑ Marc Gingras: One hundred years of helicene chemistry. Part 3: applications and properties of carbohelicenes, Chem. Soc. Rev. 42 (2013), 1051–1095.
Literatur
[Bearbeiten | Quelltext bearbeiten]- T. Hahn: Kristallographische Daten für Hexahelicen, C26H16. In: Acta Crystallographica; Volume 11, Issue 11 (1967) doi:10.1107/S0365110X58002310