Hydrogenbinding
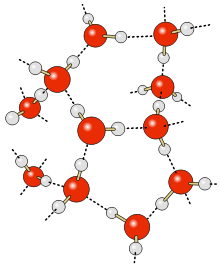
En hydrogenbinding er en tiltrækkende kraft imellem molekyler eller dele af molekyler. Bindingen dannes imellem et svagt elektropositivt hydrogenatom og et af de elektronegative atomer som ilt, kvælstof eller fluor. For at hydrogentatomet kan være elektropositivt, skal det være kovalent bundet til et elektronegativt atom.
Hydrogenbindinger kan dannes imellem forskellige molekyler, eller imellem forskellige atomer i det samme molekyle. I DNA er det f.eks. hydrogenbindinger imellem baseparrene, der holder de to strenge sammen, og i proteiner er hydrogenbindingerne med til at definere og holde sammen på den rumlige struktur.
Hydrogenbindinger varierer i styrke fra meget svage (1-2 kJ/mol) til ekstremt stærke (150 kJ/mol), så stærke at de ikke kan skelnes fra en kovalent binding, som f.eks. i ionen . Nogle typiske værdier er:
- F-H...:F (40 kcal/mol)
- O—H...:N (7 kcal/mol)
- O—H...:O (5 kcal/mol)
- N—H...:N (3 kcal/mol)
- N—H...:O (2 kcal/mol)
Hydrogenbindingers længde afhænger af bindingsstyrken, temperaturen og trykket. Den typiske længde af en hydrogenbinding i vand er 1.97 Å (197 pm).
Hydrogenbindinger i vand
[redigér | rediger kildetekst]Hydrogenbindinger forekommer særligt i vand (H2O). Bindingerne er relativt svage, men da der er mange af dem, giver de vandet nogle helt specielle fysiske egenskaber som f.eks. et meget højt kogepunkt, som skyldes at det kræver meget energi at bryde bindingerne mellem molekylerne. Til sammenligning har forbindelsen H2S et så meget lavere kogepunkt end vand, at den er en gas ved stuetemperatur, selvom den har en meget højere molekylvægt. Dette skyldes at H2S ikke indeholder hydrogenbindinger.
Hydrogenbindinger i biologi
[redigér | rediger kildetekst]Hydrogenbindinger er meget vigtige i biologien. I næsten alle biologiske og biokemiske reaktioner, der er katalyserede af enzymer, spiller hydrogenbindinger en stor rolle. Det skyldes at enzymers substrat meget ofte bindes til enzymet ved hjælp af en eller flere hydrogenbindinger.
Derudover er hydrogenbindinger vigtige for den rumlige opbygning af makromolekyler som proteiner og DNA. Proteinernes sekundære strukturelementer bliver stabiliseret af hydrogenbindinger, som er også er med til at holde sammen på både den tertiære og den kvarternære struktur.
Carbon-Oxygen Hydrogenbinding
[redigér | rediger kildetekst]| Eftersyn Dette afsnit bør gennemlæses af en person med fagkendskab for at sikre den faglige korrekthed. |
Carbon-oxygen (CH···O) hydrogenbindinger repræsenterer en usædvanlig kategori af molekylære interaktioner som først er dokumenteret i biologiske strukturer inden for de sidste 40 år. Selvom CH···O hydrogenbindinger generelt er forblevet undervurderet i den biokemiske litteratur, har undersøgelser i løbet af de sidste 15 år begyndt at give direkte bevis for disse interaktioner i biologiske systemer.
Konventionelle hydrogenbindinger (NH···O, OH···O, OH···N og NH···N) repræsenterer grundlæggende stabiliserende kræfter i biomolekylær struktur.

Traditionelt har carbon ikke været betragtet som en konventionel hydrogenbindingsdonor på grund af sin relativt lave elektronegativitet sammenlignet med oxygen og nitrogen. Imidlertid har flere undersøgelser vist, at selv alifatiske carbon-atomer kan danne svage hydrogenbindinger, der er betegnet som CH···O hydrogenbindinger. I kontrast kan carbon-atomer, med øget polarisering på grund af tilstødende atomer, teoretisk set deltage i hydrogenbindinger så stærke som de, der dannes ved traditionelle donorer, især oxygen eller nitrogen.
I 1960'erne blev bidragene fra disse interaktioner for protein-struktur belyst. Ved brug af C···C interaktioner som reference, er der inden for nyere tid påvist en udbredte karakter af CH···O hydrogenbindinger i proteiner, især i standard rygraden i bindingsmønster af β-sheets. Undersøgelser har påvist med sikkerhed, at Cα–Hα···O=C hydrogenbindinger er meget udbredt i proteiners struktur og bør betragtes som en byggesten for sekundære og tertiære struktur.
Udover rygrad-interaktioner, er der også eksperimentelt bevis for CH···O hydrogenbindinger involverer aminosyre-sidekæder i protein-strukturen. Desuden er CH···O hydrogenbindinger blevet opdaget i nukleinsyre.
Se også
[redigér | rediger kildetekst]
Henvisninger
[redigér | rediger kildetekst]- Carbon-Oxygen-Hydrogenbinding i biologisk struktur og funktion - J Biol Chem., 7. December, 2012 - (engelsk)
| Spire Denne artikel om kemi er en spire som bør udbygges. Du er velkommen til at hjælpe Wikipedia ved at udvide den. |




