Carbonu
Apariencia
| |||||||||||||||||||||||||
| Xeneral | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
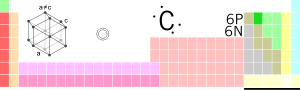
| Nome, Símbolu, Númberu | carbonu, C, 6 | ||||||||||||||||||||||||
| Serie química | non metales | ||||||||||||||||||||||||
| Grupu, Periodu, Bloque | 14, 2, p | ||||||||||||||||||||||||
| Aspeutu |  negru (grafitu) incoloru (diamante) | ||||||||||||||||||||||||
| Masa atómica | 12,0107 uma | ||||||||||||||||||||||||
| Configuración electrónica | 1s2 2s2 2p2 | ||||||||||||||||||||||||
| Electrones per capa | 2, 4 | ||||||||||||||||||||||||
| Propiedaes físiques | |||||||||||||||||||||||||
| Estáu de la materia | sólidu | ||||||||||||||||||||||||
| Densidá | (grafitu) 2.267 kg/m³ (diamante) 3.513 kg/m³ | ||||||||||||||||||||||||
| Puntu de fusión | 4.027-4.427 K | ||||||||||||||||||||||||
| Puntu de bullidura | 4.000 K | ||||||||||||||||||||||||
| Entalpía de fusión | (grafitu) 100 kJ/mol (diamante) 120 kJ/mol | ||||||||||||||||||||||||
| Entalpía de vaporización | 355,8 kJ/mol | ||||||||||||||||||||||||
| Capacidá calorífica | (25°C) (grafitu) 8,517 J/mol·K (25 °C) (diamante) 6,115 J/mol·K | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propiedaes atómiques | |||||||||||||||||||||||||
| Estructura cristalina | hexagonal | ||||||||||||||||||||||||
| Estaos d'oxidación | 4, 2 (llevemente ácidu) | ||||||||||||||||||||||||
| Electronegatividá | 2,55 (Pauling) | ||||||||||||||||||||||||
| Potenciales d'ionización (más) | 1ᵘ: 1.086,5 kJ/mol | ||||||||||||||||||||||||
| 2ᵘ: 2.352,6 kJ/mol | |||||||||||||||||||||||||
| 3ᵘ: 4.620,5 kJ/mol | |||||||||||||||||||||||||
| Radiu atómicu | 70 pm | ||||||||||||||||||||||||
| Radiu atómicu calculáu | 67 pm | ||||||||||||||||||||||||
| Radiu covalente | 77 pm | ||||||||||||||||||||||||
| Radiu de van der Waals | 170 pm | ||||||||||||||||||||||||
| Otros datos | |||||||||||||||||||||||||
| Magnetismu | diamagnéticu | ||||||||||||||||||||||||
| Conductividá térmica | (300 K) (grafitu) 119-165 W/m·K (300 K) (diamante) 900-2.320 W/m·K | ||||||||||||||||||||||||
| Difusividá térmica | (300 K) (diamante) 503-1.300 mm²/s | ||||||||||||||||||||||||
| Dureza Mohs | (grafitu) 1-2 (diamante) 10 | ||||||||||||||||||||||||
| Códigu CAS | 7440-44-0 | ||||||||||||||||||||||||
| Isótopos más estables | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Unidades nel SI y en condiciones normales (0ºC y 1 atm) | |||||||||||||||||||||||||
El carbonu[1] ye un elementu químicu de númberu atómicu 6 y símbolu C. Ye sólidu a temperatura ambiente. Dependiendo de les condiciones de formación, pue atopase na natura en distintes formes alotrópiques, carbonu amorfu y cristalinu en forma de grafitu o diamante. Ye'l pegollu básicu de la química orgánica; conócense al rodiu de 10 millones de compuestos de carbonu, y forma parte de tolos seres vivos conocíos.
Ver tamién
[editar | editar la fonte]Referencies
[editar | editar la fonte]- ↑ Esti términu apaez nel Diccionariu de l'Academia de la Llingua Asturiana. Ver: carbonu
Enllaces esternos
[editar | editar la fonte]- (castellán) Divulgación sobre ciencia y teunoloxía de los materiales de carbón, l'elementu carbonu y les sos formes alotrópiques Archiváu 2010-10-28 en Wayback Machine
- (castellán) Institutu Nacional de Seguridá y Hixene nel Trabayu d'España: Ficha internacional de seguridá química del carbonu
- (n'inglés) WebElements.com
- (n'inglés) EnvironmentalChemistry.com
- (n'inglés) Ye Elemental
- (n'inglés) Fullerenos y otros estaos alotrópicos; modelos realizaos por Vincent Herr