Лучење
Лучење је кретање материјала из једног места у друго, нпр. лучење хемијске супстанце из ћелије или жлезде. Слично томе, излучивање је уклањање одређених супстанци или отпадних производа из ћелије или организма. Уобичајени механизам ћелијског лучења је путем секреторних канала на ћелијској мембрани, званих порозоми.[1] Порозоми су перманентне липопротеинске структуре у облику чашице на мембрани. На месту порозома се секреторне везикуле фузионишу са ћелијском мембраном, како би ослободиле интравезикуларни ћелијски садржај.
Лучење код бактеријских врста представља транспорт или транслокацију ефекторских молекула, на пример: протеина, ензима или токсина (нпр. токсин колере код Vibrio cholerae), из унутрашњости (цитоплазме или цитосола) бактеријске ћелије у спољашњост. Лучење је веома важан механизам за прилагођавање и преживљавање бактерија у њиховом природном окружењу.
Код еукариотских ћелија
[уреди | уреди извор]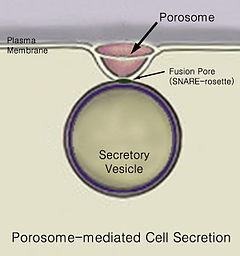
Механизам
[уреди | уреди извор]Еукариотске ћелије, укључујући и људске ћелије, имају високо еволуиран процес лучења. Протеини ванћелијског садржаја синтетишу се помоћу рибозома везаних за гранулирани ендоплазматски ретикулум (ЕР). Како се синтетишу, ови протеини се транслоцирају у лумен ЕР, где подлежу гликозилацији и бивају сакупљани од стране молекуларних шаперона. Такође, овде се погрешно савијани протеини идентификују и ретротранслоцирају у цитосол од стране ЕР-асоцираног са деградацијом, где се разграђују протеазама. Везикуле које садрже правилно савијене протеине одлазе у Голџијев апарат.
У Голџијевом апарату се гликозилација протеина модификује, и може доћи до даље посттранслационе модификације, укључујући цепање и функционализацију. Протеини затим секреторним везикулама који путују дуж цитоскелета до ивице ћелије. Модификација се може догодити и у секреторним везикулама (на пример, инсулин настаје од проинсулина у секреторним везикулама).
На крају, долази до фузије везикула са ћелијском мембраном у структури која се назива порозом, у процесу званом егзоцитоза, што резултује избацивањем интравезикуларног садржаја из ћелије.[2]
Стриктна биохемијска контрола се одржава путем pH градијента: pH цитосола је 7,4, ендоплазматичог ретикулума 7,0, а голџијевог апарата 6,5. Секреторне везикуле имају pH између 5,0 и 6,0; неке секреторне везикуле постану лизозоми, који имају pH 4,8.
Неуобичајена секреција
[уреди | уреди извор]Постоје многи протеини, попут FGF1 (aFGF), FGF2 (bFGF), интерлеукин 1 (IL1) и сл. који немају сигналну секвенцу. Они не користе класични ЕР-Голџи пут, већ се излучују на различите неуобичајене начине.
Описана су најмање четири пута неуобичајене (неконвенционалне) протеинске секреције.[3] Они укључују: 1) директну транслокацију протеина кроз плазмамембрану вероватно путем мембранских транспортера, 2) „блебинг”, 3) лизозомалну секрецију и 4) ослобађање путем егзозома изведених од мултивезикуларних тела. Поред тога, протеини се могу ослобађати из ћелија механичким или физиолошким рањавањем[4] и преко нелеталних, пролазних онкотских пора у плазма мембрани, индукованих испирањем ћелија са медијумом или пуферима без серума.[5]
У људским ткивима
[уреди | уреди извор]Многи типови људских ћелија имају способност да буду секреторне ћелије, јер имају добро развијен ендоплазматички ретикулум и Голџијев апарат. Ткива код људи која стварају излучевине укључују: гастроинтестинални тракт који излучује дигестивне ензиме и желудачну киселину, плућа која луче сурфактанте, и лојне жлезде које луче себум за подмазивање коже и косе.
Код грам-негативних бактерија
[уреди | уреди извор]Секреција није својствена само за еукариоте, већ је присутна и у бактеријама и археама. АBC транспортери (ATP binding cassette) заједнички су за сва три домена живог света. Неки излучени протеини се транслоцирају преко плазмамембране помоћу Sec translocon-а, једног од два система транслокације, за који је потребно присуство N-терминалног сигналног пептида на излученом протеину. Остали се транслоцирају преко цитоплазматске мембране путем двоструко-аргининске транслокације (Тат). Грам-негативне бактерије имају две мембране, што излучивање чини комплекснијим. Постоји најмање шест специјализованих система за излучивање код грам-негативних бактерија. Многи излучени протеини су посебно важни у бактеријској патогенези.[6]
Систем лучења типа I (T1SS или TOSS)
[уреди | уреди извор]Лучење типа I је систем који зависи од шаперона и који користи Hly и Tol ген кластере. Процес започиње након препознавања водеће HlyА секвенце и везивања за HlyB са мембране. Ова сигнална секвенца је изузетно специфична за ABC транспортер. Затим HlyAB комплекс стимулише HlyD, који почиње да се одваја и доспева на спољашњу мембрану, Сигнал на HlyD или терминални молекул, препознаје TolC. Заправо, HlyD регрутује TolC на унутрашњу мембрану, а HlyA се излучује изван спољашње мембране преко протеинског канала дугог тунела.
Систем типа I преноси разне молекуле, од јона, лекова, до протеина различите величине (20—900 kDa). Молекули који се излучују варирају у величини, од малог пептида колицина V (10 kDа, Escherichia coli), до ћелијског адхезиног протеина LapA (520 kDа, Pseudomonas fluorescens). [7] Најбоље су окарактерисани RTX токсини и липазе. Лучење типа I такође је укључено у извоз непротеинских супстрата, попут цикличних β-глукана и полисахарида.
Систем лучења типа II (T2SS)
[уреди | уреди извор]Протеини који се луче системом типа II, или главним терминалним огранком опште секреције, зависе од Sec или Tat система за иницијални транспорт у периплазму. Кад доспеју тамо, они пролазе кроз спољашњу мембрану преко мултисубјединичног (12–14 субјединица) комплекса поре, формирајући протеине секрета. Поред протеина секрета, 10–15 других протеина унутрашње и спољашње мембране чине комплетни секреторни апарат, од којих су многи и даље непознате функције. Грам-негативни пили типа IV користе модификовану верзију система типа II за своју биогенезу. У неким случајевима, одређени протеини се деле између слоја пилуса и система типа II, унутар једне бактеријске врсте.
Систем лучења типа III (T3SS или TTSS)
[уреди | уреди извор]Систем лучења типа III хомолог је базалном телу у бактеријским бичевима (флагелама). Налик је молекуларном шприцу, кроз који бактерија (неке врсте, нпр. Salmonella, Shigella, Yersinia, Vibrio) може убризгати протеине у еукариотске ћелије. Ниска концентрација Ca2+ у цитосолу, доводи до отварања канала који регулише T3SS. Један такав механизам, илустрован је LcrV (енгл. Low Calcium Response) антигеном (употребњеним од Yersinia pestis), који детектује ниску концентрацију калцијума и изазива T3SS везаност. Сличним механизмом, Hrp систем биљних патогена убризгава харпине и патогене ефекторске протеине у биљке. Овај систем лучења први пут је откривен код Yesinia pesis и показао је да се токсини могу убризгати директно из бактеријске цитоплазме у цитоплазму ћелија домаћина, а не да се једноставно излучују у ванћелијски медијум.[8]
Систем лучења типа IV (T4SS или TFSS)
[уреди | уреди извор]Систем лучења типа IV xомолог је апарату за конјугацију бактерија. Овај систем је способан да транспортује и ДНК и протеине. Откривен је код Agrobacterium tumefaciens, којa користи овај систем за увођење Т-ДНK дела Ti плазмида, у биљнoг домаћина, што узрокује развиће погођеног подручја у жучну круну (тумор). Helicobacter pylori користи систем лучења типа IV за испоруку CagA у ћелије епитела желуца, који је повезан са карциногенезом желуца.[9] Bordetella pertussis, узрочник магарећег кашља, лучи пертузијски токсин делом кроз систем типа IV. Legionella pneumophila, узрочник легионелозе (Легионарска болест) користи систем лучења типа IVB, познат као icm/dot систем (intracellular multiplication / defect in organelle trafficking genes), за транслоцирање бројних ефекторских протеина у свог еукариотског домаћина.[10] Прототип система за лучење типа IVA је VirB комплекс Agrobacterium tumefaciens.[11]
Чланови протеина ове породице су компоненте система лучења типа IV. Они посредују у унутарћелијском преносу макромолекула, преко механизма који је претходно повезан са механизмом конјугације бактерија.[12] [13]
Функција
[уреди | уреди извор]Укратко, систем лучења типа IV (Т4SS) је општи механизам којим бактеријске ћелије излучују или преузимају макромолекуле. Њихов прецизан механизам за сада је непознат. Т4SS је кодиран на грам-негативним конјугацијским елементима у бактеријама. Т4SS је комплекс кроз ћелијску мембрану или, другим речима, 11–13 језгра протеина који формирају канал кроз који ДНК и протеини могу да путују од цитоплазме донаторске ћелије до цитоплазме ћелије примаоца. Поред тога, Т4SS лучи протеине - факторе вируленције директно у ћелије домаћина, али и преузима ДНК из медијума природном трансформацијом, што показује свестраност овог макромолекуларног апарата.[14]
Интеракције
[уреди | уреди извор]Т4SS има два ефекторска протеина: прво, АТS-1, што је означава аналазма транслоцирани супстрат 1, и друго АnkА, што означава протеин који садржи анкирин поновљени домен са протеином А. Поред тога, протеини који спајају Т4SS су VirD4 везан за VirE2.[15]
Систем лучења типа V (Т5SS)
[уреди | уреди извор]Ситем лучења типа V такође зовемо и систем аутотранспортера.[16] Овај систем лучења укључује коришћење Sec система за прoлазак кроз унутрашњу мембрану. Протеини који се луче на овај начин, имају могућност да формирају бета барел са својим C-терминусом, који се убацује у спољашњу мембрану омогућавајући остатку пептида (путнички домен) да доспе ван ћелије. Често се аутотранспортери цепају, остављајући бета барел домен у спољашњој мембрани, уз ослобађање путничког домена. Неки истраживачи верују да су управо ови остаци аутотранспортера створили порине. који формирају сличне бета барел структуре. Уобичајени пример аутотранспортера, који користи овај систем лучења, јесте тримерски аутотранспортер адхезив (ТАА).[17]
Систем лучења типа VI (Т6SS)
[уреди | уреди извор]Систем лучења типа VI је идентификован 2006. године од стране Џона Мекаланоса са сарадницима (Медицинска школа Харвард, Бостон, САД), код два бактеријска патогена, Vibrio cholerae и Pseudomonas aeruginosa.[18] [19] Они су идентификовани када су мутације гена Hcp и VrgG, код Vibrio cholerae, довеле до смањења вируленције и патогености. Касније, систем лучења типа VI пронађен је у четвртини свих протеобактеријских генома, укључујући животињске, биљне и људске патогене, као и земљишне, еколошке и морске бактерије.[20] [21] Док се већина раних истраживања секреције лучења типа VI фокусирала на његову улогу у патогенези виших организама, новије студије сугерисале су његову физиолошку улогу у одбрани од једноставних еукариотских предатора и улогу у бактеријским интеракцијама.[22] [23] Генски кластери система типа VI садрже од 15 до више од 20 гена, од којих су се два, Hcp и VgrG, показала као готово универзални секреторни супстрати система. Структура ових, и других протеина у овом систему, има упечатљиву сличност са врхом флагеле Т4 фага, а сматра се да активност система функционално подсећа на фаго инфекцију.[24]
Ослобађање везикула од спољашње мембране
[уреди | уреди извор]Поред употребе претходно наведених мултипротеинских комплекса, грам-негативне бактерије поседују и другу методу за ослобађање материјала - формирање бактеријских везикула од спољашње мембране.[25] Делови спољашње мембране се одвајају, формирајући сферне структуре нанометарских размера изграђене од липидног двослоја, богатог липополисахаридом који обухвата периплазматски материјал. Овакве структуре служе за мембрански везикуларни транспорт, ради манипулације околином или инвазије на домаћин-патоген везу. Откривено је да везикуле многих бактеријских врста садрже факторе вируленције, неке имају имуномодулаторне ефекте, док друге могу директно да пријањају и заразе ћелије домаћина. Отпуштање везикула показало се као општи одговор на стресне услове, а чини се да је поступак "паковања" протеина селективан.[26]
Код грам-позитивних бактерија
[уреди | уреди извор]Код неких врста родова Staphylococcus и Streptococcus, помоћни систем лучења управља извозом многобројних адхезивних гликопротеина.
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Lee, Jin-Sook; Jeremic, Aleksandar; Shin, Leah; Cho, Won Jin; Chen, Xuequn; Jena, Bhanu P. (јул 2012). „Neuronal porosome proteome: Molecular dynamics and architecture”. Journal of Proteomics. 75 (13): 3952—62. PMC 4580231
 . PMID 22659300. doi:10.1016/j.jprot.2012.05.017.
. PMID 22659300. doi:10.1016/j.jprot.2012.05.017.
- ^ Anderson, L. L. (2006). „Discovery of the 'porosome'; the universal secretory machinery in cells”. Journal of Cellular and Molecular Medicine. 10 (1): 126—31. PMC 3933105
 . PMID 16563225. doi:10.1111/j.1582-4934.2006.tb00294.x.
. PMID 16563225. doi:10.1111/j.1582-4934.2006.tb00294.x.
- ^ Nickel, Walter; Seedorf, Matthias (2008). „Unconventional mechanisms of protein transport to the cell surface of eukaryotic cells”. Annual Review of Cell and Developmental Biology. 24: 287—308. PMID 18590485. doi:10.1146/annurev.cellbio.24.110707.175320.
- ^ McNeil, Paul L.; Steinhardt, Richard A. (2003). „Plasma membrane disruption: repair, prevention, adaptation”. Annual Review of Cell and Developmental Biology. 19: 697—731. PMID 14570587. doi:10.1146/annurev.cellbio.19.111301.140101.
- ^ Chirico, William J. (октобар 2011). „Protein release through nonlethal oncotic pores as an alternative nonclassical secretory pathway”. BMC Cell Biology. 12: 46. PMC 3217904
 . PMID 22008609. doi:10.1186/1471-2121-12-46
. PMID 22008609. doi:10.1186/1471-2121-12-46  .
.
- ^ Wooldridge, K, ур. (2009). Bacterial Secreted Proteins: Secretory Mechanisms and Role in Pathogenesis. Caister Academic Press. ISBN 978-1-904455-42-4.
- ^ Boyd, Chelsea D.; Smith, T. Jarrod; El-Kirat-Chatel, Sofiane; Newell, Peter D.; Dufrêne, Yves F.; O'Toole, George A. (август 2014). „Structural features of the Pseudomonas fluorescens biofilm adhesin LapA required for LapG-dependent cleavage, biofilm formation, and cell surface localization”. Journal of Bacteriology. 196 (15): 2775—88. PMC 4135675
 . PMID 24837291. doi:10.1128/JB.01629-14.
. PMID 24837291. doi:10.1128/JB.01629-14.
- ^ Salyers, A. A. & Whitt, D. D. (2002). Bacterial Pathogenesis: A Molecular Approach (2nd изд.). Washington, D.C.: ASM Press. ISBN 1-55581-171-X.
- ^ Hatakeyama, Masanori; Higashi, Hideaki (децембар 2005). „Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis”. Cancer Science. 96 (12): 835—43. PMID 16367902. S2CID 5721063. doi:10.1111/j.1349-7006.2005.00130.x.
- ^ Cascales, Eric; Christie, Peter J. (новембар 2003). „The versatile bacterial type IV secretion systems”. Nature Reviews. Microbiology. 1 (2): 137—49. PMC 3873781
 . PMID 15035043. doi:10.1038/nrmicro753.
. PMID 15035043. doi:10.1038/nrmicro753.
- ^ Christie, Peter J.; Atmakuri, Krishnamohan; Krishnamoorthy, Vidhya; Jakubowski, Simon; Cascales, Eric (2005). „Biogenesis, architecture, and function of bacterial type IV secretion systems”. Annual Review of Microbiology. 59: 451—85. PMC 3872966
 . PMID 16153176. doi:10.1146/annurev.micro.58.030603.123630.
. PMID 16153176. doi:10.1146/annurev.micro.58.030603.123630.
- ^ Christie, Peter J. (новембар 2004). „Type IV secretion: the Agrobacterium VirB/D4 and related conjugation systems”. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1694 (1–3): 219—34. PMC 4845649
 . PMID 15546668. doi:10.1016/j.bbamcr.2004.02.013.
. PMID 15546668. doi:10.1016/j.bbamcr.2004.02.013.
- ^ Yeo, Hye-Jeong; Yuan, Qing; Beck, Moriah R.; Baron, Christian; Waksman, Gabriel (децембар 2003). „Structural and functional characterization of the VirB5 protein from the type IV secretion system encoded by the conjugative plasmid pKM101”. Proceedings of the National Academy of Sciences of the United States of America. 100 (26): 15947—52. Bibcode:2003PNAS..10015947Y. JSTOR 3149111. PMC 307673
 . PMID 14673074. doi:10.1073/pnas.2535211100
. PMID 14673074. doi:10.1073/pnas.2535211100  .
.
- ^ Lawley, T.D; Klimke, W.A; Gubbins, M.J; Frost, L.S (јул 2003). „F factor conjugation is a true type IV secretion system”. FEMS Microbiology Letters. 224 (1): 1—15. PMID 12855161. S2CID 3398753. doi:10.1016/S0378-1097(03)00430-0.
- ^ Rikihisa, Y.; Lin, M.; Niu, H. (септембар 2010). „Type IV secretion in the obligatory intracellular bacterium Anaplasma phagocytophilum”. Cellular Microbiology. 12 (9): 1213—21. PMC 3598623
 . PMID 20670295. doi:10.1111/j.1462-5822.2010.01500.x.
. PMID 20670295. doi:10.1111/j.1462-5822.2010.01500.x.
- ^ Thanassi, David G.; Stathopoulos, Christos; Karkal, Aarthi; Li, Huilin (2005). „Protein secretion in the absence of ATP: the autotransporter, two-partner secretion and chaperone/usher pathways of gram-negative bacteria (review)”. Molecular Membrane Biology. 22 (1–2): 63—72. PMID 16092525. S2CID 2708575. doi:10.1080/09687860500063290.
- ^ Gerlach, R.; Hensel, M. (октобар 2007). „Protein secretion systems and adhesins: the molecular armory of Gram-negative pathogens”. International Journal of Medical Microbiology. 297 (6): 401—15. PMID 17482513. doi:10.1016/j.ijmm.2007.03.017.
- ^ Pukatzki, Stefan; Ma, Amy T.; Sturtevant, Derek; Krastins, Bryan; Sarracino, David; Nelson, William C.; Heidelberg, John F.; Mekalanos, John J. (јануар 2006). „Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system”. Proceedings of the National Academy of Sciences of the United States of America. 103 (5): 1528—33. Bibcode:2006PNAS..103.1528P. JSTOR 30048406. PMC 1345711
 . PMID 16432199. doi:10.1073/pnas.0510322103
. PMID 16432199. doi:10.1073/pnas.0510322103  .
.
- ^ Mougous, Joseph D.; Cuff, Marianne E.; Raunser, Stefan; Shen, Aimee; Zhou, Min; Gifford, Casey A.; Goodman, Andrew L.; Joachimiak, Grazyna; OrdoñEz, Claudia L.; Lory, Stephen; Walz, Thomas; Joachimiak, Andrzej; Mekalanos, John J. (јун 2006). „A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus”. Science. 312 (5779): 1526—30. Bibcode:2006Sci...312.1526M. PMC 2800167
 . PMID 16763151. doi:10.1126/science.1128393.
. PMID 16763151. doi:10.1126/science.1128393.
- ^ Bingle, Lewis EH; Bailey, Christopher M.; Pallen, Mark J. (фебруар 2008). „Type VI secretion: a beginner's guide” (PDF). Current Opinion in Microbiology. 11 (1): 3—8. PMID 18289922. doi:10.1016/j.mib.2008.01.006.
- ^ Cascales, Eric (август 2008). „The type VI secretion toolkit”. EMBO Reports. 9 (8): 735—41. PMC 2515208
 . PMID 18617888. doi:10.1038/embor.2008.131.
. PMID 18617888. doi:10.1038/embor.2008.131.
- ^ Schwarz, Sandra; Hood, Rachel D.; Mougous, Joseph D. (децембар 2010). „What is type VI secretion doing in all those bugs?”. Trends in Microbiology. 18 (12): 531—7. PMC 2991376
 . PMID 20961764. doi:10.1016/j.tim.2010.09.001.
. PMID 20961764. doi:10.1016/j.tim.2010.09.001.
- ^ Coulthurst, Sarah J. (2013). „The Type VI secretion system - a widespread and versatile cell targeting system”. Research in Microbiology. 164 (6): 640—54. PMID 23542428. doi:10.1016/j.resmic.2013.03.017.
- ^ Silverman, Julie M.; Brunet, Yannick R.; Cascales, Eric; Mougous, Joseph D. (2012). „Structure and regulation of the type VI secretion system”. Annual Review of Microbiology. 66: 453—72. PMC 3595004
 . PMID 22746332. doi:10.1146/annurev-micro-121809-151619.
. PMID 22746332. doi:10.1146/annurev-micro-121809-151619.
- ^ Kuehn, Meta J.; Kesty, Nicole C. (новембар 2005). „Bacterial outer membrane vesicles and the host-pathogen interaction”. Genes & Development. 19 (22): 2645—55. PMID 16291643. doi:10.1101/gad.1299905.
- ^ McBroom, Amanda J.; Kuehn, Meta J. (јануар 2007). „Release of outer membrane vesicles by Gram-negative bacteria is a novel envelope stress response”. Molecular Microbiology. 63 (2): 545—58. PMC 1868505
 . PMID 17163978. doi:10.1111/j.1365-2958.2006.05522.x.
. PMID 17163978. doi:10.1111/j.1365-2958.2006.05522.x.
Литература
[уреди | уреди извор]- Alberts B, Johnson A, Lewix J, Raff M, Roberts K, Walter P, eds. (2002). "Search: Secretion". Molecular Biology of the Cell (4th ed.) New York: Garland Science. ISBN 978-0-8153-3218-3.
- Whide D. (2000). The physiology and biochemistry of prokaryotes (2nd изд.). Oxford University Press. ISBN 978-0-19-512579-5.
- Avon D. "Home page". Cells alive!.
Спољашње везе
[уреди | уреди извор]- Secretions at the US National Library of Medicine Medical Subject Headings (MeSH)
- Илустрација Т5SS / аутотранспортера на Uni Münster

