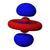
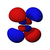
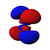
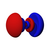
Атомска орбитала


Атомска орбитала представља део простора у атому где је највећа вероватноћа налажења електрона.[1] Притом, електрон се замишља као облак негативног наелектрисања различите густине и на основу тога се може констатовати његово присуство. Величина овог простора зависи од самог електрона али се он најчешће задржава у близини атомског језгра.[2]
Постоје s, p, d и f-орбитала. Сваки s- подниво садржи једну s-орбиталу, сваки p-подниво садржи три p- орбитале, d-подниво садржи пет d- орбитала, а сваки f-подниво садржи седам f-орбитала. У свакој орбитали стаје по два електрона, тако да на основу атомског броја лако можемо одредити распоред електрона по орбиталама. На пример: Mg-магнезијум-редни број му је 12, што је једнако броју протона као и електрона (сваки атом је електронеутралан у основном стању). Дакле уређеност његових орбитала изгледа: [3][4]
Својства електрона
[уреди | уреди извор]Са развојем квантне механике и експерименталних налаза (као што је двопрорезна дифракција електрона), утврђено је да се у орбити електрони око језгра не могу у потпуности описати као честице, али је потребно објаснити двојност таласне честице. У том смислу, електрони имају следеће особине.
Таласна својства:
- Електрони не круже око језгра као планета око Сунца, већ постоје као стојећи таласи. Најмања могућа енергија електрона може се стога узети као аналог фундаменталној фреквенцији таласа на жици. Виша стања енергије су онда слична хармоницима фундаменталне фреквенције.
- Електрони никада нису у једној тачки локације, иако се вероватноћа интеракције с електроном у једном тренутку може проценити из таласне функције електрона.
Својства која личе на честице:
- Око језгра увек кружи цели број електрона.
- Електронски скок између орбитала се одвија у честицама сличном облику. На пример, ако је један фотон удари у електрон, јавља се само једна електронска промена, у одговору на фотон.
- Електрони задржавају својства слична честицама, као што су: свака ступањ таласа има исти електрични набој као електронска честица. Сваки од њих има један дискретан спин (горе или доље).
Стога, без обзира на очигледну аналогију са окретањем планета око Сунца, електрони се не могу описати само као чврсте честице. Поред тога, атомске орбитале у обичним атома не личе на елипсоидне путање планета. Тачнија аналогија може бити да се велика и често чудно обликована „атмосфера” (електрона), дистрибуира око релативно мале планете (атомског језгра). Атомске орбитале тачно описују облик ове „атмосфере” само када је присутан електрон једног атома. Када се више електрона придода на један атом, додатни електрони имају тенденцију да равномерније попуне простор око језгра, а резултат је њихово прикупљање (понекад називано „електронски облак” ); оно тежи ка генерално сферној зони вероватноће, описујући где ће се наћи електрон атома.
Формална квантно-механичка дефиниција
[уреди | уреди извор]Атомске орбитале се могу прецизније дефинисати у формалном језику квантне механике. Наиме, у квантној механици, стање атома је апроксимирана експанзија линеарне комбинације анти-симетризованог производа (Слејтерова детерминанта) једне електронске функције. Просторне компоненте ових једноелектронских функција називају се атомске орбитале. (Када се узме у обзир и њихов спин компонента, реч је о орбитали атомског спина). А стање је заправо функција координата свих електрона, тако да је њихово кретање у корелацији, али то је често апроксимирано моделом независне честица производа таласа појединачних функција електрона.[5] (Лондонова дисперзиона сила, на пример, зависи од корелације кретања електрона.)
У атомској физиици, атомска спектрална линија одговара транзицији (квантних скокова) између квантних стања атома. Ова стање су означена скупом квантних бројева сажетих у симболски појам и обично се повезује са посебним електронским конфигурацијама, односно, по шеми атомских орбитала (на пример, 1s22s22p6 за стање основе неона симбол-ознака: 1S0).
Ова нотација значи да је одговарајућа Слејтерова детерминанта има јасну већу тежину у проширеној интеракцији конфигурације. Концепте атомске орбитале је стога кључни концепт за визуализацију процеса побуђивања, повезаног са датом транзицијом. На пример, то се може рећи за транзицију с обзиром да одговара на побуде електрона из окупиране орбитале у датој празној орбитали. Ипак, треба имати на уму да су електрони фермиони који се понашају по принципу Паулијевог искључења и не могу се разликовати од осталих електрона у атому. Осим тога, понекад се догоди да је интеракција ширење конфигурације конвергира врло споро и да се не може говорити о једноставној функцији једноталасне детерминанте на све. То је случај када је велика корелација електрона. У основи, атомска орбитала је функција једноелектронског таласа, иако је већина електрона не постоје у једном атомском електрону, те је такав талас апроксимација.
Врсте орбитала
[уреди | уреди извор]
(f и више орбитале нису приказане)
Атомске орбитале могу бити као водоникова орбитала и које су тачна решења за Шредингерову једначину за атоме сличне водонику (тј. атома с једним електроном). Алтернативно, атомске орбитала се односе на функције које зависе од координата једног електрона (тј. орбитале), али се користе као полазне основе за приближавање таласне функције која зависи од истовремених координата свих електрона у атому или молекулу. Координатни системи за атомске орбитале су обично сферне координате (r, θ, φ) у атомима и картезијске (x, y, z) у полиатомским молекулима. Предност сферних координата (за атоме) је да је функција орбитног таласа производ три фактора, од којих сваки зависи од једне координате:
- ψ (r, θ, φ) = R (r) Θ (θ) Φ (φ).
Угаони фактори атомских орбитала Θ (θ) Φ (φ) генеришу e, p, d, итд функције као праве комбинације сферних хармоника Yℓm (θ, φ) (где су ℓ и m квантни бројеви).
Постоје три математичка обрасца за радијалне функције R (r) који се могу бирати као полазиште за израчунавање својстава атома и молекула с много електрона:
- Атомске орбитале сличне водонику су изведене из тачног решења Шредингерове једначине за један електрон и језгро, за атоме попут водоника. Део функције која зависи од удаљености од језгра има радијалне чворове и опада као e–константа × удаљеност.
- Орбитале Слејтеровог типа (STO) је форма без радијалних чворова, али опада из језгра као што то чини водонику слична орбитала.
- Орбитале Гаусовог типа (Гаусових расподела) немају радијалне чворове и опада као e –удаљеност на квадрат.
Иако се водониколике орбитале и даље користе као педагошки алат, појавом компјутера, STO се показао као бољи метод за атоме и молекуле диатомских комбинација. STO може заменити и чворове у водониколиким атомским орбиталнама. Гаусова расподела се обично користи у молекулама с три или више атома. Иако није толико прецизна као STO, комбинација многих Гаусових расподела може постићи прецизност водоничних орбитала као код водоника.
Облици орбитала
[уреди | уреди извор]Табела орбитала
[уреди | уреди извор]Табела испод приказује орбиталне конфигурације за стварне водониколоке таласне функције 7, и стога покрива једноставне електронске конфигурације за све елементе у периодном систему до радијума. ψ графикони су приказани са – и + таласна функција, а фазе су приказане у две различите боје (произвољно црвена и плава). PZ орбитала је иста као и P0 орбитала, али се Px и PY формирају узимањем линеарне комбинације P + 1 и P - 1 орбитале (што је разлог зашто су наведене под M = ± 1 етикетом). Такође, P + 1 и P - 1 нису исти облик као и pz орбитала је иста као p0 орбитала, али px у py су формиране узевши линеарне комбинације p+1 и p−1 орбитале (која је зато приказана испод m = ±1 обележавања). Такође, p+1 и p−1 нису истог облика као p0, будући да су чист сферни хармоник.
Квалитативно разумевање облика
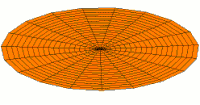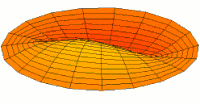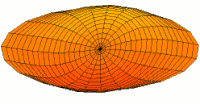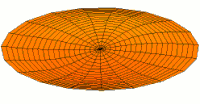
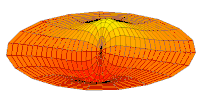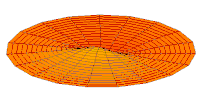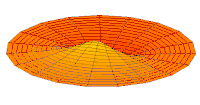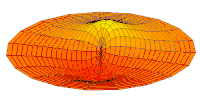
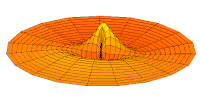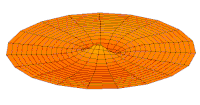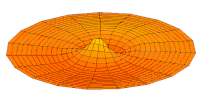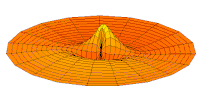
[уреди | уреди извор]Облици атомских орбитала се могу квалитативно разумети разматрањем аналогног случаја стојећих таласа на кружном бубњу.[6] Да би се видела аналогија, средње вибрационо померање сваког бита мембране бубња од тачке равнотеже током многих циклуса (мера просечне брзине и импулса мембране бубња у тој тачки) мора се узети у обзир у односу на удаљеност те тачке од центра главе бубња. Ако се ово померање схвати као аналогно вероватноћи проналаска електрона на датој удаљености од језгра, тада ће се видети да многи модови вибрирајућег диска формирају обрасце који прате различите облике атомских орбитала. Основни разлог ових разматрања лежи у чињеници да расподела кинетичке енергије и импулса у материји-таласу предвиђа где ће бити честица повезана са таласом. Односно, вероватноћа проналаска електрона на датом месту је такође функција просечног импулса електрона у тој тачки, будући да висок импулс електрона у датом положају тежи да „локализује“ електрон у том положају, путем својстава електрона таласни пакети (за детаље механизма видети Хајзенбергов принцип неодређености).
Овај однос значи да се одређене кључне карактеристике могу уочити како у мембранским модовима бубња, тако и у атомским орбиталама. На пример, у свим модовима аналогним s орбиталама (горњи ред на анимираној илустрацији доле), може се видети да сам центар мембране бубња најснажније вибрира, што одговара античвору у свим s орбиталама у атому. Овај античвор значи да је електрон највероватније у физичком положају језгра (кроз које пролази право без расипања или удара), јер се у тој тачки (у просеку) креће најбрже, дајући му максималан замах.
Ментална слика „планетарне орбите“ је најближа понашању електрона у s орбитала, све од којих немају угаони моменат, можда би могла бити слика Кеплеровске орбите са орбиталном ексцентричношћу од 1, али коначном главном осом, што није физички могуће (јер би се честице судариле), али се може замислити као граница орбита са једнаким главним осама, али растуће ексцентричности.
Испод су приказани бројни начини вибрације мембране бубња и одговарајуће таласне функције атома водоника. Може се размотрити кореспонденција за таласне функције главе вибрационог бубња за двокоординатни систем ψ(r, θ), и за таласне функције вибрирајуће сфере за три координате ψ(r, θ, φ).
- s-type drum modes and wave functions
-
Мод бубња
-
Мод бубња
-
Мод бубња
-
Таласна функција 1s орбитале (реалнни део, 2Д-пресек, )
-
Таласна функција 2s орбитале (реалнни део, 2Д-пресек, )
-
Таласна функција 3s орбитале (реалнни део, 2Д-пресек, )
Ниједан од осталих скупова модова у мембрани бубња нема централни античвор, и у свима њима се центар бубња не помера. Они одговарају чвору у језгру за све не-s орбитале у атому. Све ове орбитале имају одређени угаони моменат и у планетарном моделу одговарају честицама у орбити са ексцентричношћу мањом од 1,0, тако да не пролазе директно кроз центар примарног тела, већ се држе подаље од њега.
Поред тога, модови бубња аналогни модовима p и d у атому показују просторне неправилности дуж различитих радијалних праваца од центра бубња, док су сви модови аналогни s модовима савршено симетрични у радијалном правцу. Својства нерадијалне симетрије не-s орбитала неопходна су за локализацију честице са угаоним момемтом и таласном природом у орбитали, где она мора да се држи подаље од централне привлачне силе, јер свака честица локализована у тачци централне привлачности не би могла да има угаони моменат. У овим модовима, таласи у глави бубња теже да избегну централну тачку. Такве особине поново наглашавају да су облици атомских орбитала директна последица таласне природе електрона.
- p-type drum modes and wave functions
-
Мод бубња
-
Мод бубња
-
Мод бубња
-
Таласна функција 2p орбитале (реалнни део, 2Д-пресек, )
-
Таласна функција 3p орбитале (реалнни део, 2Д-пресек, )
-
Таласна функција 4p орбитале (реалнни део, 2Д-пресек, )
- d-type drum modes
-
Мод (3d орбитала)
-
Мод (4d орбитала)
-
Мод (5d орбитала)
Референце
[уреди | уреди извор]- ^ Orchin, Milton; Macomber, Roger S.; Pinhas, Allan & R. Marshall Wilson (2005). Atomic Orbital Theory (PDF).
- ^ Daintith, J. (2004). Oxford Dictionary of Chemistry. New York: Oxford University Press. ISBN 978-0-19-860918-6.
- ^ Griffiths 1995, стр. 190–191
- ^ Levine 2000, стр. 144–145
- ^ Roger Penrose, The Road to Reality
- ^ Cazenave, T.; Lions, P. (1982). „Orbital stability of standing waves for some nonlinear Schrödinger equations”. Communications in Mathematical Physics. 85 (4): 549—561. Bibcode:1982CMaPh..85..549C. S2CID 120472894. doi:10.1007/BF01403504.
Литература
[уреди | уреди извор]- Paul, Tipler; Llewellyn, Ralph (2003). Modern Physics (4 изд.). New York: W. H. Freeman and Company. ISBN 978-0-7167-4345-3.
- Eric, Scerri (2007). The Periodic Table, Its Story and Its Significance. New York: Oxford University Press. ISBN 978-0-19-530573-9.
- Ira, Levine (2000). Quantum Chemistry. Upper Saddle River, New Jersey: Prentice Hall. ISBN 978-0-13-685512-5.
- David, Griffiths (2000). Introduction to Quantum Mechanics (2 изд.). Benjamin Cummings. ISBN 978-0131118928.
- Irwin, Cohen; Bustard, Thomas (1966). „Atomic Orbitals: Limitations and Variations”. J. Chem. Educ. 43 (4): 187. Bibcode:1966JChEd..43..187C. doi:10.1021/ed043p187.
- Orchin, Milton; Macomber, Roger S.; Pinhas, Allan & R. Marshall Wilson (2005). Atomic Orbital Theory (PDF).
Спољашње везе
[уреди | уреди извор]- Атомске орбитале
- Ковалентне везе и молекулске структуре Архивирано на сајту Wayback Machine (10. фебруар 2009)
- Анимација водоничне орбитале
- The Orbitron, a visualization of all common and uncommon atomic orbitals, from 1s to 7g
- Grand table Still images of many orbitals
- Hydrogen atom orbitals in c++ and visualization in python