Vodikov bromid
| |||
| |||
| Imena | |||
|---|---|---|---|
| Priporočeno IUPAC ime
Hydrogen bromide[navedi vir] | |||
| Sistematično ime
Bromane[1] | |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| 3587158 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.030.090 | ||
| EC število |
| ||
| KEGG | |||
| MeSH | Hydrobromic+Acid | ||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
| UN število | 1048 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Struktura | |||
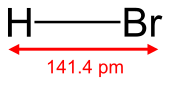
| Oblika molekule | Linearna | ||
| Dipolni moment | 820 mD | ||
| Termokemija | |||
| Specifična toplota, C | 350,7 mJ/(K·g) | ||
| Standardna molarna entropija S |
198.696–198.704 J/(K·mol)[2] | ||
Std tvorbena
entalpija (ΔfH⦵298) |
−36,45...−36,13 kJ/mol[2] | ||
| Nevarnosti | |||
| Varnostni list | hazard.com | ||
| GHS piktogrami |  
| ||
| Opozorilna beseda | Pozor | ||
| H314, H335 | |||
| P261, P280, P305+351+338, P310 | |||
| NFPA 704 (diamant ognja) | |||
| Smrtni odmerek ali koncentracija (LD, LC): | |||
LC50 (srednja koncentracija)
|
2858 ppm (podgana, 1 h) 814 ppm (miš, 1 h)[4] | ||
| NIOSH (ZDA varnostne meje): | |||
PEL (Dopustno)
|
TWA 3 ppm (10 mg/m3)[3] | ||
REL (Priporočeno)
|
TWA 3 ppm (10 mg/m3)[3] | ||
IDLH (Takojšnja nevarnost)
|
30 ppm[3] | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Vodikov bromid (tudi Bromvodik; HBr) je zelo jedka snov, ki je lahko v plinastem ali tekočem stanju. Spojine broma se uporabljajo v kemijski, fotografski in farmacevtski industriji. Vodikov bromid je brezbarven plin. Na vlažnem zraku se kadi. Vodna raztopina je podobna klorovodikovi kislini, soli so bromidi. Vodikov bromid ne gori. Pri segrevanju zaradi požara v okolici hladimo posode z razpršenim vodnim curkom. Vodikov bromid je diatomična molekula HBr. HBr je plin v standardnih pogojih. HBr kislina nastaja ob raztapljanju HBr v vodi. Obratno HBr lahko osvobodimo iz HBr hidrobromičnih kislinskih raztopin z dodatkom dehidracijskega sredstva, ampak ne z destilacijo. Vodikov bromid in hidrobromična kislina tako nista enaka ampak sta povezana. Kemiki pogosto naslavljajo hidrobromično kislino kot “HBr” v tej uporabi, medtem, ko je to razumljivo večini kemikov, to ni točno in lahko privede do zmešnjave pri ne specializiranih osebah. Na sobni temperaturi je HBr nevnetljiv plin z ostrim vonjem, v vlažnem zraku je kadeč zaradi nastajanja hidrobromične kisline. HBr je dobro vodotopen, nastaja hidrobromična kislinska raztopina katera je po težini 60,85% nasičena z HBr na sobni temperaturi. Vodne raztopine so po težini 47,6% HBr in nastaja mešanica obratni azeotrop v stanju stalnega vretja, ki vre na temperaturi 124,3 stopin celzij. Vrenje manj koncetriranih raztopin spušča H2O, dokler ni dosežena mešanica komponent, katera stalno vre.
Identifikacija snovi ali pripravka:
[uredi | uredi kodo] Identifikacija snovi ali pripravka:
Ime: Vodikov bromid,
Številka varnostnega lista: AL068,
Kemijska formula: HBr
Uporaba snovi ali pripravka: Obstaja mnogo aplikacij HBr v kemičnih sintezah npr. , HBr se uporablja pri proizvodnji alkinih bromidov iz alkohola. ROH + HBr → RBr + H2O HBr doda alkinim tako nastanejo bromo alkalni, pomemben člen oranobromidnih komponent.: RCH=CH2 + HBr → RCH(Br)–CH3 HBr doda alkinim, tako nastanejbo bromo alkalni. Stereotipična kemija tega tipa z dodatkom anti. RC≡CH + HBr → RC(Br)=CH2 HBr doda haloalkalne , da nastane geminal elihaloalkalne . ( tak tip dodatka sledi markovnikovem pravilu). RC(Br)=CH2 + HBr → RC(Br2)–CH3 HBr uporabljajo za odprtje epoksidov ter laktonov in v sintezi bromoacetalov. Dodatno HBr katelizira številne organske reakcije. HBr je bil predlagan za baterijo pretočnega tipa v splošni uporabi.
Sestava s podatki o nevarnih sestavinah:
[uredi | uredi kodo]Ugotovitve o nevarnih lastnostih:
[uredi | uredi kodo]Vodikov bromid lahko gori, čeprav se težko vname. Kontejner pri segrevanju lahko eksplodira. oškodovane jeklenke lahko učikujejo kot projektili. Napotki za nevarnost: Tekoči plin. Strupeno pri vdihavanju. Je zelo jedka za dihala, kožo in oči.
Ukrepi za prvo pomoč:
[uredi | uredi kodo]Vdihovanje: Vodikov bromid pri vdihavanju je strupen. Poškodovancu nudimo pomoč tako da mu damo dihalni aparat in stem omogočimo vdihavanje čistega zraka. Ponesrečenca obdržimo umirjenega in na toplem. Takoj pokličemo zdravniško pomoč. Če pride do zastoja dihanja, mu takoj nudimo pravilno umetno dihanje.
Zaužitje: Ni obravnavano kot možni način izpostavljenosti.
Stik s kožo in očmi: V stiku s kožo povzroči hude opekline in roženice. Ustrezni ukrepi za prvo pomoč bi morali bili takoj na voljo. Pred uporabo snovi prositi za nasvet zdravnika ob morebitnih poškodbah in o zdravniški pomoči. Ob stiku s kožo in očmi poklicati zdravniško pomoč. Odstraniti onesnažena oblačila. Dele telesa ki so prišli v stik s snovjo izpirati najmanj 15 minut pod vodo. Oči najmanj 15 minut izpirati pod vodo če je snov prišla v stik z očmi.
Ukrepi ob požaru:
[uredi | uredi kodo]Posebne nevarnosti
Primerna sredstva za gašenje Vodikov bromid ne gori. Pri segrevanju zaradi požara v okolici hladimo posode z razpršenim vodnim curkom. Vsa sredstva za gašenje, ki jih poznamo so primerna. Če pride do uhajanja plina je potrebno takoj uhajanje preprečiti.
Industrijska priprava
[uredi | uredi kodo]Vodikov bromid ( s hidrobromično kislino) se proizvaja v znatno manjšem obsegu kot njegovi kloridi. V primarni industrijski pripravi vodik in bromin kombiniraju pri temperaturi 200 – 400 stopinj celzija. Reakcija je ponovadi katalizirana s platino ali azbestozo.
Laboratorijsko spajanje ali sinteza
[uredi | uredi kodo]HBr lahko spajamo oziroma sinteziramo z različnimi metodami oziroma postopki. Pripravimo ga lahko v laboratoriju z destilacijo natrijeve raztopine ali kalijevega bromida s fosforno kislino ali razrečeno žveplovo kislino. 2 KBr + H2SO4 → K2SO4 + 2HBr Koncetrirana žveplova kislina ni učinkovita ker bo nastali HBr oksidirana v bromov plin. 2 HBr + H2SO4 → Br2 + SO2 + 2H2O Kislina je lahko pripravljena z več metodami, tu uključujemo reakcijo z brominom in sicer z žveplom in vodo ali fosforjem in vodo.
2 Br2 + S + 2 H2O → 4 HBr + SO2 Alternativno jo lahko pripravimo z bromizacijo tetralina (1,2,3,4 – tetrahidronaftalina). C10H12 + 4 Br2 → C10H8Br4 + 4 HBr Alternativno bromin lahko zmanjšamo s fosforno kislino. Br2 + H3PO3 + H2O → H3PO4 + 2 HBr Brezvodni vodikov bromid lahko proizvedemo v manjših količinah s termolizo trifenilfosforijevega bromida in refluksa ksilena. HBr pripravljen z zgoraj navedenimi metodami je lahko kontaminiran z Br2 katerega lahko odstranimo s spustitvijo plina .
Posebna zaščitna oprema za gasilce: Dihalni aparat in posebna zaščitna obleka.
Ukrepi ob nezgodnih izpustih
[uredi | uredi kodo]Previdnostni ukrepi, ki se nanašajo na ljudi: Poskrbeti za ustrezni dihalni aparat in zaščitno obleko. Poskrbeti za zadostno prezračevanje prostora.
Ekološki zaščitni ukrepi Če pride do iztekanja je to potrebno poskusiti preprečiti.
Ravnanje z nevarno snovjo/pripravkom in skladiščenje
[uredi | uredi kodo]Ravnanje Vodikov bromid shranjujemo v dobro prezračenem prostoru in pod 50 °C.
Skladiščenje Preprečiti vdor vode v jeklenke. Tlak in temperatura morata biti primerna. V primeru dvoma se posvetovati s strokovnjakom za nevarno snov.
Nadzor nad izpostavljenostjo/varnost in zdravje pri delu
[uredi | uredi kodo]Hlapi močno dražijo oči, dihalne poti in dihalne organe (pljučni edem). V visokih koncentracijah so možne hude poškodbe. Vodne raztopine močno poškodujejo oči in kožo. Kontakt s tekočim plinom povzroča ozebe.
Fizikalne in kemijske lastnosti
[uredi | uredi kodo]Pogoj pri 20 °C: Tekoči plin
Barva: Brezbarven
Vonj: Oster
Molska masa: 81
Tališče [°C]: -87
Vrelišče [°C]: -66,7
Kritična temperatura [°C]: 90 °C
Parni tlak, 20 °C: 21 bar
Obstojnost in reaktivnost
[uredi | uredi kodo]Reagira z večino kovin s prisotnostjo plina. Z vodo povzroči korozijo nekaterih kovin. Burno lahko reagira z bazami. Z vodo oblikuje jedke kisline.
Glej tudi
[uredi | uredi kodo]Sklici
[uredi | uredi kodo]- ↑ »Hydrobromic Acid - Compound Summary«. PubChem Compound. USA: National Center for Biotechnology Information. 16. september 2004. Identification and Related Records. Pridobljeno 10. novembra 2011.
- ↑ 2,0 2,1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ↑ 3,0 3,1 3,2 NIOSH Pocket Guide to Chemical Hazards. »#0331«. National Institute for Occupational Safety and Health (NIOSH).
- ↑ »Hydrogen bromide«. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).




