Barijev klorid
| |

| |
| Imena | |
|---|---|
| Druga imena
barijev diklorid
| |
| Identifikatorji | |
| |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.030.704 |
| EC število |
|
PubChem CID
|
|
| RTECS število |
|
| UNII |
|
| UN število | 1564 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| BaCl2 | |
| Molska masa | 208.23 g/mol (anhidrid) 244.26 g/mol (dihidrat) |
| Videz | bela trdnina |
| Gostota | 3.856 g/cm3 (anhydrous) 3.0979 g/cm3 (dihydrate) |
| Tališče | 962 °C (1.764 °F; 1.235 K) (960 °C, dihydrate) |
| Vrelišče | 1.560 °C (2.840 °F; 1.830 K) |
| 31.2 g/100 mL (0 °C) 35.8 g/100 mL (20 °C) 59.4 g/100 mL (100 °C) | |
| Topnost | topen v metanolu, netopen v etanolu in etil acetatu[1] |
| Magnetna občutljivost | -72.6·10−6 cm3/mol |
| Struktura | |
| Kristalna struktura | ortogonalna (anhidrid) monoklinska (dihidrat) |
| Koordinacijska geometrija |
7-9 |
| Termokemija | |
Std tvorbena
entalpija (ΔfH⦵298) |
−858.56 kJ/mol |
| Nevarnosti | |
| Glavne nevarnosti | strupen ob zaužitju |
| Varnostni list | NIH BaCl |
| GHS piktogrami | 
|
| Opozorilna beseda | Pozor |
| H301, H332 | |
| P261, P264, P270, P271, P301+310, P304+312, P304+340, P312, P321, P330, P405, P501 | |
| NFPA 704 (diamant ognja) | |
| Plamenišče | nevnetljiv |
| Smrtni odmerek ali koncentracija (LD, LC): | |
LD50 (srednji odmerek)
|
78 mg/kg (podgana, oralno) 50 mg/kg (morski prašiček, oralno)[3] |
LDLo (spodnja meja odmerka)
|
112 mg Ba/kg (kunec, oralno) 59 mg Ba/kg (pes, oralno) 46 mg Ba/kg (miš, oralno)[3] |
| NIOSH (ZDA varnostne meje): | |
PEL (Dopustno)
|
TWA 0.5 mg/m3[2] |
REL (Priporočeno)
|
TWA 0.5 mg/m3[2] |
IDLH (Takojšnja nevarnost)
|
50 mg/m3[2] |
| Sorodne snovi | |
| Drugi anioni | barijev fluorid barijev bromid barijev jodid |
| Drugi kationi | berilijev klorid magnesijev klorid kalcijev klorid stroncijev klorid radijev klorid svinčev klorid |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Barijev klorid je anorganska spojina s formulo BaCl2. To je ena izmed najpomembnejših vodotopnih barijevih soli. Podobno kot večina barijevih soli je bele barve, strupena in daje rumenozeleno barvo plamenu. V manjših količinah jo uporabljajo v kemiji in industriji.[4]
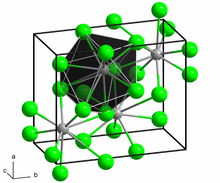
Struktura in lastnosti
[uredi | uredi kodo]BaCl2 kristalizira v dveh oblikah (je polimorfna). Ena ima kubično fluoritno strukturo, druga pa ortorombsko, podobno kot svinčev klorid. Obe obliki ustrezata preferenci velikega iona Ba2+ za koordinacijska števila nad šest.[5] V fluoritni strukturi je njegovo koordinacijsko število 8,[6] v ortorombski pa 9.[7] Ko je slednja podvržena tlakom 7–10 GPa, se pretvori v tretjo, monoklinsko obliko s koordinacijskim številom 10.[8]
BaCl2 se v vodni raztopini obnaša kot preprosta sol; v vodi je 1:2 elektrolit, raztopina ima nevtralen pH. S sulfatnim ionom reagira in tvori gosto belo oborino barijevega sulfata.
- Ba2+ + SO42− → BaSO4
Oksalat sproži podobno reakcijo:
- Ba2+ + C2O42− → BaC2O4
V zmesi z natrijevim hidroksidom da dihidroksid, ki je zmerno topen v vodi.
Sinteza
[uredi | uredi kodo]Industrijsko ga pripravljajo z dvostopenjsko reakcijo iz barita (barijevega sulfata):[9]
Prvi korak zahteva visoke temperature.
- BaS + 2 HCl → BaCl2 + H2S
Namesto HCl se lahko uporablja klor.[4]
Načeloma ga lahko dobimo tudi iz barijevega hidroksida ali barijevega karbonata. Ti bazični soli reagirata s klorovodikovo kislino, nastane hidriran barijev klorid.
Uporaba
[uredi | uredi kodo]Kljub dostopnosti in nizki ceni je uporaba omejena. Industrijsko ga uporabljajo predvsem za čiščenje jedke slanice, v manjši meri pa za proizvodnjo soli za toplotno obdelavo jekla.[4] Poleg tega barijeve spojine uporabljajo v pirotehniki za svetlobne učinke. Kombinacija barijevega nitrata in polivinilklorida ob gorenju slednjega sprošča barijev klorid, ki obarva plamen zeleno.[10]
Uporabnost omejuje dejstvo, da je močno strupen, podobno kot ostale vodotopne barijeve soli.[11] Draži oči, kožo in dihala. Lahko deluje tudi na osrednje živčevje in mišice, kar povzroči srčno aritmijo in paralizo. Izpostavljenost lahko povzroči tudi smrt.
Sklici
[uredi | uredi kodo]- ↑ Handbook of Chemistry and Physics (71. izd.). Ann Arbor, Michigan: CRC Press. 1990.
- ↑ 2,0 2,1 2,2 NIOSH Pocket Guide to Chemical Hazards. »#0045«. National Institute for Occupational Safety and Health (NIOSH).
- ↑ 3,0 3,1 »Barium (soluble compounds, as Ba)«. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ 4,0 4,1 4,2 Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jocher; Wolf, Hans Uwe (2007). »Barium and Barium Compounds«. V Ullman, Franz (ur.). Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a03_325.pub2. ISBN 978-3527306732.
- ↑ Wells, A. F. (1984). Structural Inorganic Chemistry. Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Haase, A.; Brauer, G. (1978). »Hydratstufen und Kristallstrukturen von Bariumchlorid«. Z. anorg. allg. Chem. 441: 181–195. doi:10.1002/zaac.19784410120.
- ↑ Brackett, E. B.; Brackett, T. E.; Sass, R. L. (1963). »The Crystal Structures of Barium Chloride, Barium Bromide, and Barium Iodide«. J. Phys. Chem. 67 (10): 2132. doi:10.1021/j100804a038.
- ↑ Léger, J. M.; Haines, J.; Atouf, A. (1995). »The Post-Cotunnite Phase in BaCl2, BaBr2 and BaI2 under High Pressure«. J. Appl. Cryst. 28 (4): 416. doi:10.1107/S0021889895001580.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. izd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Sabatini, Jesse J.; Poret, Jay C.; Broad, Russell N. (2011). »Boron Carbide as a Barium-Free Green Light Emitter and Burn-Rate Modifier in Pyrotechnics«. Angewandte Chemie International Edition. 50 (20): 4624–4626. doi:10.1002/anie.201007827.
- ↑ The Merck Index (7. izd.). Rahway, New Jersey: Merck & Co. 1960.


