Radikálová substitúcia
Radikálové reakcie nie sú bežné ako polárne reakcie avšak sú dôležité pri niektorých priemyselných procesoch a v početných bioprocesoch. Radikály sú vysoko reaktívne, pretože obsahujú atóm s nepárnym počtom elektrónov (zvyčajne 7) na valenčnej vrstve, skôr než stabilný oktet. Radikál môže dosiahnuť oktet niekoľkými spôsobmi. Napríklad radikál môže vziať elektrón z iného reaktantu a pritom vznikne druhý radikál. Výsledkom je radikálová adícia alebo substitúcia. Radikálová substitúcia je substitučná reakcia zahŕňajúca voľné radikály ako reaktívny medziprodukt.
Reakčný mechanizmus
[upraviť | upraviť zdroj]Postupuje podľa 3 krokov reakčného mechanizmu: Iniciácia, Propagácia, Terminácia. [1]
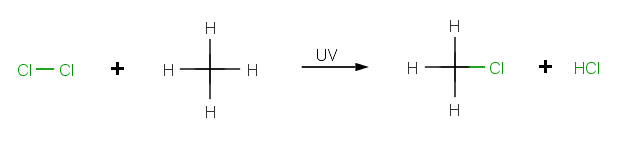
Ukážeme si na príklade reakcie chlórmetánu CH3Cl.
Iniciácia
[upraviť | upraviť zdroj]Ožiarenie UV svetlom začne reakciu štiepením relatívne slabej väzby Cl-Cl malého počtu molekúl chlóru Cl2 za vzniku reaktívnych chloridových radikálov •Cl. [1]
Propagácia
[upraviť | upraviť zdroj]Chloridové radikály napádajú molekuly metánu odoberajúc radikálovo atóm vodíka za vzniku metylového radikálu •CH3. Tieto metylové radikály reagujú s molekulou chlóru v druhom kroku propagácie za vzniku chlórmetánu a chloridového radikálu. Tento cyklus sa vracia k prvému kroku. Keď raz je tento sled iniciovaný, udržiava sa cyklus opakujúcich sa krokov- reťazovej reakcie. [2]
Terminácia
[upraviť | upraviť zdroj]Občas sa stane, že 2 radikály sa stretnú a vytvoria tak stabilný produkt. Keď sa tak stane, cyklus je zastavený a reťazec ukončený. Tento krok nie je veľmi častý, pretože koncentrácia v tomto momente je veľmi malá. Takže šanca, že sa 2 radikály stretnú je tiež veľmi malá. [2]
Reakcie
[upraviť | upraviť zdroj]V radikálovej substitúcii halogénov reagujú radikál (chémia)radikály halogénov s uhľovodíkmi. K dôležitým radikálovým substitúciám patrí aj radikálová substitúcia arylov. Mnoho oxidácií a redukcií v organickej chémii je na princípe radikálovej substitúcie, napr. oxidácia aldehydov na karboxylové kyseliny za katalýzy kyselinou chrómovou.
Niektoré menné reakcie sú:
- Barton-McCombieho redukcia je reakcia, pri ktorej sa substituuje hydroxylová skupina za vodík
- Wohl-Zieglerova reakcia zahŕňa bromáciu alkénov
- Hunsdieckerova reakcia prevádza strieborné soli karboxylových kyselín na halogénuhľovodíky
- Dowd-Beckwithova reakcia predlžuje reťazec cyklických β-keto esterov
- Bartonova reakcia zahŕňa syntézu nitroalkoholov z nitrilov
- Minisciova reakcia zahŕňa tvorbu alkylového radikálu z karboxylovej kyseliny a striebornej soli a následná substitúcia na aromatickú zlúčeninu
Biologický význam
[upraviť | upraviť zdroj]Príkladom je syntéza vitamínu D, ktorý sa tvorí v koži pôsobením slnečného žiarenia z provitamínu 7-dehydrocholesterolu, derivátu cholesterolu. Ultrafialové žiarenie štiepi B jadro zlúčeniny za vzniku cholekalciferolu, teda vitamínu D3.
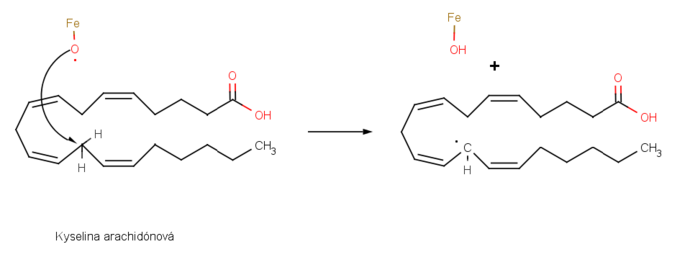
Príkladom je tiež syntéza prostaglandínov- obrovskej skupiny látok obsiahnutých vo všetkých tkanivách a telových tekutinách. Množstvo liečiv je založených na derivátoch prostaglandínov, napríklad lieky vyvolávajúce prácu (posiľujúce matku) pri pôrode, redukujúce vnútrobunkový tlak v glaukóme, kontrolujúce astmu a kontrolujúce vrodené srdcové defekty. Biosyntéza prostaglandínu je iniciovaná odobratím vodíka kyseline arachidónovej železno-kyslíkatým radikálom generujúcim nový uhlíkový radikál v radikálovej substitúcii. [2]
Potom uhlíkový radikál reaguje s molekulou kyslíka O2 za vzniku kyslíkového radikálu, ktorý reaguje s väzbou C=C tej istej molekuly v radikálovej adícii. Niektoré ďalšie transformácie vytvoria prostaglandín H2. [3]
Pozri aj
[upraviť | upraviť zdroj]- Elektrofilná adícia
- Elektrofilná aromatická substitúcia
- Nukleofilná substitúcia
- Radikálová adícia
- Eliminácia
- Nukleofilná adícia
Referencie
[upraviť | upraviť zdroj]- ↑ a b MCMURRY, John. Organic chemistry. 6. vyd. [s.l.] : [s.n.]. ISBN 978-80-214-3291-8. S. 140.
- ↑ a b c MCMURRY, John. Organic chemistry. 6. vyd. [s.l.] : [s.n.]. ISBN 978-80-214-3291-8. S. 141.
- ↑ MCMURRY, John. Organic chemistry. 6. vyd. [s.l.] : [s.n.]. ISBN 978-80-214-3291-8. S. 142.