Cesiu
| Cesiu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații generale | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nume, Simbol, Număr | Cesiu, Cs, 55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie chimică | Metale alcaline | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupă, Perioadă, Bloc | IA, 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitate | 1900 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Culoare | argintiu-aurie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr CAS | 7440-46-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți atomice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masă atomică | 132,94 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază atomică | 267 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază de covalență | 225 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rază van der Waals | 343 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurație electronică | [Xe][6s1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electroni pe nivelul de energie | 2, 8, 18, 18, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Număr de oxidare | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxid | bazic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structură cristalină | cubică cu fețe centrate | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fază ordinară | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de topire | 28,45°C ; 301,6 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fierbere | 670,8°C ; 943,95 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energie de evaporare | 63,9 kJ/mol kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informații diverse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitate (Pauling) | 0,7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate termică | 35,9 W/m·K-1 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prima energie de ionizare | 375,7 kJ/mol kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 2-a energie de ionizare | 2234,3 kJ/mol kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 3-a energie de ionizare | 3400 kJ/mol kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 4-a energie de ionizare | {{{potențial_de_ionizare_4}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 5-a energie de ionizare | {{{potențial_de_ionizare_5}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 6-a energie de ionizare | {{{potențial_de_ionizare_6}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 7-a energie de ionizare | {{{potențial_de_ionizare_7}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 8-a energie de ionizare | {{{potențial_de_ionizare_8}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 9-a energie de ionizare | {{{potențial_de_ionizare_9}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A 10-a energie de ionizare | {{{potențial_de_ionizare_10}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cei mai stabili izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unitățile SI și condiții de temperatură și presiune normale dacă nu s-a specificat altfel. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modifică text |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Cesiul este un element chimic din grupa metalelor alcaline cu simbolul Cs și cu numărul atomic 55. Din punct de vedere fizic, metalul este moale, de culoare argintiu-aurie, cu un punct de topire de 28 °C (82 °F), aceasta făcându-l unul dintre singurele cinci metale care se pot afla în stare lichidă sau într-o stare de trecere dintre starea lichidă și cea solidă la temperatura camerei. [note 1] Cesiul este un metal alcalin și are proprietăți fizico-chimice asemănătoare cu cele ale rubidiului și ale potasiului. Metalul este foarte reactiv și piroforic, reacționând cu apa la o temperatură de cel puțin −116 °C (−177 °F). Este elementul cu cea mai mică electronegativitate având un izotop stabil (Cesiu-133). Metalul este extras din polucit, în timp ce radioizotopii (în special cesiu-137) sunt separați din combustibilul nucleat epuizat.
Cesiul a fost descoperit de către doi chimiști germani, Robert Bunsen și Gustav Kirchhoff în anul 1860 cu ajutorul liniei sale spectroscopice. Prima utilizare pe scară redusă a elementului a fost cea de "reducător" (sau getter) în tuburi cu vid și în celule fotoelectrice. În 1967, perioada specifică de tranziție între cele două niveluri hiperfine ale stării fundamentale ale izotopului cesiu-133 a fost ales de către Sistemul internațional de unități la baza definirii etalonului pentru secunda. Încă de atunci, cesiul a fost utilizat, pe scară largă, ca oscilator cuantic pentru ceasuri atomice.
Din anii 1990, cea mai însemnată utilizare a elementului este aceea de substanță de umplutură pentru lichidele de forat folosite pentru a atenua găurirea din timpul forării. Cesiul mai are o gamă largă de aplicații în producerea electricității, în aparate electronice și în chimie. Radioizotopul cesiu-137 are un timp de înjumătățire de aproximativ 30 de ani și este folosit în medicină, măsurători și hidrologie. Deși elementul nu este foarte toxic, este periculos și exploziv, iar izotopii săi prezintă un risc ridicat în caz de scurgere radioactivă.
Istoric
[modificare | modificare sursă]
În 1860, Robert Bunsen și Gustav Kirchhoff au descoperit cesiul în apa minerală provenită din Dürkheim, Germania. Datorită liniilor spectroscopice de culoare albastră intensă, cesiul și-a primit numele după cuvântul latin caesius, ce înseamnă albastru-celestin. [note 2][2][3][4] Cesiul a fost primul element descoperit cu ajutorul spectrului, la un an după inventarea spectroscopului.[5]
Pentru a obține o mostră pură de cesiu, 44.000 de litri de apă minerală a fost evaporată, rămânând 240 kg de soluție concentrată de săruri. În cele din urmă, cesiul a fost precipitat sub formă de sulfat sau oxalat. După conversia cesiului în azotat și după extracția cu etanol, s-a obținut un amestec cu sodiu. Din acest amestec, litiul a fost precipitat cu carbonat de amoniu, iar potasiul, rubidiul și cesiul au format săruri insolubile cu acidul cloroplatinic, însă aceste săruri prezentau diferențe în solubilitate în apa fierbinte. Prin urmare, hexacloroplatinatul de cesiu și rubidiu ((Cs,Rb)2PtCl6) putea fi separat din amestec prin cristalizare fracționată. După reducerea compusului cu hidrogen, cesiul și rubidiul au putut fi separați datorită diferenței de solubilitate a carbonaților săi în alcool. Din toți cei 44.000 de litri de apă minerală, s-a obținut 9,2 grame de clorură de rubidiu și 7,3 grame de clorură de cesiu.[3]
Cei doi savanți au folosit clorura de cesiu astfel obținută pentru a estima masa atomică a noului element la 123,35 uam (deși astăzi a fost recalculată la 132,9 uam).[3] Aceștia au încercat să obțină cesiu elementar prin electroliza clorurii de cesiu în topitură, dar, în loc să obțină ceea ce au dorit, ei au generat o substanță albastră omogenă „ce nu putea fi văzută nici cu ochiul liber, dar nici cu microscopul”; savanții au crezut că au obținut un compus ne-stoichiometric cu formula (Cs
2Cl). De fapt, ei au produs, cel mai probabil, un amestec coloidal de metal și clorură de cesiu.[6] Electroliza soluției apoasă de clorură cu anod lichid de mercur produce un amalgam ce se descompune rapid sub influența apei.[3] Metalul pur a fost izolat, în cele din urmă, de către chimistul german Carl Setterberg în timp ce își pregătea lucrarea de doctorat cu Kekulé și Bunsen.[4] În 1882, acesta a produs cesiu metalic prin electroliza cianurii de cesiu, iar astfel a fost rezolvată problema clorurii de cesiu.[7]
Din punct de vedere istoric, cele mai importante utilizări ale cesiului au fost în cercetarea științifică și în dezvoltare, mai ales în domeniul chimic. Câteva aplicații ale cesiului existau încă din anii 1920, când a început să fie folosit în tuburi cu vid, unde a avut două funcții: ca epurator (înlătura excesul de oxigen de după fabricare) și ca strat deasupra catodului de încălzire, pentru a crește conductivitatea electrică a acestuia. Cesiul nu a fost recunoscut ca un metal cu utilizări industriale înainte de anii 1950.[8] Printre aplicațiie cesiului non-radioactiv menționăm aplicațiile în celule fotovoltaice, în tuburi fotomultiplicatoare, în componentele optice ale spectrofotometrelor cu raze infra-roșii, în cataliza unor reacții organice și în generatorul magnetohidrodinamic.[9]
Încă din 1967, Sistemul internațional de unități a utilizat cesiul pentru a crea etalonul secundă, definind secunda ca o perioadă de 9.192.631.770 cicluri ale radiației, ce corespund dezintegrării radioactive a atomului de cesiu-133.[10] În urma celei de a 13-a ediție a General Conference on Weights and Measures din 1967, secunda a fost denumită (definită) ca „durata a 9.192.631.770 cicluri a luminii cu microunde absorbită sau emisă de către tranzițiile hiperfine ale atomilor de cesiu-133”.
Proprietăți
[modificare | modificare sursă]Fizice
[modificare | modificare sursă]
Cesiul este un metal foarte moale (are cea mai mică duritate pe Scara Mohs dintre toate elementele, de 0,2), ductil, de culoare alb-argintie, ce prezintă o tentă argintiu-aurie în prezența oxigenului.[9][11] Are un punct de topire de 28,4 °C, devenind astfel unul dintre singurele metale lichide la temperatura camerei, iar mercurul este singurul metal cu temperatura de topire mai mică decât cesiul. [note 3][5] În plus, metalul are și cel mai redus punct de fierbere, după mercurul, dintre metalele, de 641 °C.[13] Compușii săi au culoarea albastră în timpul arderii într-o flacără deschisă.[14]

Cesiul formează și aliaje cu alte metale alcaline și cu aurul și amalgamuri chimice cu mercurul. La temperaturi sub 650 °C, acesta formează aliaje cu cobaltul, fierul, molibdenul, nichelul, platina, tantalul și wolframul. Poate forma, totodată, și compuși intermetalici fotosensibili cu stibiul, galiul, indiul și toriul.[9] Cesiul se poate amesteca cu celălalte metale alcaline (excepție litiul), iar aliajul cu compoziția 41% cesiu, 47% potasiu și 12% sodiu are cel mai mic punct de topire dintre toate aliajele metalelor, de −78 °C.[5][15] Au mai fost studiate și alte amalgamuri: CsHg2 (ce este de culoare neagră și posedă luciu metalic) și CsHg (ce este galben și posedă tot luciu metalic).[16]
Chimice
[modificare | modificare sursă]Cesiul metalic este foarte reactiv și foarte piroforic. În plus, se aprinde în mod spontan în aer și reacționează cu apa la temperaturi reduse, în urma reacției având loc explozii relativ periculoase.[9] Reacția cu apa solidă poate avea loc la temperaturi mai mici de −116 °C.[5] Din cauza reactivității sale ridicate, este clasificat ca fiind un material periculos și nu poate fi transportat, ca și sodiul, decât în hidrocarburi saturate uscate, ca de exemplu în uleiuri minerale. Mai poate fi păstrat și în atmosferele de gaze inerte, ca cea de argon, sau în fiole din sticlă de borsilicat sigilate cu vid. Când este păstrat în cantități mai mari de 100 grame, cesiul este sigilat în containere din oțel inoxidabil.[9] Caracteristicile chimice ale cesiului sunt similare cu cele ale metalelor alcaline, dar mai degrabă, acestea se asemănă cu cele ale rubidiului, elementul chimic situat deasupra cesiului în tabelul periodic al elementelor.[17] Însă, pot apărea mici diferențe între proprietățile chimice datorită masei atomice și a electropozitivității foarte mari.[18] Cesiul este cel mai electropozitiv element cu izotopi stabili. [note 4][5] Ionii de cesiu sunt, de asemenea, grei și mai puțin duri decât al ionilor de metale alcaline.
Compuși
[modificare | modificare sursă]
Cea mai mare parte a compușilor cesiului conțin cationul Cs+ ce se poate combina prin legături ionice cu un mare număr de anioni. O excepție notabilă este anionul de cesiură (Cs-).[20] Alte câteva excepții sunt suboxizii (vezi secțiunea oxizi).
Sărurile ionului Cs+ sunt incolore, deși anionul în sine este colorat. Majoritatea acestora sunt higroscopice, dar acest fenomen este mai puțin prezent decât în cazul sărurilor altor metale alcaline. Fosfatul, acetatul, carbonatul, compușii halogenici, oxidul, azotatul și sulfatul de cesiu sunt solubili în apă.[21] Sărurile duble (adică cele formate din mai mulți cationi și anioni diferiți) sunt adesea greu solubile; însă, această insolubilitate poate avea și aplicații. De exemplu, datorită solubilității scăzute a sulfatului de cesiu și aluminiu, compusul este folosit la purificarea cesiului din minereuri. Sărurile duble cu stibiu (ca de exemplu, CsSbCl
4), bismut, cadmiu, cupru, fier și plumb sunt, de asemenea, puțin solubile.[9]
Hidroxidul de cesiu (CsOH) este o bază foarte puternică și higroscopică.[17] Compusul poate fi folosit la decaparea semiconductoarelor, cum sunt siliciul și germaniul.[22] Hidroxidul de cesiu a fost considerat de chimiști ca „cea mai puternică bază”, fapt datorat atracției slabe dintre ionul Cs+ foarte greu și OH– mai ușor.[14] CsOH este într-adevăr cea mai puternică bază Arrhenius, însă un număr de compuși care nu există în soluții apoase, precum amida de sodiu (NaNH2) și n-butil-litiul (C4H9Li), sunt baze și mai puternice.[17]
Prin reacția unui amestec stoichiometric de cesiu și aur se formează compusul aurura de cesiu.
Compuși complecși
[modificare | modificare sursă]Ca toți cationii metalelor, ionul Cs+ formează compuși complecși în soluțiile bazelor Lewis. Adesea, din cauza greutății sale, Cs+ adoptă numere de coordinare mai mari ca șase, acestea fiind tipice pentru cationii metalelor alcaline ușoare. Această tendință este deja evidențiată în clorura de cesiu (CsCl), unde numărul de coordinare este opt. Moliciunea și numărul de coordinare mare al ionului Cs+ sunt motive principale pentru separarea sa de alți cationi, putând fi folosit la separarea deșeurilor nucleare, unde 137Cs+ este separat de K+ ce nu este radioactiv.[23]
Compuși halogenați
[modificare | modificare sursă]Clorura de cesiu (CsCl) cristalizează în sistemul cristalin cubic. Cunoscut și sub denumirea de „structura clorurii de cesiu” [18], acest model structural este compus dintr-o rețea cubică cu doi atomi la bază și cu numărul de coordinare opt; atomii de clor sunt dispuși deasupra rețelei, la marginea cubului, în timp ce atomii de cesiu stau dispuși în zona centrală a cristalului. Acest model este comun și pentru CsBr și CsI, dar și pentru mulți alți compuși ce nu conțin cesiu. În contrast, mulți alți compuși halogenați ale metalelor alcaline adoptă structura cubică a sării de bucătărie (NaCl).[18] Totuși, structura clorurii de cesiu este cea preferată de cesiu, deoarece Cs+ are o rază atomică 174 pm și Cl- de 181 pm.[24]
Oxizi
[modificare | modificare sursă]
Mai des decât celelalte metale alcaline, cesiul poate forma numeroși compuși binari cu oxigenul. De exemplu, când cesiul arde în aer, se formează superoxidul CsO2.[25] Oxidul de cesiu „normal” (Cs2O), la care starea de oxidare este cea obișnuită pentru metalele alcaline (egală cu 1), formează cristale hexagonale de culoare galben-portocalie [26] și este singurul oxid de tipul anti-clorură de cadmiu (CdCl2).[27] Oxidul se vaporizează la 250 °C iar la temperaturi mai mari de 400 °C se descompune în cesiu metalic și peroxid de cesiu (Cs2O2).[28] În afară de superoxidul și trioxidul de cesiu (CsO3),[29][30] au fost studiați și alți suboxizi viu culorați.[31] Printre aceștia se numără Cs7O, Cs4O, Cs11O3 și Cs3O (negru-verzui [32]), CsO, Cs3O2,[33] precum și Cs7O2.[34][35] Cel din urmă poate fi încălzit sub vid pentru a genera Cs2O.[27] Sunt cunoscuți, de asemenea, și compuși ai cesiului cu sulful, seleniul și telurul, dar sunt foarte puțin studiați și nu există date referitoare la aceștia.[9]
Izotopi
[modificare | modificare sursă]În total, se cunosc 39 de izotopi de cesiu ce oscilează între valorile de 112 și 151 în masa atomică. Câteva dintre aceștia pot fi sintetizați cu ajutorul elementelor mai ușoare; în natură, aceste reacții au loc și în timpul procedeelor din interiorul stelelor bătrâne,[36] precum și în interiorul supernovelor.[37] Totuși, singurul izotop stabil este 133Cs, ce are 78 de neutroni. Deși acesta are un spin nuclear ridicat (7/2+), studiile rezonanței magnetice nucleare pot fi făcute la o frecvență de rezonanță de 11,7 MHz.[38]

Izotopul radioactiv 135Cs are un timp de înjumătățire de aproximativ 2,3 milioane de ani, în timp ce izotopii 137Cs și 134Cs au un timp de înjumătățire de 30 și respectiv 2 ani. 137Cs se descompune în izotopul cu viață scurtă 137mBa prin radiații beta, iar cel din urmă ajunge la forma non-radioactivă cunoscută de bariu. În acest timp, 134Cs se transformă în 134Ba în mod direct. Izotopii de cesiu cu numerele de masă 129, 131, 132 și 136 au un timp de înjumătățire cuprins între o zi și două săptămâni, în timp ce alți izotopi au timpuri de înjumătățire cuprinse între o fracțiune de secundă și o secundă. Însă, mai sunt cunoscuți cel puțin 21 de izomeri nucleari metastabili. În afară de 134mCs (cu un timp de înjumătățire de doar o oră), toți sunt foarte instabili, cu timpi de jumătățire de aproximativ câteva minute sau chiar mai puțin.[39][40] Izotopul 135Cs este unul dintre produșii de fisiune a uraniului ce se poate forma în reactori nucleari.[41] Totuși, produsul de fisiune este redus în majoritatea reactorilor datorită 135Xe, o adevărată „otravă” pentru neutroni, și se transformă în 136Xe înainte de dezintegrarea ce are ca produs 135Cs.[42][43] Datorită descompunerii sale în urma cărora se obține 137mBa, izotopul 137Cs este un puternic emițător de radiații gama.[44] Timpul său de înjumătățire acesta este principalul produs de fisiune cu viață medie (un alt exemplu de acest fel este 90Sr).[45] De exmplu, 137Cs și 90Sr generează cea mai mare sursă radioactivă din zona Cernobîlului.[46] Este puțin probabil ca 137Cs să poată fi creat prin captură nucleară (datorită ratei de captură mici), iar ca rezultat nu trebuie să fie dezintegrat.[47] Aproape tot cesiul produs prin fisiune nucleară provine prin dezintegrarea beta a produșilor de fisiune mai bogați în neutroni, printre care se numără și izotopii iodului și ai xenonului.[48] Din cauza faptului că iodul și xenonul sunt volatili și difuzează prin intermediul combustibilului nuclear și al aerului, cesiul radioactiv este creat, de obicei, la o anumită depărtare de locul fisiunii.[49] Odată cu începutul testării armelor nucleare din jurul anului 1945, cantități de 137Cs au fost emise în atmosferă, iar acestea au revenit pe suprafața Terrei prin precipități radioactive.[9]
Abundență naturală
[modificare | modificare sursă]
Cesiul este un element relativ rar în natură, iar măsurătorile determinate au estimat concentrația sa la aproximativ 3 părți per milion din crusta Pământului.[50] Această răspândire îi atribuie cesiului locul 45 între elementele chimice din punctul de vedere al prezenței sale în natură, și locul 36 printre metale. Cu toate acestea, cesiul este mai abundent decât elemente ca stibiul, cadmiul, staniul și wolframul, și mult mai abundent decât mercurul și argintul, care au o importanță majoră în industrie. Însă, cesiul este cu 30 de ori mai rar decât rubidiul, cu care împarte proprietăți chimice similare și se află deasupra cesiului în Sistemul Periodic.[9]
Datorită mărimii razei sale ionice, cesiul este unul dintre așa-zisele "elemente incompatibile".[51] În timpul solidificării magmei, cesiul este concentrat în fază lichidă, așa că este printre ultimele ce cristalizează. Prin urmare, cele mai mari depozite ale elementului sunt pegmatitele. Din cauza faptului că cesiul nu este un substituent așa puternic și nu substituie potasiul așa de repede cum face rubidiul, mineralele evaporitice silvină (KCl) și carnalit (KMgCl3•6H2O) conțin numai 0,002 % cesiu. Cesiul se găsește în puține minerale. Mici cantități de cesiu pot apărea în beril ((Be
3Al
2(SiO
3)
6), în avogadrit ((K,Cs)BF
4), mai mult de 15 wt% Cs2O în pezotait, Cs(Be2Li)Al2Si6O18), mai mult de 8,4 wt% Cs2O în mineralul rar londonit ((Cs,K)Al
4Be
4(B,Be)
12O
28), și cantități foarte mici în rodizit.[9] Cel mai important mineral ce conține cesiu este polucitul Cs(AlSi
2O
6), ce se formează în câteva zone cu pegmatite din lume, unde poate fi asociat cu minerale conținătoare de litiu, cum ar fi lepidolitul și petalitu.[52]
Una dintre cele mai semnificative și bogate surse de concentrare a metalului este Mina Tanco, situată lângă Lacul Bernic din Manitoba, Canada. Se crede că depozitele de aici conțin aproximativ 350.000 tone metrice de minereu de polucit, reprezentând două treimi din rezervele mondiale.[52][53] Deși procentul stoichiometric al cesiului din polucit este 42,6 %, mostrele pure a acestui mineral din Mina Tanco conțin doar 34 % cesiu, iar media este de 24 wt%.[53] Polucitul comercial conține doar 19% cesiu.[54] Depozitele de pegmatite din zona Bikita din Zimbabwe sunt exploatate pentru a scoate la suprafață petalitul, însă aici se găsesc și cantități semnificative de polucit. Totodată, cantități notabile de polucit mai sunt extrase și în Deșertul Karibib, din Namibia.[53] Luând în considerare rata extracției la nivel mondial și a producției de cesiu (de aproximativ 5 spre 10 tone metrice pe an), aceste rezerve se vor termina peste mii de ani.[9]
Producție
[modificare | modificare sursă]Exploatarea rezervelor de polucit este un procedeu selectiv și se face la scară redusă, în ciuda principalelor procedee de obținere a metalelor. Minereul este sfărâmat și sortat manual, iar apoi cesiul este extras prin trei metode: asimilarea cu acid, descompunerea alcalină și reducerea directă.[9][55]
În timpul asimilării cu acid, roca este dizolvată cu acizi puternici, printre care se numără și acidul clorhidric (HCl), acidul sulfuric (H
2SO
4), acidul bromhidric (HBr) și acidul fluorhidric (HF). Prin reacția cu acidul clorhidric, se produc câteva cloruri, printre care se numără și o clorură dublă insolubile ce precipită sub formă de clorură de stibiu și cesiu (Cs
4SbCl
7), ori clorură de cesiu și iod (Cs
2ICl), sau hexaclorocerat de cesiu (Cs
2(CeCl
6)). După separare, precipitatele pure sunt descompuse, iar, după evaporarea apei existente, se obține clorura de cesiu. Dacă se folosește metoda cu acid sulfuric, atunci în urma reacției rezultă direct alaun de cesiu și aluminiu (CsAl(SO
4)
2•12H
2O). Sulfatul de aluminiu din alaun este convertit prin prăjire cu carbon în oxid de aluminiu insolubil , iar produsul este levigat cu apă pentru a rezulta o soluție de Cs
2SO
4.[9]
Prăjirea polucitului cu carbonat de calciu și clorură de calciu produce silicați de calciu insolubili și clorură de cesiu solubilă. Levigarea cu apă sau cu amoniac diluat (NH
4OH) produce o soluție de clorură de cesiu. Această soluție poate fi evaporată pentru a se obține clorura de cesiu. Cesiul ar putea fi produs direct prin reducerea minereurilor cu potasiu, sodiu sau calciu în vid, dar această metodă nu este folosită.[9]
Majoritatea cesiului aflat în minereuri (sub formă de săruri) este convertit direct în fromatul de cesiu (HCOO−Cs+), ce are anumite aplicații în uleiurile pentru forări. Pentru a suplimenta dezvoltarea pe piață, compania Cabot Corporation a construit o fabrică în 1997 la Mina Tanco din Manitoba, Canada, cu o capacitate de 12 000 de barili (1,900 m3) de format de cesiu pe an.[56] Compușii primari comerciali ai cesiului pe scară redusă sunt clorura și azotatul de cesiu.[57]
Alternativ, cesiul metalic poate fi obținut prin purificarea compușilor derivați din minereu. Clorura de cesiu și respectiv clorurile halogenilor pot fi reduse la 700-800 °C cu calciu sau cu bariu, după care rezultă distilarea cesiului metalic. În același mod, aluminatul, carbonatul și hidroxidul de cesiu pot fi reduși cu magneziu.[9] Totodată, metalul poate fi izolat prin electroliza cianurii de cesiu (CsCN) în topitură. Cesiul foarte pur mai poate fi obținut prin descompunerea termic la 390 °C a nitrurii de cesiu CsN
3, ce se produce prin reacția dintre sulfat de cesiu și nitrură de bariu.[55] În vid, dicromatul de cesiu poate reacționa cu zirconiul formând cesiu metalic pur fără alți produși gazoși.[57]
- Cs
2Cr
2O
7 + 2 Zr → 2 Cs + 2 ZrO
2+ Cr
2O
3
Prețul cesiului de puritate 99,8% în 2009 era de aproximativ 10 dolari pe gram, însă, prețurile compușilor de cesiu sunt vizibil mai ieftine.[53]
Aplicații
[modificare | modificare sursă]Forări petroliere
[modificare | modificare sursă]Cea mai modernă și largă utilizare a cesiului non-radioactiv este pentru crearea formatului numit format de cesiu, ce este un ulei de bază pentru forare.[9] Soluțiile apoase de format de cesiu (HCOO–Cs+) — ce pot fi făcute prin reacția dintre hidroxidul de cesiu și acidul formic — au început să fie folosite ca uleiuri pentru forat încă din preajma anilor 1990. Funcția formatului de cesiu folosit ca ulei de forat este de a lubrifia burghiele pentru găurire, pentru a ajuta ca roca să fie taiată mai ușor și de a menține presiunea exercitată din timpul forării sondelor petroliere.[9] Densitatea ridicată a saramurilor ce conțin formatul de cesiu (mai mare de 2,3 g/cm3),[58] în care se pot regăsi și resturi ale altor compuși de cesiu, reduce toxicitatea solidelor cu densitate mare aflate în uleiul de forare. Acest aspect constituie un avantaj din punct de vedere tehnologic, ingineresc și natural. Spre deosebire de majoritatea componenților din lichizii grei, formatul de cesiu nu dăunează mediului natural.[58] Saramurile de format de cesiu pot fi amestecate formații de potasiu și sodiu pentru ca densitatea să scadă, devenind astfel mai ușoare decât apa (1 g/cm3). În plus, acestea sunt biodegradabile și nerecuperabile, dar pot fi reciclate întrucât sunt relativ scumpe (aproximativ 4.000 USD per baril).[59] Formații alcalini nu sunt periculoși și nu dăunează produsului finit, astfel metalele nu sunt supuse coroziunii.[9]
Generator de energie și putere
[modificare | modificare sursă]Generatoarele termoionice cu vapori de cesiu sunt generatoare cu putere slabă ce convertesc energia termică în energie electrică. În tuburile cu vid cu doi electrozi (ce au rolul de convertor), cesiul neutralizează spațiul de încărcare ce se adună în jurul catodului, iar în aceste fel se îmbunătățește fluxul de electroni emiși.[60]
Cesiul mai este important și pentru proprietățile sale foto-emisive, prin care energia luminii este convertită în curent electric. Mai este folosit și în panourile solare, deoarece catozii pe bază de cesiu, cum ar fi cel din K
2CsSb, au o tensiune de prag pentru emisia electronilor foarte redusă.[61] Prin dispozitivele foto-emisive pe bază de cesiu menționăm aparatele pentru recunoașterea optică a caracterelor, fotomultiplicatorii și camere video (mai exact, tubul de la acestea).[62][63] În ciuda acestor fapte, elementele precum germaniul, rubidiul, seleniul, siliciul, telurul și altele pot substitui cesiul din materialele fotosensibile.[9]
Cristalele iodurii de cesiu (CsI), bromurii de cesiu (CsBr) ȘI fluorurii de cesiu (CsF) sunt folosite în scinilatoare pentru exploatarea minieră și pentru cercetarea particulelor fizice, deoarece sunt adaptate pentru detectarea radiațiilor gama și a razelor X. Fiind un element mai greu, cesiul asigură o bună detectare a acestora.
Vaporii de cesiu sunt larg utilizați în magnetometre.[64] Elementul mai este folosit și ca standard intern în spectrofotometrie.[65] Ca și toate metalele alcaline, cesiul are o oarecare afinitate pentru oxigen și este utilizat ca "getter" (reproducător) în tuburile cu vid.[66] Printre alte utilizări ale metalului mai trebuie menționate aplicațiile în laserele de mare energie, în lămpile fluorescente și în redresoarele cu vapori.[9]
Fluidele de centrifugare
[modificare | modificare sursă]Datorită densității lor foarte ridicate, soluțiile de clorură de cesiu (CsCl), sulfat de cesiu (Cs
2SO
4) și acid trifluoroacetic (Cs(O
2CCF
3)) sunt larg utilizate în biologia moleculară.[67] Această tehnologie este utilizată, în primul rând, la izolarea particulelor virale, organitelor sub-celulare și a acizilor nucleici din mostrele biologice.[68]
Utilizări chimice și medicale
[modificare | modificare sursă]
Există câteva utilizări chimice ale cesiului.[69] Doparea cu compuși ai cesiului este folosită pentru a spori eficiența electrică a mai multor metale sau catalizatori folosiți în producția chimicalelor ca acidul acrilic, antrachinona, oxidul de etilenă, metanolul, anhidrida ftalică, stirenul, metacrilatul de metil și alte olefine. Cesiul mai este folosit și în procedeul de obținere a acidului sulfuric, în timpul conversiei catalitice a dioxidului de sulf la trioxid de sulf.[9] Totodată, cesiul metalic este folosit și la purificarea dioxidului de carbon.[9] Fluorura de cesiu are utilizări în chimia organică , fiind o bază,[17] sau ca sursă anhidră de ioni de fluorură.[70] Adesea, sărurile de cesiu înlocuiesc sărurile de potasiu sau sodiu în sinteza organică.
Aplicațiile nucleare și aplicațiile izotopilor
[modificare | modificare sursă]Cesiu-137 este un radioizotop comun al cesiului folosit ca sursă de raze gama în industrie. Acesta este avantajos datorită timpului de înjumătățire de aproximativ 30 de ani și pentru că poate fi fabricat în urma unui ciclu nuclear, având ca produs de dezintegrare izotopul stabil 137Ba. Însă, datorită solubilității mari în apă, acesta are și dezavantajul de a fi incompatibil cu iradierea produselor alimentare și a consumabilelor medicale.[71] Izotopul a mai fost folosit în agricultură, tratamentul cancerului, la sterilizarea mâncării, la nămolurile pentru epurare și în echipamentul chirurgical.[9][72] Izotopii radioactivi ai cesiului au mai fost folosiți în radioterapie pentru a trata diferite tipuri de cancer,[73] dar apariția unor alternative mai bune, precum și utilizarea clorurii de cesiu solubile în apă, ce crea contaminări, a dus treptat la scoaterea lor din uz.[74][75] Cesiu-137 a fost utilizat în diferite tipuri de măsurare industriale, printre care se numără măsurarea umidității, densității și a grosimii.[76] A fost folosit, de asemenea, în aparatele pentru diagrafie pentru măsurarea densității unei roci.[77] Izotopul cesiu-137 a mai fost folosit în studiile hidrologice, similare cu cele în care se folosea tritiu, fiind un produs de fisiune nucleară. Odată cu începerea testelor nucleare din 1945 (ce au durat până în anii 1980), mari cantități ale izotopului au fost eliberate în atmosferă, unde au fost absorbite sub formă de soluție. Cesiu-134 și cesiu-135 au fost utilizați în hidrologie ca măsurători pentru producția de cesiu provenită din industria nucleară. Deși sunt mai puțin răspândiți decât cesiu-133 sau cesiu-137, aceștia au avantajul că pot fi produși numai din surse antropogenice.[78][79]
Hazard
[modificare | modificare sursă]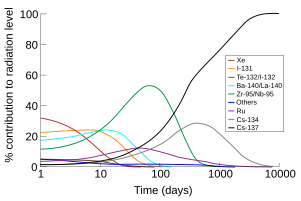
Deși riscul intrării în contact cu compuși ai cesiului în cursul vieții este redus pentru majoritatea oamenilor, aceștia sunt relativ toxici datorită asemănării cesiului cu potasiul. Contactul de largă durată cu compușii cesiului poate cauza iritabilitate și spasme, dar astfel de substanțe nu vor fi găsite în natură, iar cesiul nu este un poluant chimic major.[81] Valoarea dozei letale medii a clorurii de cesiu pentru șoareci este 2,3 g per kilogram, ce este simțitor mai mică decât cea pentru clorura de potasiu sau clorura de sodiu.[82]
| NFPA 704 |
|---|
| Codul NFPA 704 pentru cesiul metalic |
Cesiul este unul dintre cele mai reactive elemente și este foarte exploziv când reacționează cu apa. Hidrogenul gazos produs în urma reacției este încălzit de către energia termică ce provine din aceasta și poate cauza aprindere și explozie violentă. Această manifestare apare și la celelalte metale alcaline, dar cesiul este atât de reactiv, încât această reacție are loc chiar și cu apă foarte rece.[9] Metalul este foarte piroforic, și se aprinde spontan în aer producând hidroxid de cesiu și alți oxizi. Hidroxidul său este o bază foarte puternică, ce poate coroda chiar și sticla.[13] Izotopii cesiu-134 și cesiu-137 (prezenți și în cantități mici în biosferă, în locurile unde au avut loc scurgeri radioactive) reprezintă o adevărată povară radioactivă. Cesiul radioactiv nu se acumulează în corp la fel de eficient ca alți produși de fisiune (ca de exemplu iodul sau stronțiul radioactiv). Ca și în cazul altor metale alcaline, cesiul radioactiv iese din corp relativ repede, prin transpirație și urină. Totuși, cesiul radioactiv este similar potasiului și tinde să se acumuleze în țesuturile plantelor, adică în fructe și legume.[83][84][85] Se mai cunoaște că ciupercile ce provin din pădurile contaminate acumulează cesiu radioactiv (cesiu-137) în pălaria lor.[86] Acumularea izotopului cesiu-137 în lacuri a reprezentat prima mare îngrijorare de după dezastrul de la Cernobîl.[87][88] Experimentele făcute pe câini au arătat că o singură doză de 3,8 mCi (140 MBq, 4,1 μg de cesiu-137) per kilogram este letală în trei săptămâni;[89] cantități mai mici pot cauza infertilitate și cancer.[90] Agenția Internațională pentru Energie Atomică a atenționat că materiale radioactive, printre care și cesiu-137, pot fi folosite în dispozitivele de dispersie radiologică, sau în „bombe murdare”.[91]
Vezi și
[modificare | modificare sursă]- Accidentul din Goiânia, o contaminare majoră radioactivă, implicând și o bară de clorură de cesiu
- Accidentul din Acerinox, o contaminare cu cesiu-137
- Fluor, cel mai electronegativ element, este elementul opus cesiului
Note
[modificare | modificare sursă]- ^ Împreună cu rubidiu (39 °C [102 °F]), franciu (estimat la 27 °C [81 °F]), mercur (−39 °C [−38 °F]), și galiu (30 °C [86 °F]); bromul este, de asemenea, lichid la temperatura camerei și are un punct de topire de −7.2 °C, 19 °F), dar este un halogen, nu un metal.[1]
- ^ Bunsen l-a citat pe Aulus Gellius: Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.
- ^ Elementul radioactiv numit franciu poate avea un punct de topire mai mic, dar radioactivitatea sa nu permite efectuarea testelor necesare determinării acestuia.[12]
- ^ Franciu poate fi mult mai electropozitic, dar acesta nu a fost studiat exeprimental datorită radioacitvității sale ridicate.[19]
Referințe
[modificare | modificare sursă]- ^ „WebElements Periodic Table of the Elements”. University of Sheffield. Accesat în .
- ^ Oxford English Dictionary, 2nd Edition
- ^ a b c d Kirchhoff, G.; Bunsen, R. (). „Chemische Analyse durch Spectralbeobachtungen”. Annalen der Physik und Chemie. 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702.
- ^ a b Weeks, Mary Elvira (). „The discovery of the elements. XIII. Some spectroscopic discoveries”. Journal of Chemical Education. 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ^ a b c d e Kaner, Richard (). „C&EN: It's Elemental: The Periodic Table – Cesium”. American Chemical Society. Accesat în .
- ^ Zsigmondy, Richard (). Colloids and the Ultra Microscope. Read books. p. 69. ISBN 978-1-4067-5938-9. Accesat în .
- ^ Setterberg, Carl (). „Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst”. Justus Liebig's Annalen der Chemie. 211: 100–116. doi:10.1002/jlac.18822110105.
- ^ Strod, A.J. (). „Cesium—A new industrial metal”. American Ceramic Bulletin. 36 (6): 212–213.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2004). „Mineral Commodity Profile: Cesium” (PDF). United States Geological Survey. Accesat în 20 martie 2012. Verificați datele pentru:
|access-date=(ajutor) - ^ „Cesium Atoms at Work”. Time Service Department—U.S. Naval Observatory—Department of the Navy. Arhivat din original la . Accesat în .
- ^ Heiserman, David L. (). Exploring Chemical Elements and their Compounds. McGraw-Hill. pp. 201–203. ISBN 0-8306-3015-5.
- ^ „Francium”. Periodic.lanl.gov. Accesat în .
- ^ a b „Date chimie – Cesiu – Cs”. Royal Society of Chemistry. Accesat în .
- ^ a b Lynch, Charles T. (). CRC Handbook of Materials Science. CRC Press. p. 13. ISBN 978-0-8493-2321-8. Accesat în . Parametru necunoscut
|unused_data=ignorat (ajutor) - ^ Taova, T. M.; et al. (). „Densitatea topiturilor metalelor alcaline și sistemele ternare Na-K-Cs și Na-K-Rb” (PDF). Fifteenth symposium on thermophysical properties, Boulder, Colorado, USA. Arhivat din original (PDF) la . Accesat în .
- ^ Deiseroth, H. J. (). „Amalgamurile metalelor alcaline”. Progress in Solid State Chemistry. 25 (1–2): 73–123. doi:10.1016/S0079-6786(97)81004-7.
- ^ a b c d Greenwood, N.N.; Earnshaw, A. (). Chemistry of the Elements. Oxford, UK: Pergamon Press. ISBN 0-08-022057-6.
- ^ a b c Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (). „Vergleichende Übersicht über die Gruppe der Alkalimetalle”. Lehrbuch der Anorganischen Chemie (în German) (ed. 91–100). Walter de Gruyter. pp. 953–955. ISBN 3-11-007511-3.
- ^ Andreev, S. V.; Letokhov, V. S.; Mishin, V. I. (). „Laser resonance photoionization spectroscopy of Rydberg levels in Fr”. Physical Review Letters. 59 (12): 1274–76. Bibcode:1987PhRvL..59.1274A. doi:10.1103/PhysRevLett.59.1274. PMID 10035190.
- ^ Dye, J. L. (). „Compounds of Alkali Metal Anions”. Angewandte Chemie International Edition. 18 (8): 587–598. doi:10.1002/anie.197905871.
- ^ C.Michael Hogan. 2011. Phosphate. Encyclopedia of Earth. Topic ed. Andy Jorgensen. Ed.-in-Chief C.J.Cleveland. National Council for Science and the Environment. Washington DC
- ^ Köhler, Michael J. (). Etching in microsystem technology. Wiley-VCH. p. 90. ISBN 3-527-29561-5.[nefuncțională]
- ^ Moyer, Bruce A.; Birdwell, Joseph F.; Bonnesen, Peter V.; Delmau, Laetitia H. (). „Use of Macrocycles in Nuclear-Waste Cleanup: A Realworld Application of a Calixcrown in Cesium Separation Technology”: 383–405. doi:10.1007/1-4020-3687-6_24..
- ^ Wells, A.F. (). Structural Inorganic Chemistry (ed. 5). Oxford Science Publications. ISBN 0-19-855370-6.
- ^ Cotton, F. Albert (). Advanced Inorganic Chemistry. John Wiley & Sons, Inc. p. 318. ISBN 0-471-84997-9.
- ^ Format:RubberBible87th
- ^ a b Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (). „The Crystal Structure of Cesium Monoxide”. Journal of Physical Chemistry. 60 (3): 338–344. doi:10.1021/j150537a022.
- ^ „Information Bridge: DOE Scientific and Technical Information” (PDF). Office of Scientific and Technical Information — U.S. Department of Energy. . Accesat în .
- ^ Vol'nov, I. I.; Matveev, V. V. (). „Synthesis of cesium ozonide through cesium superoxide”. Bulletin of the Academy of Sciences, USSR Division of Chemical Science. 12 (6): 1040–1043. doi:10.1007/BF00845494.
- ^ Tokareva, S. A. (). „Alkali and Alkaline Earth Metal Ozonides”. Russian Chemical Reviews. 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903.
- ^ Simon, A. (). „Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels”. Coordination Chemistry Reviews. 163: 253–270. doi:10.1016/S0010-8545(97)00013-1.
- ^ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (). „The Crystal Structure of Tricesium Monoxide”. Journal of Physical Chemistry. 60 (3): 345–347. doi:10.1021/j150537a023.
- ^ Okamoto, H. (). „Cs-O (Cesiu-Oxigen)”. Journal of Phase Equilibria and Diffusion. 31: 86. doi:10.1007/s11669-009-9636-5.
- ^ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. (). „Characterization of Oxides of Cesium”. The Journal of Physical Chemistry B. 108 (33): 12360–12367. doi:10.1021/jp036432o.
- ^ Brauer, G. (). „Untersuchungen ber das System Csium-Sauerstoff”. Zeitschrift fr anorganische Chemie. 255: 101. doi:10.1002/zaac.19472550110.
- ^ Busso, M.; Gallino, R.; Wasserburg, G. J. (). „Nucleosynthesis in Asymptotic Giant Branch Stars: Relevance for Galactic Enrichment and Solar System Formation” (PDF). Annula Review of Astronomy and Astrophysics. 37: 239–309. Bibcode:1999ARA&A..37..239B. doi:10.1146/annurev.astro.37.1.239. Accesat în .
- ^ Arnett, David (). Supernovae and Nucleosynthesis: An Investigation of the History of Matter, from the Big Bang to the Present. Princeton University Press. p. 527. ISBN 0-691-01147-8.
- ^ Goff, C; Matchette, Michael A.; Shabestary, Nahid; Khazaeli, Sadegh (). „Complexation of caesium and rubidium cations with crown ethers in N,N-dimethylformamide”. Polyhedron. 15 (21): 3897. doi:10.1016/0277-5387(96)00018-6.
- ^ Brown, F.; Hall, G.R.; Walter, A.J. (). „The half-life of Cs137”. Journal of Inorganic and Nuclear Chemistry. 1 (4–5): 241–247. doi:10.1016/0022-1902(55)80027-9.
- ^ Sonzogni, Alejandro. „Interactive Chart of Nuclides”. National Nuclear Data Center: Brookhaven National Laboratory. Arhivat din original la . Accesat în .
- ^ Ohki, Shigeo; Takaki, Naoyuki (). Transmutation of Cesium-135 with Fast Reactors (PDF). Seventh Information Exchange Meeting on Actinide and Fission Product Partitioning and Transmutation. Jeju, Korea. Arhivat din original (PDF) la . Accesat în .
- ^ „20 Xenon: A Fission Product Poison”. CANDU Fundamentals (PDF) (Raport). CANDU Owners Group Inc. Arhivat din original (PDF) la . Accesat în .
- ^ Taylor, V. F.; Evans, R. D.; Cornett, R. J. (). „Preliminary evaluation of 135Cs/137Cs as a forensic tool for identifying source of radioactive contamination”. Journal of Environmental Radioactivity. 99 (1): 109–118. doi:10.1016/j.jenvrad.2007.07.006. PMID 17869392.
- ^ „Cesium | Radiation Protection”. U.S. Environmental Protection Agency. . Accesat în .
- ^ Zerriffi, Hisham (). IEER Report: Transmutation – Nuclear Alchemy Gamble (Raport). Institute for Energy and Environmental Research. Accesat în .
- ^ Chernobyl's Legacy: Health, Environmental and Socia-Economic Impacts and Recommendations to the Governments of Belarus, Russian Federation and Ukraine (PDF) (Raport). International Atomic Energy Agency. Accesat în .
- ^ Kase, Takeshi; Konashi, Kenji; Takahashi, Hiroshi; Hirao, Yasuo (). „Transmutation of Cesium-137 Using Proton Accelerator”. Journal of Nuclear Science and Technology. 30 (9): 911–918. doi:10.3327/jnst.30.911.
- ^ Knief, Ronald Allen (). „Fission Fragments”. Nuclear engineering: theory and technology of commercial nuclear power. Taylor & Francis. p. 42. ISBN 978-1-56032-088-3. Accesat în .
- ^ Ishiwatari, N.; Nagai, H. „Release of xenon-137 and iodine-137 from UO2 pellet by pulse neutron irradiation at NSRR”. Nippon Genshiryoku Gakkaishi. 23 (11): 843–850. OSTI 5714707.
- ^ en Turekian, K.K.; Wedepohl, K. H. (). „Distribution of the elements in some major units of the Earth's crust”. Geological Society of America Bulletin. 72 (2): 175–192. doi:10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2. ISSN 0016-7606.
- ^ en Rowland, Simon (04. iul. 1998). „Cesium as a Raw Material: Occurrence and Uses”. Artemis Society International. Arhivat din original la 2021-07-08. Accesat în 25 martie 2012. Verificați datele pentru:
|access-date=, |date=(ajutor) - ^ a b en Černý, Petr; Simpson, F. M. (1978). „The Tanco Pegmatite at Bernic Lake, Manitoba: X. Pollucite” (PDF). Canadian Mineralogist. 16: 325–333. Accesat în 25 martie 2012. Verificați datele pentru:
|access-date=(ajutor) - ^ a b c d en Polyak, Désirée E. „Cesium” (PDF). U.S. Geological Survey. Accesat în 25 martie 2012. Verificați datele pentru:
|access-date=(ajutor) - ^ Norton, J. J. (1973). „Lithium, cesium, and rubidium—The rare alkali metals”. În Brobst, D. A., and Pratt, W. P. United States mineral resources. Paper 820. U.S. Geological Survey Professional. pp. 365–378. Arhivat din original la 2010-07-21. Accesat în 25 martie 2012. Verificați datele pentru:
|access-date=(ajutor) - ^ a b Burt, R. O. (). „Caesium and cesium compounds”. Kirk-Othmer encyclopedia of chemical technology. 5 (ed. 4th). New York: John Wiley & Sons, Inc. pp. 749–764. ISBN 978-0-471-48494-3.
- ^ Benton, William; Turner, Jim (). „Cesium formate fluid succeeds in North Sea HPHT field trials” (PDF). Drilling Contractor (May/June): 38–41. Accesat în .
- ^ a b transl. and rev. by Eagleson, Mary (). Concise encyclopedia chemistry. Berlin: de Gruyter. p. 198. ISBN 978-3-11-011451-5. Accesat în .
- ^ a b Downs, J. D.; Blaszczynski, M.; Turner, J.; Harris, M. (). Drilling and Completing Difficult HP/HT Wells With the Aid of Cesium Formate Brines-A Performance Review. IADC/SPE Drilling Conference. Miami, Florida, USASociety of Petroleum Engineers. doi:10.2118/99068-MS. Arhivat din originalul de la . Accesat în .
- ^ Flatern, Rick (). „Keeping cool in the HPHT environment”. Offshore Engineer (February): 33–37.
- ^ Rasor, Ned S.; Warner, Charles (septembrie 1964). „Correlation of Emission Processes for Adsorbed Alkali Films on Metal Surfaces”. Journal of Applied Physics. 35 (9): 2589–2600. Bibcode:1964JAP....35.2589R. doi:10.1063/1.1713806.
- ^ „Cesium Supplier & Technical Information”. American Elements. Accesat în .
- ^ Smedley, John; Rao, Triveni; Wang, Erdong; Crabb, Donald G.; Prok, Yelena; Poelker, Matt; Liuti, Simonetta; Day, Donal B.; Zheng, Xiaochao (). „Dezvoltarea cadodului de K 2CsSb”. American Institute of Physics Conference Proceedings. 1149: 1062–1066. doi:10.1063/1.3215593.
- ^ Görlich, P. (). „Über zusammengesetzte, durchsichtige Photokathoden”. Zeitschrift für Physik. 101 (5–6): 335–342. Bibcode:1936ZPhy..101..335G. doi:10.1007/BF01342330.
- ^ Groeger, S.; Pazgalev, A. S.; Weis, A. (). „Comparația dintre o lampă de descărcare și magnetometrele cu vapori de cesiu”. Applied Physics B. 80 (6): 645–654. arXiv:physics/0412011
 . Bibcode:2005ApPhB..80..645G. doi:10.1007/s00340-005-1773-x.
. Bibcode:2005ApPhB..80..645G. doi:10.1007/s00340-005-1773-x.
- ^ Haven, Mary C.; Tetrault, Gregory A.; Schenken, Jerald R. (). „Internal Standards”. Instrumentație de laborator. New York: John Wiley and Sons. p. 108. ISBN 978-0-471-28572-4. Accesat în .
- ^ McGee, James D. (). Photo-electronic image devices: proceedings of the fourth symposium held at Imperial College, London, September 16–20, 1968. 9780120145287. 1. Academic Press. p. 391. ISBN 978-0-12-014528-7. Accesat în .
- ^ Manfred Bick, Horst Prinz, "Cesium and Cesium Compounds" din "Ullmann's Encyclopedia of Industrial Chemistry 2005", Wiley-VCH, Weinheim. doi:153 10.1002/14356007.a06 153.
- ^ Desai, Mohamed A., ed. (). „Gradient Materials”. Downstream processing methods. Totowa, N.J.: Humana Press. pp. 61–62. ISBN 978-0-89603-564-5. Accesat în .
- ^ Burt, R. O. (). „Cesium and cesium compounds”. Kirk-Othmer encyclopedia of chemical technology. 5 (ed. 4th). New York: John Wiley & Sons. p. 759. ISBN 978-0-471-15158-6.
- ^ Gregory K. Friestad, Bruce P. Branchaud, Walter Navarrini, Maurizio Sansotera "Cesium Fluoride" in Encyclopedia of Reagents for Organic Synthesis 2007, John Wiley & Sons. doi:10.1002/047084289X.rc050.pub2
- ^ Okumura, Takeshi (). „The material flow of radioactive cesium-137 in the U.S. 2000” (PDF). United States Environmental Protection Agency. Arhivat din original (PDF) la . Accesat în .
- ^ Jensen, N. L. (). Cesium, in Mineral facts and problems. Bulletin 675. U.S. Bureau of Mines. pp. 133–138.
- ^ „IsoRay's Cesium-131 Medical Isotope Used In Milestone Procedure Treating Eye Cancers At Tufts-New England Medical Center”. Medicalnewstoday.com. . Accesat în .
- ^ Bentel, Gunilla Carleson (). „Caesium-137 Machines”. Radiation therapy planning. McGraw-Hill Professional. p. 22. ISBN 978-0-07-005115-7. Accesat în . Mai multe valori specificate pentru
|pages=și|page=(ajutor) - ^ National Research Council (U.S.). Committee on Radiation Source Use and Replacement (). Radiation source use and replacement: abbreviated version. National Academies Press. ISBN 978-0-309-11014-3. Accesat în .
- ^ Loxton, R., Pope, P., ed. (). „Level and density measurement using non-contact nuclear gauges”. Instrumentation : A Reader. London: Chapman & Hall. pp. 82–85. ISBN 978-0-412-53400-3. Accesat în .
- ^ Timur, A.; Toksoz, M. N. (). „Downhole Geophysical Logging”. Annual Review of Earth and Planetary Sciences. 13: 315. Bibcode:1985AREPS..13..315T. doi:10.1146/annurev.ea.13.050185.001531.
- ^ Kendall, Carol. „Isotope Tracers Project – Resources on Isotopes – Cesium”. National Research Program – U.S. Geological Survey. Accesat în .
- ^ http://books.google.com/books?id=pWDQnxd-r1UC&pg=PT360 &pg=PT12
- ^ Datele luate de la OECD report și din The radiochemical Manual (2nd ed.) B.J. Wilson (1966).
- ^ Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (). „Cesiul în mamifere:Toxicitate acută, schimbarea organelor și acumularea țesutului”. Journal of Environmental Science and Health, Part A. 16 (5): 549– 567. doi:10.1080/10934528109375003.
- ^ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (). „Toxicitatea acută a compușilor de cesiu și rubidiu”. Toxicology and Applied Pharmacology. 32 (2): 239–245. doi:10.1016/0041-008X(75)90216-1. PMID 1154391.
- ^ Nishita, H.; Dixon, D.; Larson, K. H. (). „Acumularea cesiului și potasiului și creșterea semințelor în soluții de nutrienți și diferite soluri”. Plant and Soil. 17 (2): 221–242. doi:10.1007/BF01376226.
- ^ Avery, S. (). „Soarta cesiului în natură:Distribuția dintre componentele biotice și abiotice în ecosistemele acvatice și terestre”. Journal of Environmental Radioactivity. 30 (2): 139–171. doi:10.1016/0265-931X(96)89276-9.
- ^ Salbu, Brit; Østby, Georg; Garmo, Torstein H.; Hove, Knut (). „Availability of caesium isotopes in vegetation estimated from incubation and extraction experiments”. Analyst. 117 (3): 487–491. Bibcode:1992Ana...117..487S. doi:10.1039/AN9921700487. PMID 1580386.
- ^ M Vinichuk, A F S Taylor, K Rosén, K J Johanson. Acumularea potasiului, rubidiului și a cesiului ((133)Cs și (137)Cs) în diferite fracțiuni de sol și în ciuperci într-o pădure suedeză. Science of the total envrironment 03: 2010 DOI: 10.1016/j.scitotenv.2010.02.024
- ^ Smith, Jim T.; Beresford, Nicholas A. Cernobîl: Catastrofa și consecințele. Berlin: Springer. ISBN 3-540-23866-2.
- ^ Eremeev, V. N.; Chudinovskikh, T. V.; Batrakov, G. F.; Ivanova, T. M. (). „Izotopii radioactivi ai cesiului în apa și din Marea Neagră”. Physical Oceanography. 2 (1): 57–64. doi:10.1007/BF02197418.
- ^ Redman, H. C.; McClellan, R. O.; Jones, R. K.; Boecker, B. B.; Chiffelle, T. L.; Pickrell, J. A.; Rypka, E. W. (). „Toxicitatea 137-CsCl într-un Beagle. Efectele biologice premature”. Radiation Research. 50 (3): 629–648. doi:10.2307/3573559. JSTOR 3573559. PMID 5030090.
- ^ „Chinezii 'găsesc' mingi radioactive”. BBC News. . Accesat în .
- ^ Charbonneau, Louis (). „directorul IAEA a atenționată riscul „dirty bomb" (bomblelor murdare)”. Washington Post. Reuters. p. A15. Accesat în . Text "date 2003-03-12" ignorat (ajutor)
Bibliografie
[modificare | modificare sursă]- V Vasilescu Biofizica medicala EDP 1977
Legături externe
[modificare | modificare sursă]- Daniel A. Steck. „Cesium D Line Data” (PDF). Los Alamos National Laboratory (technical report LA-UR-03-7943). Arhivat din original (PDF) la . Accesat în .
- WebElements.com – Caesium
- Humor site dedicated to caesium
| |||||
| |||||||||||||||||||||||||||||||||||||


