Nitrato de amônio
| Ammonium nitrate Alerta sobre risco à saúde | |
|---|---|
| |
| |
| Nome IUPAC | Nitrato de amônio |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número RTECS | BR9050000 |
| Propriedades | |
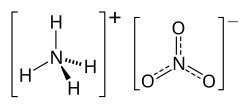
| Fórmula molecular | NH4NO3 |
| Massa molar | 80.04336 g/mol |
| Aparência | Sólido Branco |
| Densidade | 1,73 g·cm-3 (20 °C)[1] |
| Ponto de fusão |
169,6 °C [1] |
| Ponto de ebulição |
Decompõe-se a 170 °C (Pressão normal) [1] |
| Solubilidade em água | 1877 g/L (20 °C) 118 g/100 ml (0 °C) 150 g/100 ml (10 °C) 192 g/100 ml (20 °C) 242 g/100 ml (30 °C) 297 g/100 ml (40 °C) 344 g/100 ml (50 °C) 421 g/100 ml (60 °C) 499 g/100 ml (70 °C) 580 g/100 ml (80 °C) 740 g/100 ml (90 °C) 871 g/100 ml (100 °C) [2] |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
-366 kJ·mol-1[3] |
| Explosive data | |
| Sensibilidade ao choque | Muito baixa |
| Sensibilidade à fricção | Muito baixa |
| Velocidade de explosão | 5270 m/s |
| Riscos associados | |
| MSDS | ICSC 0216 |
| Índice UE | Não listado |
| Principais riscos associados |
Explosivo |
| NFPA 704 | |
| Frases R | R8, R9 |
| Frases S | S15, S16, S41 |
| LD50 | 2085–5300 mg/kg (oral in rats, mice)[4] |
| Compostos relacionados | |
| Outros aniões/ânions | Nitrito de amônio Perclorato de amônio |
| Outros catiões/cátions | Nitrato de sódio Nitrato de potássio Nitrato de hidroxiamônio |
| Compostos relacionados | óxido nitroso |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O nitrato de amónio (português europeu) ou nitrato de amônio (português brasileiro) é um composto químico de fórmula molecular NH4NO3, sendo constituído pelos íons NH4+ e NO3–.
Características
editarÉ um sal inorgânico que, quando puro, é encontrado na cor branca e quando impuro nas colorações: cinza claro ou marrom, se estiver na forma de um cristal relativamente grande, aparenta-se com o sal grosso (NaCl). É inodoro, e, em solução aquosa, precipita-se misturando-se lentamente com a água, sua dissolução é bastante endotérmica.
Uma de suas particularidades agronômicas é que detém ao mesmo tempo duas formas de fornecimento de nitrogênio ao solo, a nítrica (NO3), e a amoniacal (NH4). Como a forma amoniacal tem carga elétrica positiva (+), pode se ligar aos colóides do solo, principalmente nas argilas, pois as mesmas têm cargas elétricas negativas. O mesmo não ocorre com a forma nítrica que tem carga elétrica negativa (-), não sendo portanto absorvida pelas argilas, podendo sofrer o processo de perda chamado lixiviação ou percolação, que é transporte às camadas mais profundas dos solos, escapando assim da ação absorvedora das raízes das plantas.
Quando o nitrato de amônio é excitado com um fogareiro elétrico libera óxido nitroso (N2O), mais conhecido como gás hilariante ou gás do riso.
Pode ser produzido pela reação entre sulfato de amônio [(NH4)2SO4] e nitrato de cálcio [Ca(NO3)2], de acordo com a reação:
- (NH4)2SO4 + Ca(NO3)2}→ 2 NH4NO3+ CaSO4.
Produção a partir da amônia gasosa
editarPode ser produzido a partir da reação da amônia gasosa com uma solução de ácido nítrico, de acordo com a reação:
NH3(g) + HNO3(aq) → NH4NO3(aq)
Usos
editarUsado como fertilizante, herbicida, inseticida, absorvente para óxidos de nitrogênio, na fabricação de óxido nitroso, como oxidante em propelentes sólidos para foguetes, explosivos, etc.
O nitrato de amônio é obtido através da neutralização do ácido nítrico pela adição de hidróxido de amônio, ou ainda pode ser preparado com nitrato de sódio e hidróxido de amônio.
O nitrato de amônio (NH4 NO3) possui em média 34% de nitrogênio, é um produto sólido, perolado ou granulado, contém um radical nítrico e outro amoniacal, muito usado na agricultura por possuir menor volatilização e acidificação do solo, se adapta bem às misturas NPK e muito adequado para fertirrigação. Foi o fertilizante nitrogenado mais utilizado no mundo até o fim dos anos 80, quando teve seu consumo reduzido devido ao aumento no controle de sua venda, uma vez que é a matéria-prima principal para a fabricação de ANFOs (amonium-nitrate, fuel-oil) (FRANCO et al., 2007). O Nitrato de Amônio, dentre as fontes nitrogenadas mais usadas, é a que apresenta menor índice de acidez no solo, em número de 62, ou seja, para cada 100 kg de Nitrato de Amônio é necessário 62 kg de Carbonato de Cálcio para neutralizar a acidez no solo.[5]
Riscos
editarPerigos mais iminentes: Por ser oxidante, pode interagir com outros produtos. Quando contaminado com produtos orgânicos ou materiais redutores, aquecido, confinado, e ainda sob ação de agentes iniciadores, pode detonar. Risco de ignição ou detonação ao expor-se o produto ao calor e a materiais incompatíveis.
Perigos físicos e químicos: O nitrato de amônio é um forte oxidante. A contaminação pode promover a sua decomposição, tornando-o imprevisível e perigoso. Os contaminantes incluem matéria orgânica, cloretos, fluoretos e também alguns metais (exemplos: cobre, bronze, cromo, zinco e outros).
Efeitos do produto em animais: A inalação pode causar irritação do trato respiratório, com tosse, dor de garganta e dificuldade respiratória. O contato com o produto pode causar irritação na pele e nos olhos.
Exposto a altas temperaturas, devido à decomposição, pode liberar amônia e gases nitrosos tóxicos (NOx), capazes de provocar problemas respiratórios agudos.
Efeitos ambientais: É muito hidrossolúvel, podendo contaminar cursos d’água, tornando-os impróprios para uso em qualquer finalidade. O produto da combustão do nitrato de amônia é o óxido nitroso, . Este composto é um agravante do efeito estufa, sendo 273 vezes mais nocivo que o dióxido de carbono, . (Xavier, A. Agronomia/UFSM, 2008)
Efeitos na saúde humana: O nitrato de amônio causa irritações nos olhos, na pele e no trato respiratório. A substância pode afetar o sangue, devido ao íon nitrato, causando uma doença chamada metaemoglobinemia, ou doença do bebê azul.[6] Seus principais efeitos na saúde humana e dos ecossistemas são decorrentes dos compostos secundários que podem ser formados.
Contaminação ambiental
editarO íon nitrato é fonte de nutrição para plantas (principal uso é como fertilizante) e, portanto pode seguir o ciclo natural de nitrificação/ desnitrificação ou pode ser transportado através do solo atingindo as águas subterrâneas e chegando em curso d'água, tornando-os saturados em nitrogênio.[7] Quando o íon amônio permanece adsorvidos as cargas negativas do solo o íon nitrato permanece em solução, sua potabilidade em água para o consumo humano é estabelecida pela portaria n°518/GM em 25 de março de 2010.[8] Já a resolução CONAMA de março de 2005 estabelece as concentrações máximas de nitrato para as águas de acordo com o seu uso e características. A liberação do íon nitrato no meio, além de ser causada pela interação com as partículas do solo, também pode ser causada por elevação da temperatura e aeração na ausência de água, tais condições possibilitam a oxidação do nitrogênio e a decomposição da matéria orgânica.[9][10] No perfil do solo o nitrato de amônio está sujeito a reações, dentre elas a de decomposição, sendo que o íon amônio é biodegradável. As reações de decomposição podem ser catalisadas pela presença de Cl, Fe, Co, Ni, Zn e Cu ou podem ser resultantes do aumento de temperatura no solo (KIISKI, 2009).
Recomendações
editarExistem técnicas específicas para a remoção do íon nitrato da água, dentre elas destacam-se a osmose reversa e a permuta iônica. Já no solo, podem ser usados inibidores de nitrificação, estes inibem a conversão de amônio em nitrato.
Acidentes com nitrato de amônio
editarEm 16 de abril de 1947, ocorreu o Desastre de Texas City, considerado o mais mortífero acidente industrial da história dos EUA. A causa do acidente foi o calor devido a um incêndio no cargueiro francês, SS Grandcamp, que levou cerca de 2.086 toneladas de nitrato de amônio a entrarem em combustão, gerando uma explosão de enormes proporções que destruiu o porto e grande parte da cidade de Texas City, causando a morte de 581 pessoas.
Em 4 de agosto de 2020, na cidade de Beirute, capital do Líbano, uma sequência de explosões de uma carga de 2 750 toneladas do composto, que estava armazenada no porto da cidade, deixou mais de 100 mortos e 5 000 feridos e inúmeros danos materiais nas imediações atingidas, com efeitos sentidos até no Chipre, a mais de 200 km do local. Segundo captações de sensores da USGS (Instituto Americano de Geofísica) o impacto das explosões foi considerado como terremoto de magnitude 3,3 e potência de aproximadamente 1,8 quilotons de TNT.[11]
Ver também
editarReferências
- ↑ a b c d Registo de Ammoniumnitrat na Base de Dados de Substâncias GESTIS do IFA, accessado em 3 de Setembro de 2007
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
- ↑ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. [S.l.]: Butterworth–Heinemann. 362 páginas. ISBN 1903996651
- ↑ SOUZA, D. M .G.; LOBATO, E.; MIRANDA, L.N. Correção do solo e adubação da cultura da soja In: Simpósio sobre cultura da soja nos cerrados, 1, 1992, Uberaba. Anais... Piracicaba: Potafos, 1993. p. 138-158.
- ↑ IPC INCHEM, Types of hazards/ exposure acute hazards/ symptons prevention first aid/fire fighting fire. Disponível em<http://www.inchem.org/> Acesso em: 07 de dezembro de 2011.
- ↑ KIISKY. H. Properties of Ammonium Nitrate based fertilisers. Disponível em: <http://www.doria.fi/bitstream/handle/10024/47167/properti.pdf> Acesso em: 07 de dezembro de 2011.
- ↑ PORTARIA N°518/GM EM MARÇO DE 2004. Disponível em: <http://dtr2001.saude.gov.br/sas/PORTARIAS/Port2004/GM/GM-518.htm>Acesso em: 08 de dezembro de 2011.
- ↑ STRUJA D. Poluição das águas - revisão de literatura. Revista Eletrônica Lato Sensu – Ano 2, nº1, julho de 2007. ISSN 1980-6116
- ↑ Ammonium nitrate dictionary-Guidechem.com
- ↑ AFP (5 de agosto de 2020). «O que se sabe sobre as explosões em Beirute». Istoé. Consultado em 5 de agosto de 2020

