Propeen
| Propeen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van propeen
| ||||
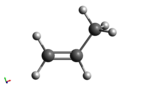
| ||||
Molecuulmodel van propeen
| ||||
| Algemeen | ||||
| Molecuulformule | C3H6 | |||
| IUPAC-naam | propeen | |||
| Andere namen | propyleen | |||
| Molmassa | 42,07974 g/mol | |||
| SMILES | C=CC
| |||
| InChI | 1S/C3H6/c1-3-2/h3H,1H2,2H3
| |||
| CAS-nummer | 115-07-1 | |||
| EG-nummer | 204-062-1 | |||
| PubChem | 8252 | |||
| Wikidata | Q151324 | |||
| Beschrijving | Kleurloos en reukloos gas | |||
| Vergelijkbaar met | Etheen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H220 - H280 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 - P410+P403 | |||
| EG-Index-nummer | 601-011-00-9 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Smeltpunt | −185,26[1] °C | |||
| Kookpunt | −47,69[1] °C | |||
| Vlampunt | −108[1] °C | |||
| Zelfontbrandings- temperatuur | 485[1] °C | |||
| Dampdruk | 1,0140 × 106[1] Pa | |||
| Oplosbaarheid in water | 384 × 10−3[1] g/L | |||
| Onoplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 0,366 D | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Propeen is een koolwaterstof, behorend tot de groep der alkenen, met als brutoformule C3H6. De stof komt voor als een kleurloos en reukloos gas.
Propeen is in zeer kleine hoeveelheden aanwezig in aardolie en wordt daarom vooral door middel van kraakprocessen geproduceerd. Na destillatie van de reactiemengsels worden hieruit diverse lagere alkenen gewonnen.
Eigenschappen en reacties
[bewerken | brontekst bewerken]Propeen komt bij kamertemperatuur voor in de gasfase en is amper oplosbaar in water. De reactiviteit van de molecule is afkomstig van de aanwezigheid van de dubbele binding, zodat reactie tot andere verbindingen vooral zal plaatsvinden via de derivatisering hiervan.
Additie van dichloor levert 1,2-dichloorpropaan:
Wanneer dezelfde reactie wordt uitgevoerd in aanwezigheid van licht en een lage concentratie aan dichloor, dan treedt een radicalaire halogenering op:
De dubbele binding blijft dus intact.
De additie van een waterstofhalogeniden levert het overeenkomstig propylhalogenide, zoals bijvoorbeeld 2-broompropaan:
De additie van water, die gekatalyseerd wordt door een niet-nucleofiel zuur (typisch zwavelzuur of fosforzuur), leidt tot vorming van 2-propanol.
Toepassingen
[bewerken | brontekst bewerken]Propeen is een eenvoudig alkeen, dat door de petrochemische industrie gewonnen wordt uit aardolie. Het is een belangrijke basisstof voor de chemische industrie. Propeen wordt onder andere gebruikt voor de productie van aceton, acroleïne, acrylzuur en butanol. De belangrijkste toepassing van propeen is echter de polymerisatie tot polypropeen. Via derivatisatie van de dubbele binding kunnen andere belangrijke polymeren, zoals polypropyleenoxide en polypropyleenglycol, gevormd worden.
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Propeen is niet toxisch, maar werkt bij hoge concentraties verstikkend. Indien het goed vermengd is met lucht, kan het een explosief mengsel vormen dat kan ontploffen door het ontstaan van een vonk.






