Sistema del complemento
Il sistema del complemento, insieme con gli anticorpi, è un elemento essenziale del sistema immunitario nei meccanismi di difesa umorale contro gli agenti infettivi. Si tratta di un sistema di mediazione umorale, costituito da circa 30 proteine circolanti nel sangue e di membrana, capaci di interagire reciprocamente e con le membrane cellulari. Nel sangue, le proteine sono presenti come molecole funzionalmente inattive; dopo l’attivazione, esse sono capaci di interagire tra loro, con gli anticorpi o con le membrane cellulari, svolgendo molteplici attività biologiche che comprendono l'uccisione delle cellule. L'attivazione "a cascata" delle sue proteine solubili, che convenzionalmente vengono chiamate componenti, è alla base di attività biologiche varie come la lisi cellulare, batterica o virale; tali componenti si introducono nelle membrane degli agenti patogeni provocando su di esse pori che portano alla lisi. Durante l'attivazione del complemento si ha inoltre il reclutamento di varie cellule immunocompetenti, come cellule fagocitarie (monociti, macrofagi, polinucleati), linfociti B e linfociti T.
Storia
[modifica | modifica wikitesto]Il termine complemento fu usato per la prima volta nel 1898 da J. Bordet che aveva notato che se incubava una miscela di batteri con siero contenente anticorpi rivolti contro i batteri stessi, questi venivano lisati (distrutti); se invece il siero veniva riscaldato a una temperatura di 56 °C la lisi non avveniva. Poiché era stato già dimostrato che gli anticorpi resistevano al riscaldamento, Bordet ipotizzò la presenza nel siero di un componente termolabile che completava l'azione degli anticorpi e che battezzò appunto complemento.
Attivazione del complemento
[modifica | modifica wikitesto]Come accade per altri sistemi operanti nell'organismo, come quello della coagulazione del sangue e quello delle chinine, l'attivazione del complemento avviene con un meccanismo detto a cascata per attivazione sequenziale dei vari componenti complementari che circolano in forma inattiva.
Esistono tre vie distinte di attivazione del complemento, la via classica, la via alternativa e la via lectinica, che partendo da momenti differenti conducono alla proteolisi del C3 con conseguente formazione di C5 convertasi. Da questo evento centrale, la attivazione delle altre componenti procede attraverso una via comune che porta alla formazione del complesso di attacco della membrana (MAC), il quale, legandosi alle membrane cellulari dei microorganismi, ne determina la lisi osmotica. Come spesso accade i nomi riflettono le tappe della scoperta, non il reale ruolo all'interno dell'organismo.
La via classica è attivata dal legame di alcune classi di anticorpi con il relativo antigene e quindi rappresenta un meccanismo dell'immunità umorale specifica. La via alternativa viene attivata direttamente da alcune proteine delle membrane cellulari dei microbi e quindi fa parte dei meccanismi della immunità innata. La via della lectina legante il mannosio utilizza il mannosio come sito di attacco alle membrane dei patogeni.
Alcune proteine presenti sulle cellule normali dell'ospite inibiscono l'attivazione del complemento e questo riduce al minimo l'effetto dannoso che il complemento potrebbe esplicare sulle cellule dell'ospite. I microorganismi invece non posseggono tali proteine, pertanto il sistema complementare può svolgere interamente la sua azione sulla loro membrana.
Via classica
[modifica | modifica wikitesto]L'attivazione della via classica dipende dalla interazione di tre proteine del complemento, C1, C4 e C2, con il complesso antigene-anticorpo. La reazione comincia con il legame del C1 alle immunoglobuline di tipo IgG1, IgG3 e IgM fissate a un antigene multivalente. Il primo componente del complemento (C1) è costituito da tre sub componenti, C1q, C1r e C1s. Il C1q (composto da sei catene disposte radialmente a ombrello) svolge un'azione di ricognizione legandosi specificamente alla regione Fc delle immunoglobuline e per attivarsi necessita del legame di due Fc contemporaneamente. Per questo motivo le IgM, che sono pentameriche (5 sub unità e quindi 5 Fc), sono più efficaci delle IgG (che sono monomeriche) nell'attivazione del complemento dal momento che richiedono una minor concentrazione per avere 2 Fc sufficientemente vicine per interagire con un singolo C1q. Il C1r e il C1s (che sono presenti a coppie organizzate in un tetramero C1r2-C1s2) svolgono invece un'azione enzimatica (serina-esterasica): il legame di due o più catene di C1q alle immunoglobuline attiva il C1r che a sua volta attiva il C1s. Il C1s scinde enzimaticamente la seconda componente della cascata complementare il C4 in due frazioni: il C4a che rimane in circolo nel plasma e il C4b che si lega covalentemente alla membrana garantendo che l'attivazione prosegua solo in presenza di antigeni o con l'immunocomplesso. C4b, a sua volta, attiva il C2 in due frazioni: la C2a e la C2b. La C2a così prodotta si lega al precedente, dando luogo al complesso C4b2a. Il C2 è l'unico componente del complemento con la nomenclatura dei frammenti invertita (negli anni '90 venne proposto di cambiare la nomenclatura a C4b2b): C2b va in circolo, mentre C2a rimane attaccata alla C4b e manca di attività biologiche. Il complesso C4b2a costituisce l'enzima chiamato C3 convertasi della via classica, capace di legarsi al C3 e di scinderlo. Il C3 viene scisso in C3a (un'anafilotossina che va in circolo) e in C3b capace di legarsi sia alla membrana batterica con finalità opsonizzanti, sia al complesso C4b2a stesso andando a costituire la C5 convertasi della via classica.
C5 viene clivato per formare C5a e C5b. C5a viene rilasciato in circolo, mentre C5b lega i complementi C6 e C7, formando il complesso C5b,6,7 che, mediante C7, si lega sulla membrana del patogeno. Successivamente giungono la molecola C8, che si lega al complesso e si inserisce nella membrana cellulare, e le molecole C9, che legano il complesso polimerizzandolo. Si legano dalle 10 alle 16 molecole di C9 per formare un poro sulla membrana. Quest'ultimo complesso è chiamato "complesso di attacco alla membrana".
Via lectinica
[modifica | modifica wikitesto]La via lectinica, molto simile alla via classica, viene attivata con il legame tra polisaccaridi presenti sui microbi e lectine o ficoline in circolo. La lectina legante il mannosio, (Mannose Binding Lectin, MBL), la H-ficolina e L-ficolina hanno omologie strutturali con la subunità C1q: presentano delle "teste" che legano specificamente residui di mannosio, di fucosio o di N-acetilglucosammina. Questi tipi di zuccheri, legati a proteine o lipidi, sono presenti solo sulle superfici cellulari di patogeni, ma non sulla superficie cellulare dei vertebrati (che contengono altri tipi di zuccheri, come l'acido sialico) permettendo, quindi, di discriminare il tipo di membrana di attacco e di innescare l'attivazione del complemento esclusivamente sulla superficie del patogeno. L'interazione con i polisaccaridi permette poi il legame con serine proteasi associate a MBL (MBL-Associated Serine Protease, MASP) comprendenti MASP-1, MASP-2 e MASP-3. MASP-1 (o MASP-3) e MASP-2 sono strettamente omologhi a C1r e C1s e una volta legato MBL (o le ficoline) vanno a formare tetrameri e a clivare C4 e C2 ricongiungendosi con le altre tappe della via classica.
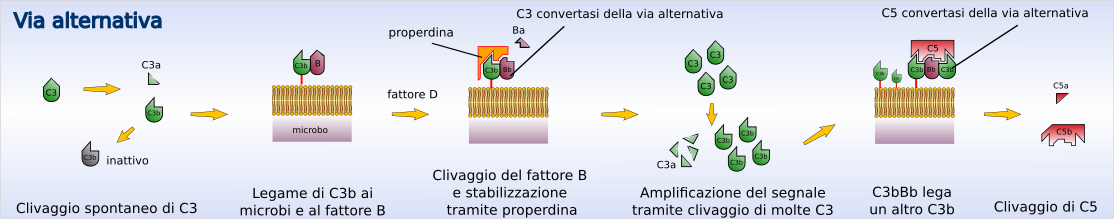
Via alternativa
[modifica | modifica wikitesto]L'attivazione della via alternativa porta alla formazione di C3 proteasi e quindi alla scissione del C3 senza il contributo di anticorpi. In condizioni normali si verifica continuamente la scissione del C3 circolante a un ritmo lentissimo (nota col termine tickover) con formazione di piccolissime quantità di C3b (che presenta omologie strutturali con C4b). Questo se rimane in circolo viene inattivato rapidamente; se invece si lega alle superfici di cellule, per esempio batteriche, esso può associarsi a una proteina plasmatica chiamata fattore B. Appena legatosi al C3b il fattore B perde un piccolo frammento (frammento Ba) a opera di una proteasi chiamata fattore D. Il frammento residuo, Bb, rimane legato al C3b costituendo il complesso C3b-Bb che rappresenta la C3 convertasi della via alternativa. Questa via è chiamata anche "via della properdina". La properdina (o fattore P) è una proteina plasmatica che, per la sua affinità con queste molecole, lega il complesso C3b-Bb, stabilizzando la C3 convertasi ed aumentandone l'emivita da 4 a 40 minuti.[1] Al posto della properdina, può anche legarsi un'altra subunità C3b, formando il complesso C3bBbC3b detto anche C5 convertasi della via alternativa. La C3 convertasi è capace di scindere grandi quantità di C3 con rapida amplificazione del processo ma solo se il complesso C3bBb viene a formarsi su membrane batteriche e non quelle delle cellule di mammiferi, in quanto queste ultime posseggono delle proteine che degradano la C3 convertasi arrestando la cascata.
Dettagli molecolari del C3
[modifica | modifica wikitesto]
Il C3 è un fattore del complemento presente nel plasma sanguigno a elevate concentrazioni, costituito da due catene, β (residui 1-645) e α (residui 650-1641), che insieme formano 13 domini, di cui 6 (MG1, MG2, MG3, MG4, MG5, LNK) appartenenti alla catena β e altri 6 (ANA, MG7, CUB, TED, MG8, C345C) appartenenti alla catena α, mentre un solo dominio (MG6) è formato per metà dalla catena α (MG6α) e per la restante dalla catena β (MG6β)[2].
Di questi 13 domini, 8 (5.5 della catena β e 2.5 della α) mostrano un avvolgimento simile al modulo strutturale fibronectina di tipo 3 (che deriva dal modulo strutturale tipo immunoglobulina), per quanto nessuna omologia di sequenza è evidente tra questi domini. In analogia quindi ai domini dell'immunoglobulina, ci si riferisce a questi 8 domini del C3 con la sigla MG (macroglobulin domains: MG1−MG8)[2].
Il C3 ha la caratteristica di possedere un legame tioesterico (Cys 988-Gln 991) altamente reattivo, perché instabile in ambiente acquoso, e il meccanismo della sua formazione, con conseguente rilascio di ammoniaca, è stato oggetto di molte pubblicazioni[3], ma alcuni risultati suggeriscono che i residui Cys 988 e Gln 991, durante o a seguito della sintesi della proteina, siano in grado di reagire spontaneamente, portando al tioestere necessario per l'attività biologica della proteina C3: indubbiamente, la formazione di questo legame comporta la partecipazione di strutture adiacenti che formano un sito attivo che promuove la reazione tra Cys 988 e Gln 991, e l'avvolgimento del C3 è in grado di fornire sia l'energia sia l'ambiente necessario affinché la reazione tra questi due residui possa avvenire[3].
Nella forma non clivata del C3 (C3 nativo), questo gruppo tioesterico è schermato dall'acqua grazie a una tasca idrofobica costituita dai residui Met 1378, Tyr 1425 e Tyr 1460 del dominio MG8 (residui 1331-1474 sulla catena α del C3) e Phe 1047 del dominio TED (thioester-containing domain, o dominio tioesterico: residui 963-1268 sulla catena α del C3)[2], il che rende il tioestere estremamente stabile all'idrolisi a pH 7.4 (t1/2 > 6 giorni)[4] o all'attacco di altri piccoli nucleofili. Sebbene completamente sepolti, il tioestere e la tasca protettiva sono posizionati all'interfaccia TED-MG8 vicino alla superficie della proteina[2]; l'instabilità del tioestere causa una lenta ma costante lisi spontanea di C3, che però non porta sempre all'attivazione del complemento poiché il C3b generato può anche disattivarsi direttamente nella fase acquosa del sangue oppure può essere inattivato dalla presenza di proteine regolatrici dell'attivazione del complemento, presenti costitutivamente sulle membrane delle cellule dei mammiferi, ma assenti in quelle dei microrganismi (vedi oltre).

A seguito del clivaggio operato dall'enzima C3-convertasi, il gruppo tioesterico viene esposto e quindi destabilizzato dall'ambiente acquoso circostante, cosicché il risultante frammento C3b (opsonina) può essere ad esempio idrolizzato (inattivato) nel sangue oppure è in grado di reagire con gruppi amminici o idrossilici di proteine o polisaccaridi presenti su tutte le superfici cellulari (in particolare, le membrane dei batteri), generando legami covalenti rispettivamente ammidici o esterei (opsonizzazione), che facilitano la fagocitosi operata da cellule dell'immunità aspecifica del Sistema Immunitario, come macrofagi e neutrofili che esprimono recettori CR (complement receptors)[5] specifici per il C3b sulla loro superficie.
Attivazione del complesso litico
[modifica | modifica wikitesto]
Come illustrato, le tre vie di attivazione del complemento, la classica, l'alternativa e la lectinica, portano alla costituzione di due complessi diversi, il C4b2a e il C3bBb, ma con un'identica funzione: quella di scindere il C3 in due frammenti, C3a e C3b, e di legarsi al C3b costituendo le C5 convertasi. Le C5 convertasi originate innescano l'attivazione delle componenti finali del sistema del complemento che conducono alla formazione del MAC (Membrane Attack Complex) e alla distruzione della cellula.
Le C5 convertasi clivano (scindono) il C5 in due frammenti: C5a che rimane in soluzione espletando importanti funzioni, e il C5b che si lega alle altre proteine del complemento già presenti sulla membrana. In questo contesto C5b mantiene una conformazione temporanea che permette di legare le due altre proteine del complemento C6 e C7 formando il complesso C5b,6,7. Una volta legata, C7 (che è idrofoba) si inserisce nel doppio strato lipidico della membrana microbica dove diventa un recettore per C8 (la componente successiva). Una volta legata, anche C8 (con una sua parte) si inserisce nella membrana andando a definire il complesso C5b,6,7,8 (o C5b-8). L'ultima tappa per la formazione di un MAC attivo è il legame con C9 che in associazione al complesso C5b-8 polimerizza e forma un poro nella membrana batterica in modo simile alla perforina rilasciata dai linfociti T citotossici e NK. Attraverso i pori prodotti dalla polimerizzazione del C9, l'acqua e gli ioni hanno libero accesso all'interno della cellula determinandone dapprima il rigonfiamento osmotico e poi lo scoppio della stessa.
Regolazione
[modifica | modifica wikitesto]Per impedire che il sistema del complemento prenda il sopravvento, specialmente attivandosi su cellule dell'organismo, sono presenti una serie di proteine circolanti della famiglia dei regolatori dell'attività del complemento, RCA (Regulators of Complement Activity).
- C1 INH (C1 Inhibitor): è una proteina plasmatica che può essere clivata dal complesso C1r2-C1s2 e legarvisi subito bloccando quindi le tappe successive. Funge da inibitore competitivo.
- inibitori dell'assemblaggio delle C3 e C5 convertasi: queste proteine si legano a C3b o C4b bloccando il legame con altri componenti della convertasi (Bb e C2a rispettivamente). Sono presenti costitutivamente sulle membrane delle cellule di mammifero, ma assenti in quelle dei microrganismi. Esempi sono: CR1, DAF (Decay-Accelerating Factor, o CD55), C4BP (C4 Binding Protein), MCP (Membrane Cofactor Protein, o CD46) e il cosiddetto fattore H. Quest'ultimo agisce grazie alla presenza di acido sialico sulla membrana delle cellule dell'organismo che favorisce il legame del fattore H al C3b piuttosto che del fattore B.
- Fattore I: è una proteina serin proteasica capace di degradare il frammento C3b, ma solo in presenza delle proteine sopra descritte. L'azione del fattore I provoca la formazione dei frammenti iC3b, C3d e C3dg inattivi che rimangono sulla superficie e possono essere riconosciuti da fagociti e linfociti B.
- inibitori della formazione di MAC: importanti per impedire che la formazione di MAC possa spostarsi nelle cellule adiacenti a quella direttamente interessata. Ne sono esempi CD59 che impedisce il legame della frazione C9 e della proteine S che lega il complesso C5b,6,7 inibendone l'inserimento nelle membrane.
Conseguenze biologiche dell'attivazione del complemento
[modifica | modifica wikitesto]L'attivazione del complemento genera la formazione di un gran numero di prodotti dotati di attività biologiche diverse: alcuni si depositano sulla superficie delle particelle attivatrici, provocandone la lisi (complesso MAC) oppure la fagocitosi (C3b). Altri come il C3a e il C5a provocano una reazione infiammatoria locale. Mediante queste attività il complemento svolge un ruolo importantissimo nel sistema umorale di difesa contro le aggressioni esterne.
Opsonizzazione, fagocitosi e lisi
[modifica | modifica wikitesto]I frammenti C3b o C5b, derivanti dall'attivazione della via classica o della via alternativa del complemento, rivestono il microrganismo che ne ha provocato l'attivazione e legandosi ai relativi recettori specifici espressi sui neutrofili e sui macrofagi ne attivano la fagocitosi, cioè l'inglobamento del microrganismo all'interno di queste cellule. In genere il solo legame con le proteine del complemento non basta a indurre la fagocitosi, che viene efficientemente attivata dal legame di immunoglobuline (anticorpi).
Il complesso di attacco delle membrane (MAC) è responsabile della lisi osmotica delle cellule estranee permettendo al complemento anche un'azione diretta sui microrganismi oltre che sostegno ad altre specie cellulari.
Induzione della risposta infiammatoria
[modifica | modifica wikitesto]La proteolisi dei componenti C3, C4 e C5 genera i relativi frammenti b che si assemblano tra loro nelle varie fasi di attivazione del complemento e i frammenti C3a, C4a e C5a, detti anafilotossine. Queste inducono l'infiammazione fissandosi ai relativi recettori di membrana presenti su mastociti, granulociti (neutrofili, basofili, eosinofili), monociti e sulle cellule endoteliali. In tutto questo il più potente risulta essere C5a, con un potere di 20 e 2.500 volte maggiore di C3a e C4a. Le principali azioni che ne derivano sono le seguenti:
- degranulazione dei mastociti con liberazione di mediatori vasoattivi.
- aumento della permeabilità vascolare per azione diretta sulle cellule endoteliali.
- aumento dell'espressione di P-selectina sull'endotelio per facilitare la chemiotassi dei neutrofili e adesione degli stessi alle cellule endoteliali.
Oltre a ciò, vi sono alcuni componenti (in primo luogo C3b e C5a) che stimolano l'attivazione e l'agganciarsi all'endotelio delle cellule ad azione fagocitaria e delle natural killer.
Si può dunque riassumere il paragrafo dicendo che il sistema del complemento comporta un'amplificazione ed un potenziamento della risposta immunitaria innata.
Eliminazione degli immunocomplessi antigene-anticorpo dati dall'ipersensibilità di tipo III
[modifica | modifica wikitesto]In seguito alla risposta immunitaria rivolta verso un determinato antigene solubile, l'individuo reagisce con la formazione di anticorpi; questi si legano all'antigene relativo con formazione di immunocomplessi circolanti (complessi antigene-anticorpo). Se di dimensioni idonee e in quantità sufficiente gli immunocomplessi possono depositarsi sulle pareti vasali promuovendo una reazione infiammatoria dannosa all'organismo. Il complemento legandosi a tali complessi ne promuove la solubilizzazione e la rimozione da parte delle cellule fagocitiche.
A livello sistemico una malattia causata da un accumulo di immuno-complessi è il lupus eritematoso sistemico la quale il deposito di essi avviene in tutto l'organismo provocando una flogosi cronica sistemica
Attivazione dei linfociti B
[modifica | modifica wikitesto]Una proteina prodotta nella scissione del C3, chiamata C3d, interagisce con il rispettivo recettore CR2 (CD21) espresso sulla membrana dei linfociti B, innescando l'inizio della risposta umorale, cioè della produzione di anticorpi.
Patologie
[modifica | modifica wikitesto]Quasi tutte le patologie correlate a difetti del complemento sono dovute a deficit genetici per le proteine interessate. Sono stati descritti deficit per tutti i componenti del sistema (anche regolatori), seppure alcuni molto rari:
- C2 e C4: è il più diffuso e il 50% degli interessati sviluppa lupus eritematoso sistemico senza avere un aumento di suscettibilità alle infezioni.
- C3: si accompagna a gravi e ricorrenti infezioni spesso fatali.
- C5, C6, C7, C8 e C9: porta alla mancanza di lisi mediata del complemento particolarmente importante per difendersi da infezioni di Neisseria meningitidis e Neisseria gonorrhoeae.
- C1 INH: provoca un incontrollato clivaggio di C2 e C4 che porta all'edema angioneurotico ereditario.
L'emoglobinuria parossistica notturna è l'unica sindrome non ereditaria causata da una mutazione di DAF e CD59 che avviene durante l'ematopoiesi.
Utilizzo in diagnostica
[modifica | modifica wikitesto]Il test di fissazione del complemento è una metodologia di diagnosi indiretta per le malattie infettive cioè volta alla ricerca di anticorpi contro un determinato antigene. Esso è ad esempio una delle prove ufficiali per la diagnosi di brucellosi.
Occorre preventivamente eliminare le proteine del complemento già presenti naturalmente nel siero che si vuole saggiare mettendo il pozzetto con il siero in un bagnomaria a 56 °C per 30 minuti. Vengono poi aggiunti l'antigene e il complemento e s'incuba per una notte a 4 °C. Vengono poi aggiunti globuli rossi di montone unitamente ad anticorpi anti - globuli rossi di montone e si lascia incubare per 30 minuti.
Se non vi erano gli anticorpi che si ricercavano, il complemento è stato utilizzato da quelli anti globuli rossi che di conseguenza sono stati lisati colorando il pozzetto di rosa (test negativo), se invece vi erano avevano utilizzato il complemento a scapito di quelli anti globuli rossi che rimangono interi e ben visibili come una chiazza rossa sul fondo del pozzetto (test positivo)
Se vengono effettuate diluizioni seriali in vari pozzetti, si può anche utilizzare per titolare la concentrazione di anticorpi
Note
[modifica | modifica wikitesto]- ^ Biologia del sistema immunitario: il sistema del complemento in www.msd-italia.it.
- ^ a b c d Bert J. C. Janssen, Eric G. Huizinga, Hans C. A. Raaijmakers, Anja Roos, Mohamed R. Daha, Kristina Nilsson-Ekdahl, Bo Nilsson & Piet Gros, Structures of complement component C3 provide insights into the function and evolution of immunity, in Nature, vol. 437, n. 7059, pp. 505-511.
- ^ a b M. K. Pangburn, Spontaneous reformation of the intramolecular thioester in complement protein C3 and low temperature capture of a conformational intermediate capable of reformation., in The Journal of Biological Chemistry, vol. 267, n. 12, 1992, pp. 8584-8590.
- ^ M. K. Pangburn, R. D. Schreiber, H. J. Müller-Eberhard, Formation of the initial C3 convertase of the alternative complement pathway. Acquisition of C3b-like activities by spontaneous hydrolysis of the putative thioester in native C3., in The Journal of Experimental Medicine, vol. 154, n. 3, 1981, pp. 856-867.
- ^ Dizionario di Medicina e Biologia Zanichelli Pro, Recettore per il complemento, su medicina.zanichellipro.it, Zanichelli Editore spa (archiviato dall'url originale il 13 settembre 2014).
Bibliografia
[modifica | modifica wikitesto]- Abul K. Abbas, Andrew H. Lichtman, Jordan S. Pober. Immunologia cellulare e molecolare. Padova, Piccin, 2002. ISBN 88-299-1622-6
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai. Immunologia cellulare e molecolare. Elsevier, 2012
- Abul K. Abbas, Andrew H. Lichtman. Fondamenti di Immunologia. Funzioni e alterazioni del sistema immunitario. Padova, Piccin, 2002.
- Jean-François Bach, Philippe Lesavre. Immunologie. Paris, Flammarion Médecine Sciences, 1981.
- Giuseppe Tridente. Immunologia e immunopatologia. Roma, Il pensiero scientifico, 1981.
- Lorenzo Bonomo. Immunologia clinica. Torino, UTET, 1992. ISBN 88-02-04544-5.
Voci correlate
[modifica | modifica wikitesto]Collegamenti esterni
[modifica | modifica wikitesto]- (EN) complement, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Biologia del sistema immunitario: il sistema del complemento in www.msd-italia.it
| Controllo di autorità | Thesaurus BNCF 53441 · LCCN (EN) sh85029354 · GND (DE) 4120589-3 · BNF (FR) cb119580971 (data) · J9U (EN, HE) 987007545783605171 · NDL (EN, JA) 00563548 |
|---|