Legame covalente

In chimica, un legame covalente è un legame chimico in cui due atomi mettono in comune delle coppie di elettroni.
Ciò avviene perché gli atomi tendono al minor dispendio energetico possibile ottenibile con la stabilità della loro configurazione elettronica (ad esempio l'ottetto). Gli orbitali atomici contenenti gli elettroni spaiati si sovrappongono in orbitali molecolari, dando luogo ad una molecola .
Tipologia di legami covalenti
[modifica | modifica wikitesto]Legame covalente puro
[modifica | modifica wikitesto]Il legame covalente è il risultato di un'interazione elettrostatica che coinvolge gli atomi. Questa interazione elettrostatica si ha tra i nuclei degli atomi (carichi positivamente) e gli elettroni condivisi (carichi negativamente).
Gli elettroni condivisi tramite il legame covalente sono delocalizzati intorno ai due atomi, formando una cosiddetta "nube elettronica", cioè uno spazio in cui esiste la possibilità di trovare gli elettroni condivisi. Si parla di legame covalente puro se avviene tra atomi uguali. Se avviene tra atomi con differenza di elettronegatività compreso tra zero e 0,4 è detto covalente omopolare o apolare. La nube elettronica è distribuita simmetricamente (cioè il legame risulta non polarizzato). In questo caso il doppietto elettronico è condiviso in egual misura tra i due atomi coinvolti, cioè gli elettroni condivisi trascorrono lo stesso tempo in prossimità di ciascuno dei due atomi, non avendo una particolare preferenza per uno dei due atomi.

Un legame covalente omopolare si ha quando la differenza di elettronegatività tra due atomi è minore o uguale a 0,4.
Un esempio di molecola contenente un legame covalente puro è la molecola di idrogeno , ottenuta dalla combinazione di due atomi di idrogeno:
H· + ·H → H:H
In generale, si ha legame covalente puro quando gli atomi coinvolti nel legame appartengono allo stesso elemento chimico. In questo caso infatti la differenza di elettronegatività tra i due atomi è nulla.
Legame covalente polare
[modifica | modifica wikitesto]Nel caso in cui si abbia una moderata differenza di elettronegatività tra i due atomi coinvolti nel legame covalente (per cui si è in presenza di un dipolo molecolare permanente), gli elettroni condivisi risultano maggiormente attratti dall'atomo più elettronegativo, il legame risulterà quindi polarizzato elettricamente
Si parla in questo caso di legame covalente eteropolare (o polare).
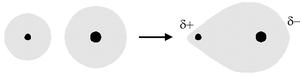
Un legame covalente polare si instaura quando avviene una sovrapposizione degli orbitali atomici di due atomi con una differenza di elettronegatività minore o uguale a 1,7[1] e maggiore di 0,4.
Ad esempio la differenza di elettronegatività tra l'idrogeno (2,20) e il cloro (3,16) è pari a 0.96 (= 3,16 - 2,20), per cui il legame tra idrogeno e cloro nella molecola di acido cloridrico è di tipo covalente eteropolare.
Va ricordato che le molecole che si formano a seguito di un legame covalente polare sono polari ma non necessariamente polarizzabili. La polarizzabilitá di una molecola dipende infatti dalla simmetria dei baricentri di carica (che ne influenza il comportamento se viene applicato un campo elettrico esterno). Molecole come la sono polari ma non polarizzate a causa di una forte simmetria di questi baricentri. La teoria V.S.E.P.R consente di localizzare particolari geometrie che garantiscono o meno polarizzabilitá.
Legame di coordinazione o dativo
[modifica | modifica wikitesto]Quando entrambi gli elettroni coinvolti nel legame provengono da uno solo dei due atomi, mentre l'altro fornisce un orbitale vuoto in cui allocarli, si parla di legame di coordinazione.
Legame covalente e legame ionico
[modifica | modifica wikitesto]Quando i doppietti elettronici sono fortemente vincolati all'elemento più elettronegativo, non si parla più di legame covalente, bensì di legame ionico; per convenzione, si parla di legame ionico se la differenza di elettronegatività tra gli atomi coinvolti nel legame è maggiore di 1,9, mentre si parla di legame covalente quando la differenza di elettronegatività tra gli atomi coinvolti nel legame è minore o uguale a 1,9.
Di conseguenza, il legame ionico si può considerare un caso estremo di legame covalente polare. Il passaggio da legame covalente a legame ionico è quindi graduale.[2]
Valenza dei legami covalenti
[modifica | modifica wikitesto]A seconda del numero di elettroni condivisi, si possono avere i seguenti casi:
- legame covalente singolo (o legame monovalente o legame semplice): viene condivisa una sola coppia di elettroni; nelle formule chimiche tale legame si rappresenta con un singolo trattino () posizionato tra i due atomi coinvolti nel legame (ad esempio: );
- legame covalente doppio (o legame bivalente): vengono condivise due coppie di elettroni; nelle formule chimiche tale legame si rappresenta con un doppio trattino () posizionato tra i due atomi coinvolti nel legame (ad esempio: );
- legame covalente triplo (o legame trivalente): vengono condivise tre coppie di elettroni; nelle formule chimiche tale legame si rappresenta con un triplo trattino () posizionato tra i due atomi coinvolti nel legame (ad esempio: ).
Esistono anche legami tetravalenti (ampiamente studiati in chimica inorganica) e nel 2005 è stata dimostrata l'esistenza di legami quintupli in molecole stabili.[3]
Legami covalenti polari e polarità della molecola
[modifica | modifica wikitesto]Le molecole che contengono legami covalenti polari possono presentare una certa polarità causata da una distribuzione non simmetrica delle cariche.
Ad esempio, la molecola dell'acqua presenta due legami covalenti polari tra l'ossigeno e ognuno dei due atomi di idrogeno. L'elettronegatività dell'ossigeno (3,52 circa) prevale su quella dell'idrogeno (2,11 circa), attirando verso di sé gli elettroni dei due atomi di idrogeno e polarizzando ciascun legame. La molecola dell'acqua presenta un angolo di legame di 104°45' e costituisce nel suo complesso un dipolo elettrico che ha nell'atomo di ossigeno la sua estremità negativa e nei due atomi di idrogeno la sua estremità positiva.
Più semplice è il caso della molecola dell'acido cloridrico : in questo caso la maggiore elettronegatività del cloro fa sì che la molecola sia un dipolo che ha nell'atomo di cloro la sua estremità negativa e nell'atomo di idrogeno la sua estremità positiva.
In altri casi, ai legami covalenti polari può essere associata una distribuzione simmetrica delle cariche, per cui la molecola risulta apolare.
Ad esempio, gli atomi della molecola del diossido di carbonio sono disposti lungo una retta . Pur essendo ogni doppio legame polare, la simmetria della molecola annulla le due polarità uguali in intensità ma opposte in direzione. Quindi la molecola di diossido di carbonio risulta complessivamente apolare.
Legame covalente ad un solo elettrone
[modifica | modifica wikitesto]Nel 2024 un team di ricercatori dell'Università di Tokyo ha ottenuto un idrocarburo con un legame covalente ad un solo elettrone, la cui esistenza era già stata ipotizzata da Linus Pauling.[4]
Prima di allora erano noti soltanto legami covalenti fra un numero pari di elettroni.
Note
[modifica | modifica wikitesto]- ^ Depaoli, Chimica generale e inorganica, p.84
- ^ Giuseppe Valitutti, Patrizia Amadio e Marco Falasca, 11, in Chimica concetti e modelli. Dalla struttura atomica all'elettrochimica, 3ª ed., Zanichelli, p. 257.
- ^ Synthesis of a Stable Compound with Fivefold Bonding Between Two Chromium(I) Centers Tailuan Nguyen, Andrew D. Sutton, Marcin Brynda, James C. Fettinger, Gary J. Long, and Philip P. Power Pubblicato online il 22 settembre 2005; 10.1126/Science.1116789 Support info Archiviato il 1º ottobre 2007 in Internet Archive.
- ^ Un solo elettrone, un legame unico: ecco la scoperta del secolo, su Everyeye Tech, 26 settembre 2024. URL consultato il 28 settembre 2024.
Bibliografia
[modifica | modifica wikitesto]- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 6-7, ISBN 88-08-09414-6.
- Alberto Costanzo, Esercitazioni di chimica. Compendio teorico ed esercizi di chimica per ingegneria, 2ª ed., Esculapio, 2010, ISBN 978-88-7488-377-6.
Voci correlate
[modifica | modifica wikitesto]- Legame chimico
- Legame σ
- Legame π
- Legame δ
- Legame di coordinazione
- Legame ionico
- Polarità delle molecole
- Risonanza (chimica)
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «legame covalente»
Wikizionario contiene il lemma di dizionario «legame covalente» Wikimedia Commons contiene immagini o altri file sul legame covalente
Wikimedia Commons contiene immagini o altri file sul legame covalente
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) covalent bond, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) IUPAC Gold Book, "covalent bond", su goldbook.iupac.org.












