Sesium aurida
| |
| |
 Larutan CsAu (kiri), CsAu murni (kanan)
| |
| Nama | |
|---|---|
| Nama IUPAC
Sesium aurida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| |
| |
| Sifat | |
| AuCs | |
| Massa molar | 329,87 g·mol−1 |
| Penampilan | Kristal kuning |
| Titik lebur | 580 °C (1.076 °F; 853 K)[1] |
| bereaksi keras | |
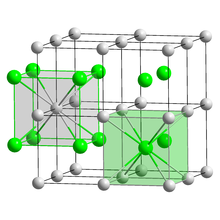
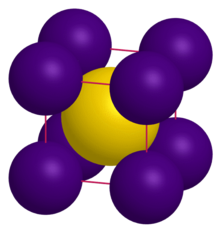
| Struktur | |
| CsCl | |
a = 4,24 Å[1]
| |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Sesium aurida adalah sebuah senyawa anorganik dengan rumus CsAu. Ia adalah garam Cs+ dari anion Au− yang tidak biasa.[2]
Pembuatan dan reaksi
[sunting | sunting sumber]CsAu diperoleh dengan memanaskan campuran stoikiometri sesium dan emas. Dua cairan kuning metalik bereaksi menghasilkan produk kuning transparan.[3] Meskipun merupakan senyawa dari dua logam, CsAu tidak memiliki sifat logam karena merupakan garam dengan muatan lokal; ia malah berperilaku sebagai semikonduktor dengan celah pita sebesar 2,6 eV.[4]
Senyawa ini mudah terhidrolisis, menghasilkan sesium hidroksida, emas metalik, dan hidrogen.[3]
- 2 CsAu + 2 H2O → 2 CsOH + 2 Au + H2
Larutan senyawa ini berwarna cokelat dalam amonia cair, dan aduk amonia CsAu · NH
3 berwarna biru; yang terakhir memiliki molekul amonia yang diselingi antara lapisan kristal CsAu yang sejajar dengan bidang (110). Larutan mengalami metatesis dengan resin penukar ion bermuatan tetrametilamonium untuk menghasilkan tetrametilamonium aurida.[3]
Referensi
[sunting | sunting sumber]- ^ a b Kienast, Gerhard; Verma, Jitendra; Klemm, Wilhelm (Juni 1961). "Das Verhalten der Alkalimetalle zu Kupfer, Silber und Gold". Zeitschrift für anorganische und allgemeine Chemie (dalam bahasa German). 310 (3): 143–169. doi:10.1002/zaac.19613100304.
- ^ Peer, William J.; Lagowski, J. J. (1978). "Metal-Ammonia Solutions. 11. Au−, a Solvated Transition Metal Anion". J. Am. Chem. Soc. 100: 6260–6261. doi:10.1021/ja00487a064.
- ^ a b c Jansen, Martin (30 November 2005). "Effects of relativistic motion of electrons on the chemistry of gold and platinum". Solid State Sciences. 7 (12): 1464–1474. Bibcode:2005SSSci...7.1464J. doi:10.1016/j.solidstatesciences.2005.06.015
 .
.
- ^ Norrby, Lars J. (February 1991). "Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks?". Journal of Chemical Education. 68 (2): 110. Bibcode:1991JChEd..68..110N. doi:10.1021/ED068P110.
Bacaan lebih lanjut
[sunting | sunting sumber]- Jansen, Martin (2008). "The chemistry of gold as an anion". Chemical Society Reviews. 37 (9): 1826–1835. doi:10.1039/B708844M. PMID 18762832.—memasukkan foto dari senyawa ini.

