Nitrogén
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Általános | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Név, vegyjel, rendszám | nitrogén, N, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Latin megnevezés | nitrogenium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemi sorozat | nemfémek | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Csoport, periódus, mező | 15, 2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | színtelen 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtömeg | 14,00643–14,00728 g/mol[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronszerkezet | [He] 2s2 2p3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronok héjanként | 2, 5
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Halmazállapot | gáz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sűrűség | (0 °C, 101,325 kPa) 1,2506 g/l | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hármaspont | 63,18 K, 12 600 Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáspont | 63,14 K (-210 °C, - °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forráspont | 77,35 K (-195,8 °C, - °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáshő | (N2) 0,3604 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Párolgáshő | (N2) 2,7928 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris hőkapacitás | (25 °C) (N2) 29,124 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomi tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristályszerkezet | hexagonális  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidációs szám | ±3, 5, 4, 2 (erős sav) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitás | 3,04 (Pauling-skála) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizációs energia | 1.: 1402,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.: 2856 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.: 4578 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár | - pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár (számított) | - pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalens sugár | 71±1 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals-sugár | 155 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egyebek | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mágnesség | diamágneses | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hővezetési tényező | (300 K) 25,98 mW/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hangsebesség | (gáz, 27 °C) 334 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-szám | 7727-37-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fontosabb izotópok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hivatkozások | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A nitrogén a periódusos rendszer V.A csoportjába tartozó nemfémes elemek egyike. Rendszáma 7, vegyjele N. Vegyértékelektron-szerkezete 2s22p3. A nitrogén elemi állapotban színtelen, szagtalan, íztelen, kevéssé reakcióképes kétatomos gáz. A Föld légkörének 78,09 térfogatszázalékát alkotja. A nitrogént 1772-ben fedezte fel Daniel Rutherford skót orvos, mikor rájött, hogy a levegőből elkülöníthető.
A nitrogén az univerzumban gyakran előforduló elem, becslések szerint a galaxisunkban és a Naprendszerben a hetedik leggyakoribb elem. A szupernóvákban szén és hidrogén fúziójával szintetizálódik. Az elemi nitrogén, illetve a hidrogénnel és oxigénnel alkotott vegyületei illékonyságuk miatt sokkal kevésbé gyakoriak a Naprendszer belső kőzetbolygóin; egészében véve a nitrogén viszonylag ritka elem a Föld kérgében. Azonban – mint a Földön – a nitrogén és vegyületei gázhalmazállapotban gyakran előfordulnak a légkörrel rendelkező bolygók és holdak atmoszférájában.
Számos iparilag fontos vegyület, mint például az ammónia, a salétromsav, a szerves nitrátok (hajtógázok és robbanóanyagok), és a cianidok is tartalmaznak nitrogént. Az elemi nitrogénben lévő rendkívül erős kötés meghatározó jelleggel bír; nehézséget okoz az organizmusoknak és az iparnak egyaránt, hogy a N2 gázt hasznos vegyületekké alakítsa, ugyanakkor gyakran hasznos, nagy mennyiségű energia szabadul fel, amikor ezek a vegyületek elégnek, felrobbannak, vagy nitrogéngázra bomlanak vissza. A szintetikusan előállított ammónia és nitrátok kulcsfontosságú ipari műtrágyák; azonban ezek egyben a legfőbb szennyező anyagok is, melyek a vizek eutrofizációját okozzák.
A legfőbb felhasználási területeken kívül a nitrogénvegyületek sokoldalú szerves anyagok. A nitrogén alkotóeleme olyan változatos anyagoknak, mint a kevlár szövet és cianoakrilát ragasztó. A nitrogén összetevője minden nagyobb farmakológiai gyógyszer osztály – beleértve az antibiotikumok – molekuláinak is. Számos készítmény elő-gyógyszere, vagy imitációja a természetes nitrogéntartalmú jelző molekuláknak: például a szerves nitrátok közé tartozó nitroglicerin és a nitroprusszid képes a vérnyomás kontrollálására, mert azok metabolitja a természetes nitrogén-monoxid. A növényi alkaloidok (gyakran a növény védelmére szolgáló vegyületek) is tartalmaznak nitrogént, így sok jelentős nitrogéntartalmú gyógyszer – mint például a koffein és a morfin – hatással van az állati neurotranszmitterek receptoraira.
Nitrogén előfordul minden élő szervezetben, elsősorban az aminosavakban (és így fehérjékben), valamint a nukleinsavakban (DNS és RNS). Az emberi test mintegy 3 tömegszázalék nitrogént tartalmaz, ezzel az oxigén, a szén és a hidrogén után a negyedik leggyakoribb elem az emberi testben. Az elem mozgását a levegőből a bioszférába és a szerves vegyületekbe, majd onnan vissza a légkörbe a nitrogénciklus írja le.
Története és etimológiája
[szerkesztés]
Régi magyar neve: légeny[2] vagy azót.[3]
A nitrogént hivatalosan Daniel Rutherford skót orvos fedezte fel 1772-ben, aki „kártékony levegőnek” (noxious air) vagy „rögzített levegőnek” (fixed air) nevezte azt.[4][5] Rutherford számára ismert volt az a tény, hogy a levegő olyan összetevője, amely nem táplálja az égést. Körülbelül ugyanabban az időben Carl Wilhelm Scheele, Henry Cavendish, és Joseph Priestley is vizsgálta nitrogént; ők „megégett levegőként” vagy „flogisztikálódott levegőként” utaltak rá. A nitrogéngáz eléggé közömbös volt, belélegezvén az állatok elpusztultak, és a tűz kialudt benne; így Antoine Lavoisier úgy hivatkozott rá, mint „fojtó levegő” illetve „azote”; a görög ἄζωτος (azotos) szó után, melynek jelentése élettelen.[6] Lavoisier kifejezése a nitrogénre széles körben elterjedt; Magyarországon az „azotum”, „azót” kifejezésekkel illették, olyan szavak mellett, mint a „fojtós matéria, „fojtószer” és „fullasztó”.[2] A nyelvújítás idején, a magyar kémiai műnyelv létrehozására irányuló erőltetett törekvések vezettek a „légeny” szó megszületéséhez; ám ez sok más szóval egyetemben nem honosodott meg, a tudomány képviselői idővel visszatértek a nemzetközi kifejezésekre.[2]
A ma is használatos nitrogén elnevezés a francia nitrogène szóból származik, amelyet 1790-ben alkotott meg Jean-Antoine Chaptal (1756–1832) francia kémikus, a görög nitron (nátrium-karbonát) és a francia gène (termelő) szavakból. A nitrogént megtalálták a salétromsavban; Chaptal felfogása szerint a nitrogéngáz a salétromsav alapvető része volt.[7] (A salétromsav salétromból (kálium-nitrát) származtatható, melynek régebbi elnevezését (nitre) nátrium vegyületekre is használták).[forrás?]
A nitrogén vegyületei már a középkorban is jól ismertek voltak. Az alkimisták a salétromsavat aqua fortis (erős víz) néven ismerték. A salétromsav és a sósav elegyének neve aqua regia (királyvíz) volt, mert arról volt híres, hogy feloldotta az aranyat (a fémek királyát). A legkorábban katonai, ipari, és mezőgazdasági célokra felhasznált nitrogénvegyület a salétrom volt (nátrium-nitrát és kálium-nitrát), elsősorban puskaporként, majd műtrágyaként hasznosították. 1910-ben John William Strutt felfedezte, hogy egy elektromos kisülés a nitrogéngázban „sárga fényben ragyogó, örvénylő felhő” formájában „aktív nitrogént” eredményez, amely egy egyatomos allotrop módosulatnak tekinthető. Az aktív nitrogén reagált a higannyal, robbanásveszélyes higany-nitridet alkotva.[8]
Előállítása
[szerkesztés]A nitrogéngáz ipari gáz, amelyet cseppfolyós levegőből frakcionált desztillációval vagy gáz-halmazállapotú levegőből mechanikus úton állítanak elő (pl. túlnyomásos fordított ozmózisos membrán vagy nyomásadszorpció (pressure swing adsorption) révén). A kereskedelmi nitrogén gyakran az acélgyártáshoz szükséges oxigénkoncentrációt megteremtő iparilevegő-feldolgozás mellékterméke. Palackba sűrítve gyakran nevezik OFN-nek (oxigénmentes nitrogén).[9]
Laboratóriumi körülmények között előállítható például ammónium-nitrit hevítésével,[forrás?] vagy ammónium-klorid vizes oldatának és nátrium-nitrit reakciójával.[10]
Ez utóbbi reakcióban kis mennyiségben NO- és HNO3-szennyeződés is keletkezik. A szennyeződések eltávolíthatók, ha a gázt kálium-dikromát-tartalmú vizes kénsavoldaton vezetik át.[10] Nagyon tiszta nitrogén állítható elő bárium-azid vagy nátrium-azid termikus bontásával.[11]
Tulajdonságai
[szerkesztés]
A nitrogén nagy elektronegativitású (3,04)[12] nemfémes elem. Vegyértékhéján öt elektron található, ennek következtében a legtöbb vegyületében három vegyértékű. Molekulája kétatomos (N2), benne háromszoros kovalens kötés van, melyből egy szigma-kötés és kettő pi-kötés. Ez a hármas kötés az egyik legerősebb. Nem táplálja az égést. Ennek a kötésnek az erőssége meghatározó a természeti és az emberi gazdasági tevékenységek szempontjából, mert megnehezíti a nitrogéngáz más vegyületekké alakítását, de megkönnyíti azok ismételt N2 gázzá alakítását (ez nagy energiafelszabadulással jár).
Légköri nyomáson a molekuláris nitrogén forráspontja 77 K (−195,79 °C); olvadáspontja pedig 63 K (−210,01 °C);[13] szilárd halmazállapotban allotrop kristályszerkezete béta hexagonális. 35,4 K (−237,6 °C) alatt a nitrogén köbös kristályszerkezetű allotrop módosulatként van jelen (úgynevezett alfa-fázis).[14] A cseppfolyós nitrogén egy a vízhez hasonló megjelenésű folyadék, ismert kriogén anyag; sűrűsége a vízének 80,8 százaléka (a folyékony nitrogén sűrűsége a forrásponti hőmérsékleten 0,808 g/ml).[15]
A nitrogén kettőnél több atomot tartalmazó allotrop módosulatait, mint például az N3 és N4, laboratóriumban sikerült előállítani.[16] Rendkívül magas nyomáson (1,1·106 atm) és magas hőmérsékleten (2000 K) a nitrogén egyszeres kötésű, szinklinális (gauche) köbös kristályszerkezetű anyaggá polimerizálódik. (Ilyen körülményeket gyémánt üllővel lehet előállítani). Ez a struktúra nagyon hasonló a gyémántéhoz, mindkettő rendkívül erős kovalens kötéseket tartalmaz; ezért az N4 beceneve a „nitrogén gyémánt”.[17]
Egyéb (még nem szintetizált) allotrópjai közé tartozik a hexazin (N6, a benzolgyűrű analogonja),[18] és az oktaazakubán (N8, a kubán analogonja).[19] Az előbbiről azt feltételezik, hogy rendkívül instabil; míg az utóbbi az előrejelzések szerint kinetikailag stabil, a molekula szimmetriájából adódóan.[20]
Izotópjai
[szerkesztés]
A nitrogénnek két stabil izotópja létezik: 14N és 15N. Messze a leggyakoribb a nitrogén-14 (99,634 %), amely a csillagokban termelődik a CNO-ciklus során. A tíz szintetizált izotóp közül a 13N felezési ideje durván tíz perc, míg a többi nem-stabil izotópé másodperc nagyságrendű.[21]
A biológiailag közvetített reakciók (pl. asszimiláció, nitrifikáció és denitrifikáció) határozott ellenőrzés alatt tartják a talaj nitrogéndinamikáját. Ezek a reakciók általában a talaj 15N-dúsulását és a termékek kimerülését eredményezik.[22]
A Föld légkörében lévő molekuláris nitrogén egy kis része (0,73 %) a 14N15N izotopológ (ez tehát két különböző nuklidot tartalmazó nitrogénmolekula); míg a fennmaradó rész szinte teljes egészében 14N2.[23]
A 16N radioizotóp a domináns radionuklid a nyomottvizes, illetve a forralóvizes reaktorok hűtőfolyadékában, azok normál működése esetén. A vízben lévő oxigén-16-ból keletkezik (n,p) reakció révén. Rövid, körülbelül 7,1 másodperces felezési ideje van,[21] de miközben oxigén-16-tá bomlik vissza, nagy energiájú (5–7 MeV) gamma-sugárzást bocsát ki.[21][24] Emiatt a nyomottvizes reaktor primer hűtőközegének hozzáférhetőségét a reaktor működése alatt korlátozni kell. A nitrogén-16 az egyik legfontosabb alkalmazott eszköz, amellyel a primer hűtőkör szekunder gőzkörbe való csekély szivárgását is azonnal észlelni lehet.[24]
Hasonlóképpen korlátozni kell működés közben a forralóvizes reaktorú atomerőmű gőzköreinek bármelyikének összetevőihez való hozzáférést. A kondenzátorból származó kondenzátumot általában tíz percig állni hagyják, hogy lehetővé tegyék a nitrogén-16 elbomlását. Ez szükségtelenné teszi a tápvíz csővezetékek és szivattyúk leárnyékolását, és a hozzáférésük korlátozását.[forrás?]
Elektromágneses spektruma
[szerkesztés]
A molekuláris nitrogén (14N2) nagy mértékben átlátszó az infravörös és látható tartománybeli sugárzás számára, mivel a dipólusmomentuma nulla, és így nem tud kölcsönhatásba lépni az ilyen hullámhosszúságú elektromágneses sugárzással. Ugyanakkor jelentős abszorpció figyelhető meg extrém ultraibolya hullámhosszokon,[25] mintegy 100 nanométertől kezdődően. Ez szorosan összefügg a molekula olyan állapotai közötti elektron-átmenetekkel, melyek során az elektronok nem egyenlő mértékben oszlanak meg az atomok között. A nitrogén abszorpciója vezet a Föld, illetve más bolygók felső légkörében az ultraibolya sugárzás jelentős elnyeléséhez. Ez a jelenség megvédi a földi életet a halálos sugárzásoktól, azonban zavaró körülmény a csillagászati képalkotások során.[26] Hasonló okokból a tiszta molekuláris nitrogén lézerek jellemzően az ultraibolya tartományban bocsátanak ki fényt.
A nitrogén hozzájárul a sarki fény kialakulásához, annak révén, hogy nagy energiájú elektromágneses sugárzás hatására a nitrogén elektronjai magasabb héjakra ugranak (az atom gerjesztett állapotba kerül), majd innen fénykibocsátás mellett alapállapotba kerül vissza (az elektronok alacsonyabb héjakra ugranak).[27] A Föld felső légkörének kék ragyogását (földfény), és a légkörbe belépő űrhajók ablakában látszódó kékes izzást jellemzően nem a molekuláris nitrogén, hanem az oxigénnel egyesülő szabad nitrogénatomok okozzák, mely folyamatban nitrogén-monoxidot (NO) képeznek.[forrás?]
A nitrogéngáz is mutat szcintillációt.

Reakciói
[szerkesztés]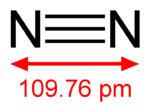
A nitrogén standard hőmérsékleten és nyomáson általában véve nem reakcióképes elem. A nitrogéngáz csak kevés vegyülettel reagál spontán, ellenáll a savaknak és bázisoknak, valamint az oxidálószereknek és a legtöbb redukálószernek. Kivételt képez a lítium, amellyel a nitrogén szobahőmérsékleten is reagál, így lítium-nitrid (Li3N) képződik:[28]
Magasabb hőmérsékleten a magnézium is reakcióba lép a nitrogénnel, magnézium-nitridet képezve.[29]
Égése a természetben villámláskor játszódik le; a nitrogén magas, körülbelül 3000 °C hőmérsékleten egyesül az oxigénnel (lent). A nitrogén-monoxid azonban keletkezhet tüzelési folyamatokban;[30] illetve enzimatikus segítséggel szintetizálódhat az emlősök és a primitív élőlények sejtjeiben is.[31]

A N2 számos adduktumot képez az átmenetifémekkel. Az első példa dinitrogén-komplexre a [Ru(NH3)5(N2)]2+. Azonban érdekes megjegyezni, hogy az N2 ligandum hidrazin bomlásából származik, és nem szabad dinitrogén hozzákapcsolódásából. Ma már számos ilyen vegyület létezik, beleértve például: IrCl(N2)(PPh3)2; W(N2)2(Ph2PCH2CH2PPh2)2; és [(η5-C5Me4H)2Zr]2(μ2, η2,η2-N2). Ezek a komplexek szemléltetik, hogy a dinitrogén hogyan kötődhet fémekhez a nitrogenáz enzimekben; illetve a Haber–Bosch-eljárás katalizátorában.[32] 2005-ben publikáltak egy katalitikus eljárást, amely molibdén-komplex és proton forrás jelenlétében ammóniává redukálja a nitrogént.[28]
A nitrogénvegyületek ipari célú előállításának kiinduló lépése a Haber-eljárás; amelyben a nitrogént N2 és H2 reakciójával kötik meg, vas(II, III)-oxid (Fe3O4) katalizátor jelenlétében körülbelül 500 °C-on, 200 atmoszféra nyomáson. A biológiai nitrogén megkötés a természetben élő cianobaktériumokban és a növények gyökerében szintén molekuláris nitrogénből állít elő ammóniát. A bioszférában lévő nitrogén zömének forrását jelentő reakciót vas- és molibdénatomokat tartalmazó nitrogenáz enzim komplex katalizálja; energiája (−20,5 kJ/mol) pedig az adenozin-trifoszfát (ATP), adenozin-difoszfátot és szervetlen foszfátot eredményező hidrolíziséből származik.[forrás?]
Előfordulása
[szerkesztés]A nitrogén a Föld légkörének leggyakoribb összetevője (a száraz levegő 78,082 térfogat-, illetve 75,3 tömegszázaléka nitrogén).[33] Ez a nagy koncentráció azonban nem tükrözi a nitrogén alacsony előfordulását a Föld összetételében, mert az elem nagy részét a Nap még a bolygó kialakulásának korai szakaszában elpárolgatta.
A nitrogén gyakori elem az univerzumban, tömeg szerint közelítőleg a hetedik leggyakoribb kémiai elem a galaxisunkban és a Naprendszerben. Az ottani előfordulásáról azt gondolják, hogy teljes egészében a szupernóvákban fuzionálódó hidrogén és szén eredményeképpen jön létre.[34] A Far Ultraviolet Spectroscopic Explorer segítségével csillagászok molekuláris nitrogént és nitrogénvegyületeket mutattak ki a csillagközi térben.[35]
Az elemi nitrogén, illetve a hidrogénnel és oxigénnel alkotott gyakori vegyületei illékonyságuk miatt, a Nap hője következtében gáz formában eltűntek a korai Naprendszer planetezimáljairól; így elvesztek a belső Naprendszer kőzetbolygói számára. A nitrogén ennélfogva viszonylag ritka elem e belső bolygókon, köztük a Föld egészén. Ebben a tekintetben a neonra emlékeztet, amely hasonló előfordulással bír a világegyetemben; ezzel szemben ritka elem a belső Naprendszerben. A nitrogén becslések szerint a földkéreg 30. leggyakoribb összetevője. Létezik néhány viszonylag ritka nitrogénásvány, mint például a salétrom (kálium-nitrát), a chilei salétrom (nátrium-nitrát) és az ammónium-klorid. Ezek is elsősorban kiszáradt óceáni ágyakból mint koncentrátumok ismertek, mivel a természetben előforduló nitrogénvegyületek közül jobban oldódnak vízben.[forrás?] Hasonló történik a szintén meglehetősen ritka elem, a bór oldhatósága kapcsán is.
A nitrogén és vegyületei azonban sokkal gyakoribbak gáz formában azon bolygók és holdak légkörében, melyek elég nagyok ahhoz, hogy atmoszférájuk legyen.[36] Például, a molekuláris nitrogén nem csupán a Föld légkörének; hanem a szaturnuszi hold, a Titán sűrű légkörének is fő alkotórésze. Továbbá, köszönhetően a gravitáció visszatartó erejének alacsonyabb hőmérsékleten, a nitrogén és vegyületei értékelhető mennyiségben fordulnak elő a gázóriások légkörében.[37]
A nitrogén jelen van minden élő szervezetben, a fehérjékben, a nukleinsavakban, és más molekulákban. Jellemzően a növényi anyagok száraz tömegének körülbelül 4%-át, és az emberi test körülbelül 3%-át teszi ki. Jelentős összetevője az állati hulladéknak (például guanó), általában karbamid, húgysav, ammóniumvegyületek, és ezen nitrogéntartalmú termékek származékainak formájában található meg; melyek alapvető tápanyagai az összes olyan növénynek, melyek nem tudják megkötni a légköri nitrogént.[forrás?]
Felhasználása
[szerkesztés]Nitrogéngáz
[szerkesztés]
A nitrogéngázt számos területen alkalmazzák (például inert gázként helyettesíti a levegőt ott, ahol az oxidáció nemkívánatos[38]):
- Inert atmoszféra előállítására, tisztán vagy szén-dioxiddal keverve; hogy megőrizze a csomagolt vagy ömlesztett élelmiszerek frissességét (késlelteti az avasodást és egyéb oxidatív károsodásokat). A tiszta nitrogént, mint élelmiszer-adalékanyagot az Európai Unió az E941-es E-számmal jelöli..[39]
- A hagyományos izzólámpákban, mint az argon olcsó alternatívája.[40]
- Elektronikus alkatrészek, mint például tranzisztorok, diódák, és integrált áramkörök gyártásához.[forrás?]
- Szárítva és nyomás alá helyezve, dielektrikum gázként használják nagyfeszültségű berendezésekben.[forrás?]
- Rozsdamentes acél gyártásához.[41]
- Katonai repülőgépek üzemanyag-rendszerében, hogy csökkentsék a tűzveszélyt.[forrás?]
- Tűzveszélyes folyadékokkal töltött tartályok tetején, biztonsági intézkedésként (nitrogénpárna).
- Közúti és légi járművek gumiabroncsainak töltésére.[42]
- Az üzemelés körülményei között nem cseppfolyósodó inert gáztöltetként, például légrugókban, tűzoltó palackokban.
- Ammóniagyártáshoz:
A nitrogént a kémiai analízisben is elterjedten alkalmazzák a minták előkészítésekor. Arra használják, hogy töményítsék és csökkentsék a folyadékminták térfogatát. A nyomás alatt lévő nitrogéngázt merőlegesen a folyadék felszínére irányítva, lehetővé válik, hogy az oldószer elpárologjon, miközben az oldott anyag(ok) hátramaradnak.[43]
Cseppfolyós nitrogén
[szerkesztés]
A cseppfolyós nitrogén egy kriogén folyadék. Légköri nyomáson −195,8 °C-on forr. Ha megfelelő tartályban, például termoszban szigetelik el, jelentős párolgási veszteség nélkül szállítható.[44]
A szárazjéghez hasonlóan a folyékony nitrogént főleg hűtőközegként használják fel. Többek között vér, reproduktív sejtek (sperma és petesejt), illetve egyéb biológiai minták és anyagok krioprezervációjára használható fel.[45] A krioterápia során klinikailag a bőrön alkalmazzák, hogy eltávolítsák a cisztákat és szemölcsöket.[46] Bizonyos laboratóriumi berendezésekben a hidegcsapdákban alkalmazzák, illetve felhasználják röntgendetektorok vagy infravörös érzékelők hűtésére. Alkalmazzák órajelnél gyorsabban működtetett számítógépek központi feldolgozóegységeinek és egyéb eszközeinek hűtésére, melyek a normál működésnél több hőt termelnek.[47]
Nitrogénvegyületek
[szerkesztés]A nitrogén összekapcsolása, illetve megkötése a modern ipari kémia legfontosabb jellemzője. A nitrogénből és a földgázból a Haber–Bosch-eljárással ammónia állítható elő. Az ammónia egyrészt közvetlenül felhasználható (elsősorban műtrágyaként és nitro-műtrágyák előállítására);[13] másrészt más fontos anyagok – beleértve a robbanóanyagokat is – prekurzoraként, az Ostwald-eljárással előállított salétromsav útján.[38]
A salétromsav szerves és szervetlen sói a kémiai energia történelmileg fontos és kényelmes tárolói voltak. Ezek közé fontos vegyületek tartoznak, például a kálium-nitrát (amit a lőporban használtak)[48] és az ammónium-nitrát, amely fontos műtrágya[33] és robbanóanyag (lásd ANFO). Egyéb különböző nitrált szerves vegyületek, mint a nitroglicerin, a trinitrotoluol,[48] és a nitro-cellulóz[49] robbanóanyagokként és a modern lőfegyverek hajtóanyagaiként használatosak. A salétromsavat oxidálószerként használják a folyékony üzemanyagú rakétákban. A hidrazin és származékai rakéta-üzemanyagokként és hajtógázokként használhatóak fel. A legtöbb ilyen vegyület instabilitását és robbanásra, illetve égésre való hajlamát az okozza, hogy a nitrogén oxidként, és nem a sokkal stabilabb nitrogén molekulaként (N2) van jelen, amely ezen vegyületek termikus bomlásának eredménye. Amikor a nitrátok elégnek vagy felrobbannak, a kialakuló dinitrogénmolekula erős hármas kötése termeli a legtöbb energiát a reakció során.
A nitrogén összetevője minden nagyobb gyógyszerosztály molekuláinak a farmakológiában és az orvostudományban. A dinitrogén-oxidot (N2O) a 19. század elején fedezték fel, mint részleges érzéstelenítő, habár azt csak később használták műtéti érzéstelenítésre. Kéjgáznak nevezték, és úgy találták, hogy belégzése a részegséghez hasonlító állapotot idéz elő. Egyéb említésre méltó nitrogéntartalmú gyógyszerek a növényi alkaloidokból származó drogok, mint például a morfin (sok alkaloida létezik, amelyről ismert, hogy farmakológiai hatású; egyes esetekben ezek a növény ragadozókkal szembeni természetes kémiai védelmét szolgálják). A nitroglicerin és a nitroprusszid ismert vérnyomás- és a szívműködés-szabályzók, melyek a nitrogén-monoxid hatását utánozzák.
Vegyületei
[szerkesztés]A nitrogén legfontosabb semleges hidridje az ammónia (NH3), noha a hidrazint (N2H4) is gyakran alkalmazzák. Az ammónia 6 nagyságrenddel bázikusabb, mint a víz. Oldatban ammóniumiont (NH4+) képez. A folyékony ammónia (forráspontja 240 K) amfoter anyag (azaz kijelzi a Brønsted-Lowry féle savas vagy bázikus jelleget is), ezenfelül amidionokat képez (NH2–). Amid és nitrid (N3−) sók is ismertek, de ezek vízben lebomlanak. Az ammónia alkil-vegyületekkel egy-, két-, három- illetve négyszeresen szubsztituált vegyületei az aminok. A négyszeresen szubsztituált, úgynevezett kvaterner aminok kereskedelmileg és biológiailag is egyaránt jelentősek; mindemellett mivel a négy szubsztituens egy pozitív töltésű nitrogénatomot eredményez, így ezek egyben vízben oldható, vagy legalábbis amfoter vegyületek.[forrás?]
A nitrogén anionok (negatív töltésű ionok) másik nagy csoportja a mérgező azidok (N3–). Az azidok lineáris molekulák, és bár elektronszerkezetük a szén-dioxidhoz hasonló, de a szervezetben a cianidokhoz hasonló módon kötődnek a vas-tartalmú enzimekhez. Egy másik, azonos szerkezetű molekula a színtelen és viszonylag inert altatógáz, a dinitrogén-oxid (dinitrogén-monoxid, N2O), más néven kéjgáz. Ez a vegyület a különböző nitrogén-oxidok egyike, mely családot gyakran NOx-ként rövidítik. A nitrogén-monoxid (NO) egy természetes szabad gyök, amelyet növények és állatok egyaránt használnak a jelátvitel során; például értágulatkor (vazodilatáció) a vérerek simaizom-szöveteinek elernyedését okozza. A vöröses színű, és mérgező nitrogén-dioxid (NO2) párosítatlan elektront tartalmaz; illetve fontos összetevője a szmognak. A párosítatlan elektront tartalmazó nitrogén vegyületek hajlamosak a dimerizációra (így párosíva az elektronjaikat), és általában véve nagyon reaktívak. A kapcsolódó savak a salétromossav HNO2, és a salétromsav HNO3; sóik a nitritek és a nitrátok.
A többi oxid, mint például a dinitrogén-trioxid (N2O3), a dinitrogén-tetroxid (N2O4), illetve a dinitrogén-pentoxid (N2O5), nem stabil, és robbanásveszélyes; amely egyenes következménye az N2 kémiai stabilitásának. Szinte mindegyik hipergol-hajtóanyagú rakéta N2O4 használ oxidálószerként; ezek üzemanyagai a hidrazin különböző származékai, melyek szintén nitrogénvegyületek. Ezeket a rakéta-hajtóműveket széles körben használták, a Space Shuttle-n és az Apollo-program rakétáin, mert e hajtóanyagok szobahőmérsékleten folyadékok, és külön gyújtó-rendszer nélkül, érintkezéskor begyulladnak; ez lehetővé teszi a pontosan szabályzott égést. Néhány rakéta, mint a Titan II és az Ariane 1-4 is hipergol üzemanyagokat használ, bár a trend távolodik ezektől költségvetési és a biztonsági okok miatt. Az N2O4 a salétromsav (HNO3) előállításának köztes terméke, és egy meglehetősen erős oxidálószer.
A nitrogén figyelemre méltó azokról a robbanásszerűen instabil vegyületekről, amelyek belőle állíthatóak elő. A nitrogén-trijodid (NI3) egy rendkívül érzékeny robbanóanyag. A nitrocellulóz, amelyet cellulóz salétromsavval történő nitrálásával állítanak elő, lőgyapot néven is ismert. A glicerin nitrálásával gyártható nitroglicerin a dinamit veszélyesen instabil robbanásveszélyes összetevője. A hozzá képest stabilabb, de kevésbé erős robbanóanyag, a trinitrotoluol (TNT) az a standard robbanóanyag, amelyhez a nukleáris robbantások erejét mérik.[50]
A nitrogén szerves vegyületekben is megtalálható. A gyakori nitrogéntartalmú funkciós csoportok közé tartoznak: az aminok, az amidok, a nitro-csoportok, az iminek, és az enaminok. Egy vegyi anyag nitrogén tartalmát a Kjeldahl-módszerrel lehet meghatározni.
Biológiai szerepe
[szerkesztés]A nitrogén nélkülözhetetlen építőköve az amino- és nukleinsavaknak, amelyek alapvető fontosságúak a földi élet számára.[33]
A légkörben lévő elemi nitrogént közvetlenül nem tudják felhasználni sem a növények, sem az állatok; át kell alakítani (meg kell kötni) megfelelő állapotba, hogy hasznos legyen a magasabb rendű növények és állatok számára. A csapadék gyakran tartalmaz jelentős mennyiségű ammóniumiont és nitrátot, melyről azt gondolják, hogy a villámlás, illetve egyéb légköri elektromos jelenségek nitrogén megkötésének eredménye.[51] Ezt először Liebig javasolta 1827-ben, majd később megerősítették.[51] Mivel azonban az erdő lombkoronája a légköri nitráthoz képest jobban megtartja az ammóniumionokat, a kötött nitrogén többsége nitrátként éri el a talaj felszínét a fák alatt. A fa gyökerei ezzel szemben előnyösebben asszimilálják a talaj-nitrátokat, mint a talajbeli ammóniumionokat.[52]
Egyes különleges baktériumok (pl. Rhizobium trifolii) rendelkeznek nitrogenáz-enzimmel, amely ammóniumion formájában megköti a légköri nitrogént, így kémiailag hasznossá alakítja a magasabb rendű szervezetek számára. Ehhez a folyamathoz nagy mennyiségű energia és anoxiás körülmények szükségesek. Ezek a baktériumok képesek szabadon élni a talajban (pl. Azotobacter), de általában egy szimbiotikus kapcsolatban élnek a hüvelyes növények (pl. lóhere (Trifolium), vagy szójabab (Glycine max)) gyökérgumóival. A nitrogén-megkötő baktériumok szintén szimbiózisban élnek számos független növényfajjal is, például az égerrel (Alnus), a zuzmókkal, a kazuárfával (Casuarina), a májmohákkal, és az óriáslapuval (Gunnera).[53]
A szimbiotikus kapcsolat részeként a növény a megkötött ammóniumionokat nitrogén-oxidokká és aminosavakká alakítja, hogy fehérjéket és más molekulákat (például alkaloidokat) képezzen belőlük. Mindezért cserébe a növény cukrot juttat (szekretál) a szimbióta baktériumoknak.[53] A hüvelyesek anaerob (oxigénmentes) környezetet tartanak fenn a nitrogén-megkötő baktériumok számára.[forrás?]
A növények képesek asszimilálni a nitrogén közvetlenül nitrátok formájában is, melyek jelen lehetnek a talajban természetes ásványok, műtrágyák, állati hulladék, vagy szerves bomlás (nem kifejezetten a növényhez kapcsolódó baktériumok termékeként) formájában. Az ilyen módon elnyelt nitrátok először nitritekké alakulnak a nitrát reduktáz enzim hatására, majd a nitrit reduktáz enzim ammóniává alakítja őket.[53]
A nitrogén vegyületek az állati biológia alap építőkövei is egyben. Az állatok növényi eredetű nitrogéntartalmú aminosavakat használnak kiindulási anyagként a nitrogén-biokémiájukhoz, beleértve a fehérjék és nukleinsavak gyártását is. A növényeken táplálkozó rovarok függenek az étrendjükben szereplő nitrogéntől, oly módon, hogy a növényre szórt nitrogén-műtrágya mennyiségének változtatása kihatással van a növényből táplálkozó rovarok szaporodási ütemére.[54]
Az oldható nitrátok fontos korlátozó tényezői bizonyos, az óceán vizein élő baktériumok szaporodásának.[55] Sok helyen a világon, a termőföldeken alkalmazott műtrágyázás eredményeképpen az elfolyó oldható nitrogén a folyótorkolatoknál az óceánokba jut. Ez a folyamat a vizek eutrofizációját eredményezheti, mivel a nitrogénalapú baktériumok elszaporodása kimeríti víz oxigéntartalmát, míg végül a magasabbrendű organizmusok elpusztulnak. A szennyező folyamatok miatt jól ismert „holt zóna” a Mexikói-öböl partvidéke, és a Fekete-tenger.[forrás?]
Sok tengeri hal nagy mennyiségű trimetilamin-oxidot állít elő, hogy megvédje őket a környezetük erős ozmotikus hatásai ellen; ennek a vegyületnek a dimetilaminná alakulása felelős a nem-friss tengeri halak korai szagáért.[56] Az állatokban, az aminosavakból származó nitrogén-monoxid (NO) szabad gyökök, fontos szabályozó molekulák a keringésben.[55]
A nitrogén-monoxid vízzel való gyors reakciója az állatokban nitrit anyagcseretermékek termelődését eredményezi. Az állatok nitrogén anyagcseréje a fehérjékben általában karbamid kiválasztását; míg a nukleinsavakban karbamid és húgysav kiválasztását eredményezi. A bomló állati hús jellegzetes szagát hosszú szénláncú, nitrogén-tartalmú aminok keletkezése okozza; mint például a putreszcin és kadaverin, melyek az ornitin és lizin - aminosavak - illetve a pusztuló fehérjék bomlástermékei.[57]
Az organizmusok hulladékai és bomlástermékei előállítanak ugyan kis mennyiségű nitrátot, de a nitrogéntartalom nagy része végül molekuláris nitrogén formájában visszatér a légkörbe. A nitrogén körforgása a légkörből az organizmusokba, majd onnan vissza: a nitrogén ciklus.[53]
Biztonság
[szerkesztés]Nitrogéngáz gyors felszabadulása zárt térben kiszoríthatja az oxigént, következésképpen a fulladás veszélye áll fenn. Elképzelhető néhány figyelmeztető tünet, mivel az emberi karotid test (glomus caroticum) egy viszonylag lassú és rossz oxigénhiány (hypoxia) érzékelő rendszer.[58] Hasonló eset történt röviddel az első Space Shuttle űrsikló-misszió fellövése előtt 1981-ben, amikor két technikus elvesztette az eszméletét (és egyikük meghalt), mert beléptek az űrsikló mobil indítóállványának egy kamrájába, amely tűzvédelmi elővigyázatosságból tiszta nitrogénnel volt nyomás alá helyezve.[forrás?]
Amikor az ember magas parciális nyomású nitrogént lélegez be (magasabb, mint kb. 4 bar; búvárkodás esetén 30 méter alatti mélységben tapasztalható) a gáz érzéstelenítő szerként kezd hatni. Ez nitrogén narkózishoz vezethet, amely egy átmeneti, félig altatott agykárosító állapot, hasonló ahhoz, amit a dinitrogén-oxid okoz.[59][60]
A nitrogén emellett feloldódik a véráramban és a test zsírszöveteiben. A gyors dekompresszió (túl gyorsan felemelkedő búvárok, vagy kabin nyomásról szkafander nyomásra túl hamar áttérő űrhajósok esetén) egy potenciálisan végzetes állapothoz vezethet, amelyet keszonbetegségnek (másik nevén dekompressziós betegség) neveznek; mely során nitrogén buborékok keletkeznek a véráramban, az idegekben, ízületekben, és egyéb érzékeny vagy fontos területeken.[61][62] Egyéb inert gázok (a szén-dioxidon és az oxigénen kívül) használata azonos hatású buborékokat eredményez, így a nitrogén, mint gázkeverék lecserélése megakadályozza ugyan a nitrogén narkózis kialakulását, de nem akadályozza meg a dekompressziós betegséget.[63]
A folyékony nitrogénnel való közvetlen érintkezés súlyos fagyási sérüléseket okoz. Ez a folyékony nitrogén formájától függően vagy azonnal az érintkezéskor, vagy néhány másodperccel azt követően következik be. Az ömlesztett folyékony nitrogén kevésbé gyors fagyást okoz, mint egy permetnyi nitrogén-köd (melyet a dermatológiai gyakorlatban bizonyos bőrelváltozások lefagyasztására használnak). A nitrogénnel átitatódott anyagok általi extra felület is fontos szereppel bír; az átitatódott ruházat vagy pamut sokkal gyorsabb fagyást eredményez, mintha a folyadék közvetlenül a bőrre kerülne. A csupasz bőr, és a folyékony nitrogén cseppek közti „teljes” érintkezést ugyanis a Leidenfrost-hatás következtében létrejött szigetelő gázréteg megakadályozza. Ez a jelenség néhány másodpercnyi védelmet biztosít a fagyás ellen. Azonban a bőrön, vagy a szöveteken alkalmazott nitrogén-permet megkerüli ezt a hatást, és emiatt helyileg azonnali fagyási sérülést okoz.
Bizonyos esetekben biztonsági okokból oxigénérzékelőket alkalmaznak, ha zárt térben kell folyékony nitrogénnel dolgozni, így időben figyelmeztetni lehet a munkásokat a gázszivárgásra.[64]
Jegyzetek
[szerkesztés]- ↑ Current Table of Standard Atomic Weights in Order of Atomic Number. Commission on Isotopic Abundances and Atomic Weights – Commission II.I of the International Union of Pure and Applied Chemistry, 2013. (Hozzáférés: 2013. október 13.)
- ↑ a b c Szőkefalvi-Nagy Zoltán: A magyar kémiai szaknyelv kialakulása. (Hozzáférés: 2013. január 28.)
- ↑ Bokor József (szerk.). Azot, A Pallas nagy lexikona. Arcanum: FolioNET (1893–1897, 1998.). ISBN 963 85923 2 X. Hozzáférés ideje: 2022. május 30.
- ↑ Lavoisier, Antoine Laurent. Elements of chemistry, in a new systematic order: containing all the modern discoveries. Courier Dover Publications, 15. o. (1965). ISBN 0-486-64624-6
- ↑ (1932) „The discovery of the elements. IV. Three important gases”. Journal of Chemical Education 9 (2), 215. o. DOI:10.1021/ed009p215. ISSN 0021-9584.
- ↑ Elements of Chemistry, trans. Robert Kerr (Edinburgh, 1790; New York: Dover, 1965), 52.
- ↑ Online Ethymology Dictionary: Nitrogen. (Hozzáférés: 2013. január 28.)
- ↑ Lord Rayleigh's Active Nitrogen Archiválva 2012. november 1-i dátummal a Wayback Machine-ben. Lateralscience.co.uk. Hozzáférés ideje: 2011-10-26.
- ↑ Reich, Murray, Kapenekas, Harry (1957). „Nitrogen Purfication. Pilot Plant Removal of Oxygen”. Industrial & Engineering Chemistry 49 (5), 869–873. o. DOI:10.1021/ie50569a032.
- ↑ a b (1967) „Analysis for nitrite by evolution of nitrogen: A general chemistry laboratory experiment”. Journal of Chemical Education 44 (8), 475. o. DOI:10.1021/ed044p475.
- ↑ (2004) „Polymerization of nitrogen in sodium azide”. The Journal of Chemical Physics 120 (22), 10618–10623. o. DOI:10.1063/1.1718250. PMID 15268087.
- ↑ szerk.: Lide, D. R.: CRC Handbook of Chemistry and Physics, 84th, Boca Raton, FL: CRC Press (2003)
- ↑ a b Gray, Theodore. The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers (2009). ISBN 978-1-57912-814-2
- ↑ Chemistry of the Elements, 2nd, Butterworth–Heinemann (1997). ISBN 0080379419
- ↑ (2006) „A comparison of liquid nitrogen and liquid helium as cryogens for electron cryotomography”. Journal of Structural Biology 153 (3), 231–240. o. DOI:10.1016/j.jsb.2005.12.004. PMID 16427786.
- ↑ A new molecule and a new signature – Chemistry – tetranitrogen. Science News, 2002. február 16. [2015. október 16-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. augusztus 18.)
- ↑ „Polymeric nitrogen synthesized”, physorg.com, 2004. augusztus 5. (Hozzáférés: 2009. június 22.)
- ↑ Fabian, J. and Lewars, E. (2004). „Azabenzenes (azines) — The nitrogen derivatives of benzene with one to six N atoms: Stability, homodesmotic stabilization energy, electron distribution, and magnetic ring current; a computational study”. Canadian Journal of Chemistry 82 (1), 50–69. o. [2005. március 29-i dátummal az eredetiből archiválva]. DOI:10.1139/v03-178. (Hozzáférés: 2013. február 2.)
- ↑ Muir, B.: Cubane
- ↑ Ujwala N. Patil, Nilesh R. Dhumal and Shridhar P. Gejji. „Theoretical studies on the molecular electron densities and electrostatic potentials in azacubanes”, 27-32. oldal. [2020. április 6-i dátummal az eredetiből archiválva] (Hozzáférés: 2013. február 2.)
- ↑ a b c G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon (2003). „The NUBASE evaluation of nuclear and decay properties”. Nuclear Physics A 729, 3–128. o. [2008. szeptember 23-i dátummal az eredetiből archiválva]. DOI:10.1016/j.nuclphysa.2003.11.001. (Hozzáférés: 2013. február 2.)
- ↑ Stable Isotopes and Biosphere - Atmosphere Interactions: Processes and Biological Controls, 74–75. o. (2004. december 15.). ISBN 9780080525280
- ↑ Atomic Weights and Isotopic Compositions for Nitrogen. NIST. (Hozzáférés: 2013. május 22.)
- ↑ a b Neeb, Karl Heinz. The Radiochemistry of Nuclear Power Plants with Light Water Reactors. Berlin-New York: Walter de Gruyter, 227. o. (1997). ISBN 3-11-013242-7
- ↑ (1943) „Absorption Spectrum of N2 in the Extreme Ultraviolet”. Physical Review 64 (7–8), 207. o. DOI:10.1103/PhysRev.64.207.
- ↑ Mignone C, Pierce-Price (2010). „The ALMA Observatory: the sky is only one step away.”. Science in School (15), 44-49. o.
- ↑ National Aeronautics and Space Administration, Science Mission Directorate: Ultraviolet Waves, 2010. [2011. január 27-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. január 30.)
- ↑ a b Schrock, R. R. (2005). „Catalytic Reduction of Dinitrogen to Ammonia at a Single Molybdenum Center”. Acc. Chem. Res. 38 (12), 955–962. o. DOI:10.1021/ar0501121. PMID 16359167. PMC 2551323.
- ↑ Raymond Chang, Kenneth Goldsby. Chemistry, 12th edition, Penn Plaza, New York: McGraw-Hill Education (2015). ISBN 978-0-07-802151-0
- ↑ NOX - Nitrogén-oxidok. (Hozzáférés: 2013. január 29.)
- ↑ Fürst Zsuzsanna (1999. 05). „A nitrogén-monoxid”. Természet Világa 130 (4), 146–151. o. (Hozzáférés: 2013. január 29.)
- ↑ Fryzuk, M. D. and Johnson, S. A. (2000). „The continuing story of dinitrogen activation”. Coordination Chemistry Reviews 200–202, 379. o. DOI:10.1016/S0010-8545(00)00264-2.
- ↑ a b c Emsley, p. 360
- ↑ Croswell, Ken. Alchemy of the Heavens. Anchor (1996. February). ISBN 0-385-47214-5
- ↑ Meyer, Daved M.; Cardelli, Jason A.; Sofia, Ulysses J. (1997). „Abundance of Interstellar Nitrogen”. The Astrophysical Journal 490, L103–L106. o. DOI:10.1086/311023.
- ↑ Megjegyzés: a kisebb sziklás holdak és bolygók légkörében a nitrogén és vegyületei jóval gyakoribbak a neonnál, mivel illékonyságuk a neonénál kisebb.
- ↑ Hamilton, Calvin J.: Titan (Saturn VI). Solarviews.com. (Hozzáférés: 2007. december 24.)
- ↑ a b Emsley, p. 364
- ↑ (2002) „Food Additives in Europe 2000”, 591. o.
- ↑ szerk.: Harding, Charlie: Elements of the p Block. Cambridge: Royal Society of Chemistry (2002). ISBN 978-0-85404-690-4
- ↑ Gavriliuk, V. G.; Berns, Hans. High nitrogen steels: structure, properties, manufacture, applications. Springer (1999). ISBN 3-540-66411-4
- ↑ Why don't they use normal air in race car tires?. Howstuffworks. (Hozzáférés: 2006. július 22.)
- ↑ Kemmochi, Y (2002). „Centrifugal concentrator for the substitution of nitrogen blow-down micro-concentration in dioxin/polychlorinated biphenyl sample preparation”. Journal of Chromatography A 943 (2), 295–297. o. DOI:10.1016/S0021-9673(01)01466-2. PMID 11833649.
- ↑ Kaganer (1967). „Vessels for the storage and transport of liquid oxygen and nitrogen”. Chemical and Petroleum Engineering 3 (12), 918–922. o. DOI:10.1007/BF01136404.
- ↑ Index: Mínusz 200 fokon tárolják az őssejteket, 2013. január 23. (Hozzáférés: 2013. január 30.)
- ↑ Ahmed I, Agarwal S, Ilchyshyn A, Charles-Holmes S, Berth-Jones J (2001. May). „Liquid nitrogen cryotherapy of common warts: cryo-spray vs. cotton wool bud”. Br. J. Dermatol. 144 (5), 1006–9. o. DOI:10.1046/j.1365-2133.2001.04190.x. PMID 11359389.
- ↑ Kent, Allen; Williams, James G.. Encyclopedia of Computer Science and Technology, Volume 30. CRC Press, 318. o. (1994). ISBN 0-8247-2283-3
- ↑ a b Emsley, p. 362
- ↑ Cleveland, David (2002) "Don't Try This at Home: Some Thoughts on Nitrate Film, With Particular Reference to Home Movie Systems" in Roger Smither and Catherine Surowiec (eds.), This Film is Dangerous: A Celebration of Nitrate Film, Brussels, FIAF, ISBN 978-2-9600296-0-4, p. 196
- ↑ Häring, Heinz-Wolfgang. Industrial Gases Processing. John Wiley & Sons, 243–. o. (2008. november 23.). ISBN 978-3-527-62125-5. Hozzáférés ideje: 2012. január 2.
- ↑ a b Rakov, Vladimir A.. Lightning: Physics and Effects. Cambridge University Press, 508. o. (2007). ISBN 978-0-521-03541-5
- ↑ „Vertical Distribution of Roots and Soil Nitrate: Tree Species and Phosphorus Effects” 62 (1), 280–286. o, Kiadó: Soil Science Society of America Journal. [2013. június 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. január 2.)
- ↑ a b c d Bothe, Hermann; Ferguson, Stuart John; Newton, William Edward. Biology of the nitrogen cycle. Elsevier, 283. o. (2007). ISBN 0-444-52857-1
- ↑ Jahn, G.C. (2005). „Effect of nitrogen fertilizer on the intrinsic rate of increase of the rusty plum aphid, Hysteroneura setariae (Thomas) (Homoptera: Aphididae) on rice (Oryza sativa L.)”. Environmental Entomology 34 (4), 938–943. o. [2016. február 5-i dátummal az eredetiből archiválva]. DOI:10.1603/0046-225X-34.4.938. (Hozzáférés: 2013. február 2.)
- ↑ a b Knox, G. A.. Biology of the Southern Ocean. CRC Press, 392. o. (2007). ISBN 0-8493-3394-6
- ↑ Nielsen, M. K.; Jørgensen, B. M. (2004. Jun). „Quantitative relationship between trimethylamine oxide aldolase activity and formaldehyde accumulation in white muscle from gadiform fish during frozen storage”. Journal of Agricultural and Food Chemistry 52 (12), 3814–3822. o. DOI:10.1021/jf035169l. PMID 15186102.
- ↑ Vickerstaff Joneja, Janice M.. Digestion, diet, and disease: irritable bowel syndrome and gastrointestinal function. Rutgers University Press, 121. o. (2004). ISBN 0-8135-3387-2
- ↑ Biology Safety – Cryogenic materials. The risks posed by them. University of Bath. [2007. február 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. január 3.)
- ↑ Fowler, B, Ackles, KN; Porlier, G (1985). „Effects of inert gas narcosis on behavior—a critical review”. Undersea Biomed. Res. 12 (4), 369–402. o. [2010. december 25-i dátummal az eredetiből archiválva]. PMID 4082343. (Hozzáférés: 2008. szeptember 21.)
- ↑ Rogers, W. H.; Moeller, G. (1989). „Effect of brief, repeated hyperbaric exposures on susceptibility to nitrogen narcosis”. Undersea Biomed. Res. 16 (3), 227–32. o. [2009. szeptember 1-i dátummal az eredetiből archiválva]. PMID 2741255. (Hozzáférés: 2008. szeptember 21.)
- ↑ Acott, C. (1999). „A brief history of diving and decompression illness”. South Pacific Underwater Medicine Society Journal 29 (2). [2011. szeptember 5-i dátummal az eredetiből archiválva]. (Hozzáférés: 2008. szeptember 21.)
- ↑ Kindwall, E. P., A. Baz; E. N. Lightfoot; E. H. Lanphier; A. Seireg. (1975). „Nitrogen elimination in man during decompression”. Undersea Biomed. Res. 2 (4), 285–97. o. [2011. július 27-i dátummal az eredetiből archiválva]. PMID 1226586. (Hozzáférés: 2008. szeptember 21.)
- ↑ US Navy Diving Manual, 6th revision [archivált változat]. United States: US Naval Sea Systems Command (2006). Hozzáférés ideje: 2008. április 24. [archiválás ideje: 2008. május 2.]
- ↑ Liquid Nitrogen – Code of practice for handling. United Kingdom: Birkbeck, University of London (2007). Hozzáférés ideje: 2012. február 8.
Fordítás
[szerkesztés]- Ez a szócikk részben vagy egészben a Nitrogen című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk
[szerkesztés]- a magyar Wikipédia nitrogént tartalmazó vegyületeinek listája belső lapon és külső keresővel
 A Wikimédia Commons tartalmaz Nitrogén témájú kategóriát.
A Wikimédia Commons tartalmaz Nitrogén témájú kategóriát.- Videó: egy lavór cseppfolyós nitrogén beleöntése egy medencébe










