Virus de la grippe A (H5N1)
élevés dans des cellules de rein
de canidés (en vert)
| Domaine | Riboviria |
|---|---|
| Embranchement | Negarnaviricota |
| Sous-embr. | Polyploviricotina |
| Classe | Insthoviricetes |
| Ordre | Articulavirales |
| Famille | Orthomyxoviridae |
| Genre | Alphainfluenzavirus |
- Espèce : virus de la grippe A
- sous-type H1N1
- sous-type H1N2
- sous-type H2N2
- sous-type H2N3
- sous-type H3N1
- sous-type H3N2
- sous-type H3N8
- sous-type H5N1
- sous-type H5N2
- sous-type H5N3
- sous-type H5N6
- sous-type H5N8
- sous-type H5N9
- sous-type H6N1
- sous-type H6N2
- sous-type H7N1
- sous-type H7N2
- sous-type H7N3
- sous-type H7N4
- sous-type H7N7
- sous-type H7N9
- sous-type H9N2
- sous-type H10N7
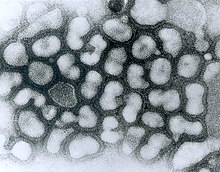
micrographie à transmission électronique de
particules virales chargées négativement en
passage tardif. (Source : Dr. Erskine Palmer,
bibliothèque d’images du Centers for Disease
Control and Prevention Public Health,
image n°280). Date de création : 1981.
Le sous-type H5N1 du virus de la grippe A fait référence aux types de deux antigènes présents à la surface du virus : l'hémagglutinine de type 5 et la neuraminidase de type 1. Le virus de la grippe A est un virus à ARN monocaténaire de polarité négative à génome segmenté (8 segments) qui appartient au genre Alphainfluenzavirus de la famille des Orthomyxoviridae. Le sous-type H5N1 est de ceux susceptibles de provoquer une grippe aviaire transmissible à l'être humain.
La première apparition connue de ce type de grippe chez les humains a eu lieu à Hong Kong en 1997. L’infection des humains a coïncidé avec une épizootie de grippe aviaire, causée par le même agent infectieux, dans les élevages de poulets à Hong Kong. La première série de cas à Hong Kong était aussi un cas groupé familial (cluster) ; deux personnes étaient tombées malades dans la même famille, dont l'une est morte, puis un des enfants est tombé malade et est mort d’une pneumopathie.
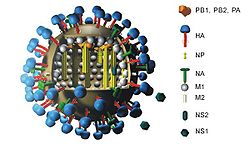
Chez les oiseaux, il existe 16 sous-types de virus grippaux pour l’hémagglutinine. Seuls les sous-types H5 et H7 sont actuellement réputés hautement pathogènes chez les oiseaux.
Chez l’humain, les sous-types de virus grippaux pathogènes ou hautement pathogènes concernent essentiellement les porteurs des antigènes N1 et N2 (qui comprennent la grippe commune saisonnière, et dont proviennent les souches sélectionnées chaque année pour la fabrication des vaccins antigrippaux, le plus souvent du sous-type N2, mais pas encore pour ceux des sous-types H5 moins bien connus). Le virus A (H5N2) est endémique chez de nombreuses espèces d'oiseaux avec des foyers assez fréquents (et une mortalité élevée chez les oiseaux), cependant il est nettement moins pathogène pour l'être humain que le sous-type H5N1 et moins fréquent que les autres sous-types N1.
Ces virus grippaux sont réputés être habituellement transportés à travers le monde dans les intestins des oiseaux sauvages migrateurs. Ils sont très rarement mortels et souvent n’occasionnent pas de symptôme visible. Cependant ce variant (H5N1) est un agent infectieux parmi les plus mortels jamais enregistrés chez les individus infectés. Depuis 1997, il semble avoir élargi la liste de ses cibles.
À ce jour, ce virus ne contamine que rarement les êtres humains, mais avec un taux de mortalité très élevé. Il semble s’être endémisé en Asie et présente donc un risque croissant d’humanisation par mutation pour des populations exposées professionnellement ou vivant de façon intime avec des oiseaux. Le risque de pandémie vient notamment du fait que ce virus de la grippe aviaire peut se recombiner avec un virus de la grippe humaine. De tels cas se produisent naturellement et ont déjà eu lieu dans le passé, tels que la pandémie grippale causée par la grippe espagnole de 1918 qui a tué de 50 à 100 millions de personnes[2].
L'aspect dangereux des variétés H5N1 est lié au fait qu'elles combinent les deux sous-types H et N les plus pathogènes connus pour les humains. En 2008, on ignore encore si leur haut degré de dangerosité permettrait une réelle pandémie, car le développement de la maladie est encore jugé trop rapide pour ne pas être détecté avant de devenir une contagion épidémique interhumaine, cas qui ne s'est pas encore confirmé à ce jour. Une pandémie nécessiterait que la contagion ne puisse être contenue efficacement par la détection et le confinement de nombreux porteurs mobiles non encore malades au sein d'une population assez large et assez concentrée (notamment en milieu urbain). En comparaison, les foyers naissant en milieu rural (plus exposés aux migrations d'oiseaux sauvages contaminés) sont nettement plus faciles à contenir par des mesures sanitaires.
Les vaccins actuellement disponibles ne sont efficaces l’un que pour la grippe humaine (et sous certaines conditions), l’autre que pour la grippe aviaire. Ils ne sont donc a priori peu ou pas efficaces en cas de virus pandémique recombiné.
Au , 109 cas d’infection humaine étaient confirmés, causant le décès de 55 personnes hors de la Chine. Treize pays d’Asie et d’Europe ont été affectés. Aussi, plus de 120 millions d’oiseaux sont morts de l’infection ou ont été euthanasiés.
Au , 171 personnes ont été reconnues infectées dans le monde depuis fin 2003, dont 93 sont mortes. 200 millions d'oiseaux environ ont été victimes du virus ou abattus à titre préventif en Asie, Europe et Afrique, les trois continents affectés. Ce même jour, la France confirme son premier cas aviaire dans l’Ain et l’Inde reconnaît 50 000 oiseaux retrouvés morts au Maharashtra les jours précédents, alors que l’Égypte connaît ses premiers cas de malades humains.
Fin août 2011, la FAO et en France le portail intergouvernemental Risques majeurs signalent une souche mutante du H5N1 apparemment résistante au vaccin, avec des risques imprévisibles pour la santé humaine[3].
Description du virus
[modifier | modifier le code]C'est un virus qui semble apte a la survie dans les milieux aquatiques ou humides complexes[4].
Historique
[modifier | modifier le code]Cas aviaires
[modifier | modifier le code]| Carte mondiale des pays touchés par le virus H5N1 () | |
|---|---|
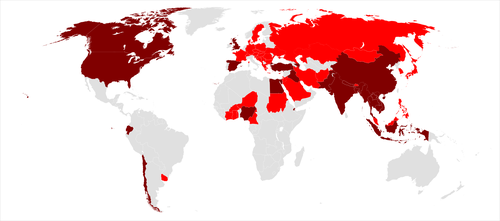 | |
| → Pays dont la volaille ou les oiseaux ont été atteints. | |
| → Pays dont la population humaine a été atteinte. | |
En 2008, le H5N1 est un virus qui cause principalement un type de grippe aviaire (parfois appelé « grippe du poulet », même si elle n'atteint pas que ce volatile). Ce virus est réputé se transmettre d’un oiseau à un autre par contact direct (par exemple lorsque les couples d’oiseaux régurgitent leur nourriture pour l’échanger) ou indirect (lorsqu'ils entrent en contact avec leurs excréments sur l'eau, le lieu de nidification, etc.). De 1997 à 2005, le H5N1 n'a presque uniquement infecté que des oiseaux (volailles essentiellement) en restant confiné à l'Asie du Sud-Est.
La transmission diffusion du virus semble essentiellement due au commerce des volailles, mais les oiseaux sauvages joueraient un rôle potentiellement important si le virus mutait en restant contagieux chez l'oiseau et en le devenant chez l'humain.
Selon une étude[5] publiée en 2008, 6 espèces de canards sauvages ont été testées pour mesurer combien de temps ces oiseaux pouvaient excréter le virus sans succomber à la maladie (après avoir été expérimentalement infectés) ; le canard colvert semble le meilleur véhicule du virus à longue distance (les 5 autres espèces testées sont rapidement mortes du virus et/ou ont développé des symptômes nuisant à leur migration ou survie normale). Dans ce cas, le colvert a été la seule espèce à excréter abondamment le virus sans symptômes.
Ces chercheurs suggèrent donc que, parmi les oiseaux sauvages, le colvert soit prioritairement suivi par les programmes éco-épidémiologiques, car la souche H5N1 s'est en 2008 déjà propagée à plus de 60 pays (via le commerce de volailles et probablement bien moindrement la circulation des oiseaux sauvages), et la plupart des pays peuvent abriter tout ou partie de l’année des populations de colverts (sauvages, domestiques, semi-domestiques).
Cet oiseau, le plus abondant des canards sauvages en Europe (estimation : environ 9 millions d’individus en Europe de l’ouest), est le plus chassé et, étant le plus tolérant à la présence humaine, il est aussi présent dans les espaces publics et basses-cours. D’autres canards, et des oies, cygnes et mouettes jouent aussi un rôle éco-épidémiologique estiment les chercheurs, et on peut les suivre comme « sentinelles » (Chez certains, le H5N1 provoque une grippe « neurologique » affectant leur capacité à nager et voler (les forçant par exemple à nager compulsivement en cercle).
Le H5N1 pouvant infecter de nombreux organes, dont le cerveau, les chercheurs recommandent au moins un frottis de la gorge et du cloaque pour tester les oiseaux vivants, mais aussi une analyse des organes internes (cerveau, pancréas, foie, rein et rate dans le cas où l’animal est déjà mort de mort suspecte ou dans le cas d’une veille éco-épidémiologique).
Histoire de la détection du H5N1
[modifier | modifier le code]Le H5N1 a d'abord été détecté chez quelques oies en Chine en 1996. Quelques cas humains de H5N1 (une variété de grippe de type A) ont été constatés une première fois en 1997 à Hong Kong. La souche H5N1 n’a pas été, comme certains l’ont rapporté de façon erronée, isolée pour la première fois en Afrique du Sud en 1961 (la souche isolée par W.B. Bekker en 1961 était de type H5N3), mais en Écosse en 1959. Le H5N1 HP (hautement pathogène) est le plus souvent très contagieux parmi les oiseaux et provoque des symptômes très sévères, souvent fatals (de 50 % à 80 %), avec de fortes différences de sensibilité selon l'espèce d'oiseau concernée.
Premières émergences en Asie orientale et du Sud-Est
[modifier | modifier le code]La majorité des cas du virus H5N1 a été signalée en Extrême-Orient et en Asie du Sud-Est. Une fois qu’une émergence est détectée, les autorités locales ordonnent souvent une extermination massive des oiseaux et des espèces animales affectées. Si ceci est réalisé très rapidement, le risque d’explosion contagieuse de grippe aviaire peut être contenu. Cependant, l’OMS a exprimé des inquiétudes sur le fait que tous les pays ne communiquent pas les émergences contagieuses aussi complètement qu’ils le devraient. La Chine, par exemple, est connue pour avoir officiellement nié les émergences passées du SRAS et du SIDA.
Au-delà des conditions de promiscuité dans les fermes et marchés animaux, le cas des oiseaux migrateurs est très préoccupant. Durant l’été 2005, des émergences de H5N1 ont été détectées dans le Nord-Ouest de la Chine et la Russie non-européenne. Les médias et certains officiels gouvernementaux européens ont exprimé leur crainte que le virus se dirige vers l’ouest.
La souche H5N1 de grippe aviaire est passée des oiseaux aux humains en 1997 à Hong Kong. Dix-huit personnes furent infectées, dont six sont décédées. La contagion fut limitée à Hong Kong, lorsque tous les poulets du territoire furent exterminés.
En , une nouvelle émergence de grippe aviaire H5N1 a fait surface dans l’industrie avicole du Viêt Nam et de Thaïlande, avant de se propager en quelques semaines vers dix régions ou pays d’Asie comprenant l’Indonésie, la Corée du Sud, le Japon, et la Chine continentale.
Des mesures intensives ont été prises pour exterminer les poulets, canards et oies (rien que pour les poulets, plus de 40 millions ont été éliminés dans les zones hautement infectées) et la contagion a été contenue en mars, mais le décompte total des morts humaines au Vietnam et en Thaïlande a atteint le chiffre de 23 personnes.
Les nouveaux cas de contagion dans la volaille ont été confirmés dans les provinces de Ayutthaya et Pathumthani en Thaïlande et dans la ville de Chaohu dans la région chinoise de Anhui en .
En , la grippe aviaire a été confirmée à Kampung Pasir dans le Kelantan en Malaisie. Deux poulets furent confirmés porteurs du H5N1. Par suite, Singapour a imposé une interdiction d’importation des produits malais à base de poulets et volailles. De façon similaire, l’Union européenne a imposé le bannissement de ces mêmes produits malais. L’élimination de toute la volaille a été ordonnée par le gouvernement malais dans un rayon de 10 km autour des lieux d’émergence contagieuse. Ces mesures semblent avoir réussi et depuis lors, Singapour a levé l’interdiction et la Malaisie a demandé à l’Office international des épizooties (OIE) de déclarer la volaille malaisienne exempte de grippe[6].
Une autre émergence de grippe aviaire en a touché 33 des 64 cités et provinces du Viêt Nam, conduisant à l’élimination forcée de près de 1,2 million de volailles. On estime que plus de 140 millions d’oiseaux sont morts ou ont été tués à cause de l’émergence contagieuse.
En , la plupart des cas humains de grippe aviaire en Asie orientale sont attribués au contact rapproché avec des volailles infectées. La transmission de personne à personne n’a pu être confirmée dans l’Est de l’Asie.
Phase 2 d’alerte mondiale et cas en Asie Centrale
[modifier | modifier le code]Également au début du mois d’, une émergence de grippe A (H5N1) a été confirmée au Kazakhstan et en Mongolie, ce qui suggère une extension de la zone contaminée par le virus[7]. Plus tard en août, le virus a été trouvé en Russie occidentale, faisant sa première apparition en Europe. Par suite, les autorités néerlandaises ont ordonné que les volailles en liberté devraient être enfermées dans des espaces couverts[8]. Les officiels de l’Union européenne ont choisi de ne pas imposer pour l’instant une telle mesure aux pays membres.
Les officiels du gouvernement chinois ont rapporté que plus de 1 000 oiseaux migrateurs ont été trouvés morts en 2005.
Phase 3 d’alerte mondiale et cas au Moyen-Orient, Europe Orientale et Afrique
[modifier | modifier le code]À la fin de , le chargé de mission à l’ONU pour la santé, David Nabarro, responsable de la coordination d’une réponse en cas d’émergence contagieuse, a établi qu’une pandémie grippale pouvait maintenant survenir à tout moment et pourrait tuer en quelques mois de 5 à 150 millions de personnes. Il a également déclaré que puisque le virus s’est transmis aux oiseaux migrateurs, l’émergence pandémique pourrait survenir en Afrique ou au Moyen-Orient, plutôt qu’en Asie du Sud-Est comme on l’avait supposé jusqu’à présent. Dans le même temps, les ministres de l’agriculture de l’ASEAN ont annoncé un plan de trois ans pour contrer la dissémination de la maladie[9].
Au début du mois d’, les officiels roumains ont mis en quarantaine Ciamurlia, un village sur le delta du Danube où vivent 30 personnes, après que les analyses de trois canards morts ont confirmé qu’ils étaient bien infectés par le H5N1. Cependant, il n’y a eu aucun cas de malade rapporté dans le village. Le ministre de l’Agriculture a dit que le virus trouvé chez les canards élevés dans la ferme provenait d’oiseaux migrateurs venus de Russie[10]. En attendant une confirmation de la part des scientifiques, c’est la première fois que le virus a été détecté en Europe. Six villages ont par suite été placés en quarantaine après la mort d’oiseaux domestiques, et plus de 220 oiseaux ont été tués.
Le , le Commissaire européen à la santé Markos Kyprianou a confirmé que les analyses des dindes trouvées mortes dans des fermes de Kiziksa en Turquie ont montré qu’elles étaient mortes de la souche H5N1. Avant même que ces résultats d’analyse soient connus, quelque 5 000 oiseaux et volailles ont été éliminés dans la zone infectée. Une hypothèse est que la maladie a été apportée par des oiseaux migrateurs venus nicher dans le sanctuaire d’oiseaux du lac de Manyas (zone Ramsar), à quelques kilomètres de la ferme infectée, ou de passage lors de leur migration vers l’Afrique (ils sont particulièrement nombreux en cette saison).
Des analyses similaires sur les trois canards trouvés morts en Roumanie ont depuis révélé que les morts étaient causées par une souche de grippe H5, laissant suspecter le virus H5N1. Ces nouvelles ont créé un début de panique en Turquie, où les habitants ont cherché à se procurer des antiviraux dans les pharmacies, alors que partout en Europe, les gouvernements prenaient des mesures de contingentement immédiat, et créaient une réserve de médicaments avec l'objectif de pouvoir traiter l’ensemble de la population des régions infectées.
Fin 2005, début 2006, les experts exprimaient des craintes croissantes concernent l’Afrique où les échanges commerciaux et les oiseaux migrateurs pouvaient contaminer la volaille ou d'autres espèces migratrices. Certains craignaient que la prochaine région touchée fût les vallées du Nil de l’Égypte au Soudan et du Niger, puis les régions subsahariennes où migrent également nombre d’espèces européennes durant l’hiver. Le foyer pouvait alors s’installer et se développer en Afrique centrale, où les moyens de lutte sont très insuffisants, notamment dans des régions déjà durement touchées par la famine ou des conflits politiques et ethniques (Nigeria, Niger, Rwanda, Somalie) perdurent. On craignait notamment que des fermiers locaux touchés revendent les oiseaux morts sur les marchés, contaminant directement la population, l’extermination systématique des oiseaux et le manque d’indemnisation des éleveurs causant de sérieux problèmes alimentaires et économiques dans des régions déjà très démunies. Les premiers cas de la grippe sont apparus début au Nigeria.
Sous l'égide de l'OMS et de la FAO qui ont aussi appelé à aider l'Afrique, les États européens se sont préparés à un possible retour du virus en Europe printemps 2006 lors de la remontée des oiseaux migrateurs, faisant une priorité de la constitution de stocks de médicaments, suffisants pour traiter des millions de personnes au cas où une mutation du virus le rendrait plus adapté à l'être humain.
Le déplacement des principaux foyers aviaires vers des régions pauvres, en guerre ou politiquement instables (Afghanistan, Pakistan, Irak, Syrie, Est de la Turquie, etc.) où les mesures d'isolement épizootiques sont confrontées à des difficultés économiques locales (notamment pour l'indemnisation des éleveurs locaux) a incité les gouvernements occidentaux et l'Union européenne à fournir une assistance d'urgence à ces pays. Cette assistance immédiate sur les lieux de primo-infection devant s'avérer bien moins coûteuse (économiquement et écologiquement) et plus efficace que des mesures prises plus tardivement si l'épizootie se répand, devenant difficilement contrôlable. Le premier cas mortel confirmé chez l’humain dans cette zone en Irak est très significatif de l’influence de la situation économique et politique sur le manque d’efficacité des mesures sanitaires dans ces régions instables et pauvres.
Union européenne, Association européenne de libre-échange et ex-Yougoslavie
[modifier | modifier le code]Le , des oiseaux morts en Croatie et en Macédoine sont suspectés d'être atteints. Des analyses sont en cours.
Le , la Grèce annonce un cas confirmé de virus H5 concernant des dindons morts sur l'île de Chios, en mer Égée, le premier du genre dans un pays de l’Union européenne. Cependant les analyses plus poussées montrèrent que ce cas n'est pas lié au virus H5N1, mais à une forme moins virulente sans danger pour l’humain.
Une réunion de responsables de la santé européens à Londres signala que tous les pays membres de l’Union n'étaient pas préparés de façon égale à une pandémie. Si le Royaume-Uni craignait la pénurie, la France avait pris de l’avance sur ses voisins en commandant très tôt des millions de boîtes de médicaments antiviraux, des centaines de millions de masques de protection, en organisant à l’avance leur stockage et la distribution gratuite sur l'ensemble du territoire par les services sociaux et sanitaires, et en provisionnant plus de 200 millions d’euros pour les besoins complémentaires.
Elle mit d’autre part en place des laboratoires d’analyse et une surveillance accrue dans les zones les plus exposées, en particulier à l’embouchure de la Loire, en Camargue, et dans le Sud-Ouest (lieu de passage et de nidification d’oiseaux migrateurs, et aussi région d’élevage d’oies et canards). Elle organisa au début du mois de novembre en Bretagne (région d’élevages importants de volailles et de passage des espèces migratoires maritimes), un exercice d’alerte de façon à mesurer l’efficacité des mesures prises et la collaboration des différents services locaux.
Mais d'autres pays européens, placés en cœur de l’Union européenne bien que n’en faisant pas partie, sont mal lotis et pas préparés tels que la Bosnie-Herzégovine et la Macédoine qui pourraient être exposées très tôt. On ne dispose aussi d'aucune information publique concernant les mesures sanitaires préventives prises par la Serbie-et-Monténégro. Pour ces raisons, les pays européens semblent d’accord pour se prêter mutuellement assistance en fonction de l’évolution et de la répartition des besoins, collaborer par l'échange rapide d’informations, et soutenir et compenser financièrement les coûteuses mesures sanitaires.
Le premier cas de virus aviaire H5N1 confirmé le dans l’Union européenne est un perroquet importé d'Asie, trouvé mort durant sa quarantaine. Tous les volatiles présents dans la zone de quarantaine ont été abattus. Le Royaume-Uni n’est pas officiellement touché, la quarantaine ayant eu lieu dans une zone internationale bien isolée du reste du territoire. Le Royaume-Uni milite maintenant pour l’interdiction des importations d’oiseaux exotiques (mais les experts craignent qu’une telle interdiction mène au développement d’un trafic bien plus difficile à contrôler, car sans surveillance sanitaire officielle). Il a été confirmé ensuite que ce n'était pas le perroquet du Surinam qui était en cause, mais des canaris en provenance du Sud Est asiatique en quarantaine avec le perroquet.
Le , la France ordonne à 21 départements qui se trouvent dans les zones de migrations des oiseaux d'enfermer les animaux de la basse-cour (poules, canards, oies, etc.).
Le , des oiseaux morts en Italie et en Grèce sont atteints. La France étend sa zone de confinement à 56 départements, la Slovénie prend des mesures.
Le , en France, découverte du premier cas de virus H5N1 confirmé, sur un canard sauvage trouvé mort à Joyeux dans l'Ain.
Le , des oiseaux morts en France, en Allemagne, en Autriche et en Slovénie sont atteints par le virus. La France étend sa zone de confinement à toute la France de même pour l'Italie, l'Allemagne, les Pays-Bas, la Belgique, l'Autriche, etc.
Le , en Allemagne, il y a 40 cas de grippe aviaire avérés.
Le , en France, deuxième canard sauvage porteur du H5N1 retrouvé mort, à Bouvent dans l'Ain.
Le , en France, contagion dans un élevage de 11 000 dindes dans le département de l'Ain. Au moins 400 dindes sont mortes du virus H5N1, les autres ont été abattues. L'exploitation a été placée en isolement.
Le , en Suisse, dans le canton de Genève, le premier cas de canard sauvage est déclaré touché par le virus hautement pathogène H5N1. Le Conseil fédéral (gouvernement suisse) annonce en cas de pandémie, non avéré à ce jour, un maximum de 10 000 morts et de deux millions de personnes qui pourraient être contaminées. 32 cas confirmés au . Le confinement des volailles sera levé le lundi 1er mai.
Le , dans le nord de l'Allemagne, un chat mort a été retrouvé, il a été infecté par le virus H5N1. On ne sait toujours pas comment le félidé a attrapé la maladie avant de mourir.
Le , la grippe aviaire fait son apparition en Pologne : le laboratoire national polonais de Pulawy, dans l'est du pays, confirme le premier cas du virus H5N1 détecté dans le pays.
Le , la grippe aviaire tue un premier chien en Azerbaïdjan, après le décès de trois humains selon le blog H5N1 mutation[11].
Le , le H5N1 tue 1 000 oiseaux en Israël[12], ce qui est préoccupant car la séquence H9N2 est également présente en Israël et les risques d'une recombinaison avec la séquence S227N (séquence pour la transmission humaine), séquence déjà détectée en Turquie, et donc une recombinaison serait d’autant plus facilitée.
Chez les mammifères
[modifier | modifier le code]Il est scientifiquement démontré (2012) que le H5N1 peut être facilement transmis d'un mammifère à un autre par voie aérienne. Les Pays-Bas ont proposé () une conférence internationale sur les recherches sur les travaux controversés[13] de chercheurs américains et néerlandais (de Rotterdam)[14]
Cas porcins
[modifier | modifier le code]En , le virus grippal aviaire a été détecté chez le porc au Viêt Nam, ce qui a accru les craintes d’émergence de nouvelles variantes infectieuses.
En , les cas de grippe aviaire chez le porc ont été détectés en Indonésie (« peste porcine » pathogène). Au même moment que la circulation continue du virus dans les élevages aviaires, les cas porcins ont accru le niveau de préoccupation sur l’évolution possible du virus en un agent infectieux capable de déclencher une pandémie grippale humaine à l’échelle mondiale. Les experts de la santé disent que les porcs peuvent transporter les virus grippaux humains qui peuvent se combiner facilement (c'est-à-dire échanger des sous-unités génomiques homologues par réarrangement génétique) avec le virus aviaire, échanger des gènes et muter en une forme facilement transmissible aux humains.
Le , l’OMS a indiqué qu’elle suivait très attentivement les rapports de la Chine sur le cas des 38 personnes décédées et plus de 200 autres malades infectés par une maladie d’origine porcine dans la province du Sichuan. Cette province, où des infections de bacille streptocoque ont été détectées chez le porc dans une émergence concurrente, à l’une des plus grandes populations porcines chinoises. L’émergence contagieuse chez les humains a quelques caractéristiques inhabituelles qui sont attentivement surveillées par l’OMS. Jusqu’à présent, les autorités chinoises affirment n’avoir trouvé aucune évidence de transmission interhumaine[15].
Rôle du porc
[modifier | modifier le code]L’hypothèse la plus couramment admise au tournant de l’an 2000, malgré un épisode au cours duquel les êtres humains ont été directement contaminés par des volailles infectées, plaçait l’espèce porcine au cœur des événements qui conduisent à l’émergence de nouveaux virus humains. C’est ainsi, à cause du porc que serait apparu le sous-type A (H3N2) vers 1968, en Asie, par remplacement notamment de la molécule H2 d’un virus humain A (H2N2) par une molécule de type H3 provenant, selon une étude phylogénétique, d’un virus de canard sauvage.
Les régions de porcheries industrielles sont alors à considérer comme zones à risques, surtout à proximité de poulaillers, de zones humides, sur des trajets de migration aviaire ou en zone urbanisée. (Bretagne, nord de la France, Belgique, etc.).
Néanmoins, la part de responsabilité du porc, reste discutée : « On soupçonne le porc d'être l'hôte intermédiaire lors d'un échange génétique entre les virus grippaux aviaires et humains, mais on n'en possède pas la preuve expérimentale[16]. »
Celle du sanglier et des suidés sauvages en général n’est que très rarement évoquée, mais elle mérite de l’être, notamment en France, parce que les populations de sangliers favorisées par les plans de chasse et abondamment nourries en forêt, y ont fortement augmenté, comme dans plusieurs pays voisins… D’autant qu’ils n’y ont plus d’autres prédateurs que l’être humain et semblent localement connaître des problèmes génétiques liés à la consanguinité ou au peuplement par l’introduction d’espèces hybrides issues de croisements plus ou moins récents avec le cochon domestique.
Le porc (peut être aussi dans certains cas, via les lisiers ? via les mouches ?) semblait être l’intermédiaire obligatoire ou privilégié entre l'oiseau et l'être humain. Il constitue un creuset idéal à la recombinaison du virus, car il est à la fois sensible aux virus aviaires et aux virus humains.
L’épisode de « la grippe du poulet » survenu à Hong Kong en 1997 a cependant montré que des virus aviaires pouvaient directement provoquer des cas humains de grippe, parfois sévères et mortels.
Cas humains
[modifier | modifier le code]De début 2003 au 25 mars 2024, un total de 888 cas humains d’infection par la grippe A(H5N1), dont 463 décès, ont été notifiés à l’OMS dans 23 pays soit un taux de létalité de 52% [17].
| Total des cas humains confirmés par laboratoire d’infection à la grippe aviaire de type A (H5N1) selon l’Organisation mondiale de la Santé (OMS) | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Pays |
Dates de confirmation depuis le 26 décembre 2003 | Totaux au 22 juin 2011 | |||||||||||||||||||
| 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | |||||||||||||
| cas | décès | cas | décès | cas | décès | cas | décès | cas | décès | cas | décès | cas | décès | cas | décès | cas | décès | cas | décès | ||
| 8 | 5 | 8 | 5 | 62,5 % | |||||||||||||||||
| 1 | 0 | 2 | 0 | 3 | 0 | 0,0 % | |||||||||||||||
| 1 | 0 | 1 | 0 | 0,0 % | |||||||||||||||||
| 4 | 4 | 2 | 2 | 1 | 1 | 1 | 0 | 1 | 0 | 1 | 1 | 6 | 6 | 16 | 13 | 81,2 % | |||||
| 1 | 1 | 8 | 5 | 13 | 8 | 5 | 3 | 4 | 4 | 7 | 4 | 2 | 1 | 40 | 26 | 65,0 % | |||||
| 1 | 0 | 1 | 0 | 0,0 % | |||||||||||||||||
| 18 | 10 | 25 | 9 | 8 | 4 | 39 | 4 | 29 | 13 | 31 | 12 | 150 | 52 | 34,7 % | |||||||
| 20 | 13 | 55 | 45 | 42 | 37 | 24 | 20 | 21 | 19 | 9 | 7 | 7 | 5 | 178 | 146 | 82,0 % | |||||
| 3 | 2 | 3 | 2 | 66,7 % | |||||||||||||||||
| 2 | 2 | 2 | 2 | 100,0 % | |||||||||||||||||
| 1 | 1 | 1 | 1 | 100,0 % | |||||||||||||||||
| 3 | 1 | 3 | 1 | 33,3 % | |||||||||||||||||
| 17 | 12 | 5 | 2 | 3 | 3 | 25 | 17 | 68,0 % | |||||||||||||
| 12 | 4 | 12 | 4 | 33,3 % | |||||||||||||||||
| 3 | 3 | 29 | 20 | 61 | 19 | 8 | 5 | 6 | 5 | 5 | 5 | 7 | 2 | 119 | 59 | 49,6 % | |||||
| Total | 4 | 4 100 % |
46 | 32 69,6 % |
98 | 43 48,9 % |
115 | 89 77,4 % |
88 | 59 67,0 % |
44 | 33 75,0 % |
73 | 32 43,8 % |
48 | 24 50,0 % |
46 | 23 50,0 % |
562 | 329 | 58,5 % |
| Source officielle : (en) Cumulative Number of Confirmed Human Cases of Avian Influenza A/(H5N1) Reported to WHO. | |||||||||||||||||||||
Ce virus semble capable de déjouer le système immunitaire et de se déplacer dans l'organisme en s'y faisant transporter par des globules blancs. Il peut ainsi franchir les barrières méningées du cerveau et les barrières placentaires. Sauf chez le fœtus semble-t-il (en raison d'un système immunitaire immature), il déclenche une tempête de cytokines qui provoque une autodestruction des organes touchés (comme dans le cas du SRAS). Les épidémiologistes craignent que le H5N1 mute de façon à passer facilement d’un humain à l’autre. Si une telle mutation se produit sans que le H5N1 perde de sa virulence, une pandémie pourrait survenir, avec un nombre de morts rivalisant avec celui de la pandémie de grippe espagnole de 1918.
L’agent infectieux aviaire H5N1 est passé des oiseaux aux humains en 1997 à Hong Kong. Dix-huit personnes ont été infectées, dont six sont décédées. L’alerte était limitée à Hong Kong. Toutes les volailles sur le territoire avaient été éliminées.
Les statistiques de l’OMS au [18] indiquaient que la grippe aviaire H5N1 chez les humains avait causé la mort de 60 personnes sur un total de 117 cas humains, tous ces cas étant situés en Asie du Sud-Est, et pour la plupart on a pu démontrer qu’ils ont été contractés au contact des volailles.
Toutefois, à cause de l'influence croissante des recombinaisons virales en cours, des spécialistes de plus en plus nombreux critiquent l’exactitude ou la complétude des données fournies par l’OMS, et publient leurs propres cartes d’expansion des cas d’exposition humains et animaux[19], notamment en Mongolie, le long de la frontière du Kazakhstan et de la Russie, ou dans toute la vallée du Nil en Égypte, et tout l'ouest du Sahel. Hors s’il y a recombinaison (le scénario maintenant davantage craint que les mutations), les modes et vecteurs de contamination peuvent en être complètement modifiés, la mortalité et la morbidité réduites (et l’incubation prolongée), ce qui rend alors la partie dangereuse du virus recombiné nettement plus dangereuse et capable de se transmettre entre d’autres espèces animales, y compris l’être humain.
Aussi, bien que certains cas humains aient été confirmés par des représentants de l’OMS, ils proviennent uniquement de rapports transmis par des autorités nationales, mais sans confirmation par une analyse de prélèvement dans un laboratoire de référence agréé par l’OMS (deux laboratoires dans le monde sont actuellement reconnus, un au Royaume-Uni, l’autre en Australie), sans certitude démontrée de la similitude des cas relevés dans ces pays avec les souches virales reconnues. Ces cas ne sont pas à exclure, mais n’identifient pas forcément une souche hautement pathogène de virus grippal d’origine aviaire, ils ne sont donc pas comptabilisés officiellement par l’OMS.
En , des scientifiques affirment avoir testé avec succès sur les humains un vaccin censé protéger contre une souche de virus aviaire qui se propage chez les oiseaux d’Asie et de Russie. Le virus de grippe A (H5N1) a infecté près de 100 humains durant les 18 mois passés, tuant près de la moitié d’entre eux. Si le virus commence à se propager efficacement parmi les humains, les experts craignent qu’il puisse déclencher une pandémie mondiale qui tuerait des millions de personnes. En réponse, des millions d’oiseaux ont été abattus partout en Asie orientale afin de contenir la diffusion du virus.
Les gouvernements et l’Organisation mondiale de la santé ont constitué des stocks de médicaments antiviraux, et les scientifiques se sont mobilisés pour produire un vaccin efficace. En raison du délai nécessaire (environ quatre mois) à la production en masse d’un vaccin qui pourrait protéger d’une pandémie grippale humaine, le Dr. Anthony S. Fauci, directeur du National Institute of Allergy and Infectious Diseases aux États-Unis, a annoncé que les États-Unis commanderont des doses supplémentaires du vaccin destinées à contenir une pandémie humaine, si elle devait se produire[20].
Transmission et infection
[modifier | modifier le code]La transmission du H5N1 se fait par un contact étroit ou prolongé entre un humain et une volaille. Les oiseaux s'infectent entre eux en partageant de la nourriture (un des oiseaux doit être contaminé), ils régurgitent leur nourriture et donc se transmettent le virus, ils peuvent aussi se contaminer en entrant en contact avec les excréments d'un contaminé.
Un cas de transmission d’être humain à être humain a été confirmé en [21], mais le virus n'est pas hautement contagieux dans l'espèce humaine[22].
Via l'oiseau et d'autres animaux
[modifier | modifier le code]L'oiseau infecté sécrète le virus principalement par les fientes, mais aussi en phase finale via toutes les autres sécrétions (salive, sécrétions nasales). D'autres oiseaux peuvent contracter le virus par contact direct avec ces excrétions ou quand ils entrent en contact avec les surfaces souillées par ces matériaux.
Une étude[23] a précisé le rôle des oiseaux migrateurs comme réservoir ou transporteurs de la grippe aviaire. 18 espèces de canards, oies et cygnes ont été inoculées avec 4 souches différentes de H5N1. L'infection asymptomatique (excrétion de H5N1, sans aucun signe clinique) a été en moyenne de 4 jours[23]. Un suivi télémétrique (balise Argos) effectué en Asie, Afrique et Europe durant 3 ans (2006 - 2009), pour 228 oiseaux appartenant à 19 espèces, a montré que la distance maximale parcourue durant la phase d'infection asymptomatique variait de 300 à 1700 km en migration selon les espèces (jusqu’à 2900 km pour certains oiseaux). Les oiseaux qui ont volé sur de très longues distances l'ont fait sur des temps très courts espacés de longues périodes de repos[23].
Selon ces données, un oiseau migrateur moyen ne pourrait disperser le H5N1 sur 500 km que durant les 5 à 15 jours par an où il est infecté. Les oiseaux infectés asymptomatiquement risquent peu de propager le virus sur de grandes distances, car les vols migratoires sont séquencés en vols rapides de 1 à 4 jours, espacés de périodes de repos plus longues que les périodes d’infection. La dispersion intercontinentale nécessiterait alors une infection successivement relayée par plusieurs oiseaux migrateurs infectés. Ces résultats se fondent cependant sur l'hypothèse que les oiseaux en liberté et captifs répondent de la même manière à l'infection, que l'infection asymptomatique ne modifie pas les forces ou aptitudes à se déplacer, qu'il n'y a pas d'immunité préexistante et que le virus ne peut être transporté dans les plumes tout en gardant son pouvoir infectant[23]. Cette étude conclut que des oiseaux migrateurs peuvent transporter le H5N1 sur de longues distances (centaines à milliers de km), mais avec une probabilité très faible que cela se produise à l’échelle individuelle[23].
La plupart des experts admettent d'ailleurs maintenant que le risque maximal est lié aux canards et volailles d'élevage. D'autres espèces (cochon, chat, chien, mustélidés, rats et souris, voire des insectes..) pourraient aussi être impliqués en cas de pandémie. En laboratoire ou dans la nature, ces espèces se sont montrées sensibles au H5N1. Le chat domestique et le chien pourraient déjà avoir été des vecteurs possibles d’infection aux souches H5N1 de grippe aviaire (Kuiken et al, 2004, cas de chiens infectés en Thaïlande).
Des oiseaux sauvages s'alimentant à proximité de zones d'élevages peuvent ensuite véhiculer le virus sur de longues distances[24]. Selon une étude publiée en 2011, il semble que le lac Qinghai soit une zone carrefour pour le H5N1 et sa diffusion[24].
Exposition humaine
[modifier | modifier le code]Les dernières grippes pandémiques, probablement d'origine aviaire et/ou porcine, semblent être nées dans des zones et conditions de forte promiscuité, dans les régions densément peuplées de l’est et du sud-est asiatique. Elles nécessitent l'apparition d'un virus mutant, éventuellement très pathogène, mais surtout très contagieux.
Début , un seuil d’alerte a largement été dépassé concernant la pathogénicité avec 148 vies humaines perdues sur 253 cas confirmés – principalement d'abord au Viêt Nam puis en Indonésie. La plupart de ces cas semblent liés à un contact avec des volailles infectées ou des surfaces souillées. Au Vietnam, trois frères sont tombés malades après avoir consommé une soupe crue de sang de canard, ce qui a reposé la question des modes de transmission du virus et des risques liés aux animaux domestiques ou à d’autres espèces relais potentielles en cas de début de pandémie. Parmi une trentaine de cas de transmission interhumaine possibles, un seul a été démontré avec certitude. Pour les autres, il reste toujours un doute, le virus pouvant provenir des volailles de l'environnement familial ou de fientes d'oiseaux.
Mi 2006, ce virus est resté peu contagieux entre humains. Mais la promiscuité des humains avec les poulets vivants, les porcs et d’autres animaux dans certaines fermes ou marchés continue à favoriser les échanges de matériels génétiques entre le virus H5N1 et d’autres souches virales affectant facilement les humains ou le porc. Au-delà des cas humains confirmés, une cause d’alarme est la persistance de foyers chez les volailles principalement dans quelques pays d’Asie après que le Cambodge, la Chine, l’Indonésie, le Japon, le Laos, la Corée du Sud, la Thaïlande et le Viêt Nam ont été touchés.
Actuellement[Quand ?], la transmission interhumaine du virus A/H5N1 reste un évènement rare même si le premier cas de contamination inter-humaine a été rapporté au Viêt Nam au cours de l’année 2005. La grande virulence de ce virus chez l'animal fait craindre que le virus A/H5N1 soit particulièrement pathogène pour l'être humain s'il venait à acquérir des caractéristiques pandémiques. Le Viêt Nam et la Thaïlande ont connu des cas isolés sévères où une transmission d’être humain à être humain a été suspectée. Dans un cas, le porteur d’origine, qui avait reçu la maladie d’un oiseau, a été porté par sa mère durant 5 jours alors que la jeune fille était décédée. Peu après, la mère est tombée malade et a péri également. En , les tests d’infection de deux infirmières qui avaient traité des patients atteints de grippe aviaire se sont révélés positifs.
Ce qui préoccupe maintenant les chercheurs en santé est que le taux de mortalité du virus au Viêt Nam a chuté dernièrement de façon significative, de plus de 65 % à 35 % en seulement un an. Puisque le virus peut alors survivre plus longtemps avec les patients qu’il infecte, cela signifie que le virus pourrait infecter un nombre bien plus élevé de personnes, et pourrait se développer en pandémie mondiale avec des millions de morts, en dépit d’un pourcentage rapporté plus faible de mortalité. Par exemple, la mortalité de la pandémie de grippe espagnole de 1918 (de type H1N1) était inférieure à 5 %[25] mais a pourtant fait plus de victimes que la Première Guerre mondiale. Cela semble indiquer que le virus a muté en une variété permettant une contagion plus étendue.
En , un homme à Jakarta a été le premier cas fatal confirmé en Indonésie. Mais le décès ultérieur de ses deux fils, dont aucun n’était en proche contact avec de la volaille vivante, a accru l’inquiétude d’une transmission inter-humaine[26].
Bien que la Chine n’ait pas encore rapporté de décès humains, des rapports non officiels sur Internet en 2005 font état de 120 décès humains apparentés. Ces rapports sont fermement dénoncés par Pékin. Les Nations unies ont critiqué le gouvernement chinois pour avoir caché des informations vitales dans la lutte contre le virus, comme il l’a fait lors de l’émergence du SRAS.
En , un garçon de 14 ans et sa sœur de 15 ans, originaires de Dogubeyazit, un village proche de la frontière avec l'Iran, en Turquie sont les premiers humains décédés d'infection à H5N1 hors Asie de l'Est. La sœur des deux premières victimes, âgée de 11 ans et traitée depuis plusieurs jours dans un service de soins intensifs, est décédée vendredi matin à l'hôpital de Van. Les enfants de cette famille ont été contaminés en jouant avec des têtes de poulets morts, ce qui expliquerait pourquoi leurs parents n'ont pas été infectés.
Le mardi , la Turquie recense son 15e cas supposé (non encore confirmé par le laboratoire de référence de l’OMS) de contamination humaine par le virus H5N1 de la grippe aviaire. Il s'agit d'une femme de Sivas (centre-est) testée positive et qui se trouvait dans un état stable. L'OMS indique n'avoir constaté pour le moment aucun signe de transmission de la grippe aviaire d'être humain à être humain : Nous n'avons aucun élément aujourd'hui à l'appui d'une transmission de l'homme à l'homme, mais tout cela reste préliminaire, a déclaré mardi le chef de la délégation d'experts en Turquie, le Dr Guenaël Rodier.
La confirmation des chiffres d'exposition se confronte d'autre part à de nouvelles difficultés, car des mutations génétiques (encore mineures) du virus semblent avoir été observées dans la récente souche à l’est de la Turquie, ce qui semble confirmer l’existence d’une mutation amorcée en Indonésie, avec une mortalité humaine nettement plus faible et une incubation plus longue, ce qui accroît le risque. Certains cas ont pu faire croire à un mode de transmission différent à l'être humain, mais des enquêtes épidémiologiques plus poussées ont pu montrer l'existence de foyers aviaires (petits élevages urbains) non déclarés à proximité de lieux d'habitation. Enfin, des recombinaisons avec H1N1 (celui semble-t-il de la pandémie de grippe humaine de 1918) semblent être observées en Israël ou Palestine et cette mutation se prolonge dans la vallée du Nil en Égypte où l’identification précise est plus difficile du fait de l’existence désormais chronique de souches d’autres virus de même famille et aux effets assez similaires sur l’être humain et les espèces équidés.
Transmission au fœtus
[modifier | modifier le code]Le virus de la grippe saisonnière est réputé épargner le fœtus même en cas de grippe sévère de la mère[27]. Mais – au moins dans certains cas – les virus hautement pathogènes semblent pouvoir franchir la barrière placentaire.
En 2007, un rapport d'autopsie[28] a pour la première fois décrit le cas d’un fœtus humain atteint par le H5N1 (celui d’une chinoise de 24 ans, morte du H5N1 HP 9 jours après les premiers symptômes et alors qu’elle était enceinte). L’autopsie a confirmé la présence de virus H5N1 (ou plus précisément de matériel génétique viral, ou d'antigène), dans le placenta, dans le foie du fœtus et surtout dans ses poumons où il a cependant provoqué bien moins de dégâts que dans ceux de la mère. Les scientifiques suggèrent que ces faibles dommages puissent être expliqué par l’immaturité du système immunitaire du fœtus, qui ne produit pas de tempête de cytokines et chemokines face à l’agression virale. Chez la mère ce sont les poumons, mais aussi la trachée, les intestins, les ganglions et le cerveau qui étaient touchés.
Infection intestinale
[modifier | modifier le code]70 % des malades du H5N1 sont victimes de diarrhées. Plusieurs études, analyses et autopsie, sur l'animal ou l'être humain montrent que l'intestin, comme chez l'oiseau peut être infecté par le virus ; c'est un fait important sur le plan du risque de contagion et de l'éco-épidémiologie puisque des quantités importantes de virus pourront se retrouver dans les égouts en cas de début d'épidémie (Rats, mouches, moustiques, etc. pourraient alors le transporter, et l'on peut craindre une transmission de type gastroentérite si le virus mutait pour devenir très contagieux). En 2007, le Pr Gu a aussi détecté le virus dans les fèces et le sang d'un enfant atteint de diarrhée avant d'entrer dans une phase de coma[29].
Prédispositions génétiques
[modifier | modifier le code]Certains gènes humains semblent prédisposer à l'infection et peut-être à une réaction plus violente au virus. Une étude[30] a porté sur les 261 premiers cas humains confirmés à partir de . L'OMS a reconnu parmi eux 36 clusters (cas groupés) familiaux documentés (1,2). Chaque cluster réunissait de 2 à 8 personnes infectées. Seuls 4 clusters étaient composés de 2 personnes non génétiquement apparentées (mari et femme).
Modes de transmission
[modifier | modifier le code]Transmission du virus A/H5N1 entre animaux
[modifier | modifier le code]La transmission directe est efficace pour la transmission entre oiseaux. Elle est également efficace vers d'autres espèces d'oiseaux vers d'autres espèces animales. On sait depuis 1995 au moins que les fientes d’oiseaux sont probablement la 1re source de contamination. Elles contiennent jusqu’à 107 particules virales infectieuses par gramme[31]. On a pu montrer que la consommation de volaille crue par des félidés en Thaïlande (en zoos ou par les chats domestiques) peut infecter ces animaux. Des cas de transmission de félin à félin ont été constatés, probablement par ingestion ou inhalation de rejets pharyngés ou de particules lorsque les animaux se lèchent, se lèchent le dessous des pattes, par inhalation de virions, ou par inhalation ou ingestion de rejet gastro-intestinaux via la nourriture qu'ils se partagent ou se disputent. La transmission par voie salivaire est hautement probable.
Transmission du virus A/H5N1 de l'animal vers l'humain
[modifier | modifier le code]Classiquement, la transmission interhumaine des virus grippaux se fait lorsqu’un individu infecté génère à la faveur d’éternuements des aérosols (moins de 5 microns de diamètre) permettant au virus d’atteindre le nasopharynx et les bronchioles. Elle se fait également par l’inhalation de gouttelettes de Pflügge (parole), la toux (plus de 5 microns de diamètre) et le contact direct qui ne permettent alors au virus qu’une atteinte des voies respiratoires supérieures. La dose infectante est environ 100 fois plus faible dans le cas d’une transmission par aérosols (qui est de l’ordre de quelques doses infectieuses).
Le virus A/H5N1 se transmet difficilement à l'être humain, il est présent essentiellement chez les animaux qui en constituent le réservoir viral. La transmission à l'humain se fait par contact direct et indirect avec des animaux infectés : lors de l'abattage, du dépeçage ou du plumage d'oiseaux porteurs du virus, de la manipulation de volailles infectées non cuites, au contact du sang d'oiseaux infectés. La consommation de viande de volaille cuite à une température supérieure à 70 °C (les différentes parties de la volaille doivent être cuites) ne présente aucun risque. Par contre, la congélation des volailles ne détruit pas le virus. En 1997, les premiers cas humains d'infection par le virus A/H5N1 sont apparus chez des personnes vivant ou travaillant au contact étroit d'oiseaux. Dix-huit cas d’infections humaines par le virus A/H5N1 ont été décrits à Hong Kong, en 2004, 44 cas sont survenus en Thaïlande suggérant un certain degré d'adaptation du virus à l'être humain. Les professionnels qui se sont occupés de l'abattage des oiseaux infectés ont présenté une séroconversion vis-à-vis du virus A/H5N1 sans développer de signes cliniques d'infection respiratoire[32]. Actuellement[Quand ?], la transmission interhumaine du virus A/H5N1 reste encore limitée. Elle semble le résultat de contacts intimes et répétés avec des animaux ou des sujets infectés. Un seul cas de transmission interhumaine a été documenté chez un enfant de onze ans décédé d'une pneumopathie due au virus A/H5N1. Sa mère et sa tante qui avaient prodigué les soins ont très probablement été contaminées au cours de ces soins puisque l’enquête épidémiologique n'a pas montré de contact étroit avec des volailles[33].
La transmission de l'environnement à l'humain est probablement le mode majeur de contamination via l'inhalation de particules issues de fientes de volaille ou d'oiseaux, via l'ingestion d'eau contaminée Il semble que la principale voie d'infection environnementale soit l'infection par des mains contaminées qui sont portées à la bouche, au nez ou aux yeux.
Le risque pandémique, s’il existe, s’est-il accru d' à ? Il semble qu'en Turquie le taux de mortalité par le H5N1 ait significativement baissé, ce qui aurait pu être un indice d'humanisation de la souche originale (par exemple favorisée par recombinaison partielle avec la grippe humaine chez le porc). C’est un risque qui augmente avec la croissance du nombre d'hôtes de souches grippales animales et/ou humaines (ce nombre est estimé par certains experts à quelques centaines de cas humains pour l'apparition d'une première mutation à caractère humain par recombinaison génétique, au vu du taux actuel de mortalité et de la durée de survie des patients, et du nombre de gènes estimé pour ce virus). Les virus grippaux ne disposent pas de la faculté (comme dans les cellules humaines) de réparer leurs erreurs de transcription génétique. Les mutations sont donc fréquentes, particulièrement au contact d'autres matériels génétiques par polymérisation de transcription inverse peu de temps avant la mort de la cellule quand son noyau est directement exposé et intensément actif. De ce fait les virus de la grippe acquièrent facilement du patrimoine génétique tiers dans les cellules qu'ils ont infectées, ce qui augmente l’efficacité de leur propagation (vers les sujets victimes de même espèce), et leur résistance globale.
Enfin, comme le rappelle l'OMS en , les sujets (humains ou animaux) morts de la grippe restent contagieux durant au moins une dizaine de jours après leur mort. Les cadavres animaux doivent donc être traités rapidement pour éviter leur ingestion par les oiseaux et autres nécrophages, dont le sanglier qui est un porcin, qu'on peut donc supposer sensible au H5N1. Ceci est notamment vrai en hiver et au printemps où ces cadavres sont plus nombreux et où ils constituent une source de nourriture recherchée par les nécrophages.
Les villes très denses de certains pays (Chine, Palestine, Égypte) sont donc étroitement surveillées, et il est maintenant hautement recommandé de ne plus tolérer les élevages de volailles en milieu urbain, d'y lutter contre les trop fortes concentrations d'oiseaux sauvages (pigeons, étourneaux) par la stérilisation et les interdictions de nourrissage de ces espèces (qui trouvent dans les villes une nourriture trop abondante, et de nombreux refuges en période de grand froid), et de mettre en place de solides structures d'évacuation rapide des déchets ménagers qui ne doivent pas être laissés à la portée des oiseaux sauvages (gestion efficace et contrôle des décharges, lutte contre les décharges sauvages non contrôlées). Ceci est particulièrement difficile dans les villes et zones de bidonvilles des pays plus pauvres (tels le Nigeria et la Palestine) où les espèces domestiques côtoient trop souvent les espèces sauvages et des dépôts non contrôlés de déchets au milieu d'une population humaine très concentrée.
Question de la température :
Le virus est naturellement adapté au froid, ce qui explique pour partie la prédominance épidémique en saisons d'hiver, même à l'air libre en milieu naturel (ce qui favorise la contamination par simple contact de surfaces souillées, par respiration de gouttelettes respiratoires infectées, et en milieux humides très prisés par les oiseaux. Les virus grippaux sont réputés ne pas résister à la chaleur. Des virus H5N1 hautement pathogènes ont survécu plus d’un mois (« au moins 35 jours ») à 4 °C dans des fientes et près d’une semaine (6 jours) lors d’une expérience où les fientes étaient maintenues à 37 °C, mais des souches du H5N1 semblent s'être parfaitement adaptées à des régions subéquatoriales où la température ne descend pas en dessous de 17 °C dans l'air et rarement sous les 25 °C dans l'eau[34].
Mutations
[modifier | modifier le code]Comme tous les virus à ARN, le H5N1 mute rapidement. Les généticiens classent les sous-types viraux et les nouveaux variants du H5N1 en clades regroupant chacun un ancêtre d'une forme du H5N1 et ses descendants connus. Les variants des virus H5N1 et leurs descendants, quand ils sont repérés (par séquençage génétique, après parfois des indices cliniques laissant suspecter une mutation), sont classés sur l'arbre phylogénétique par ordre d'apparition (date), selon leur lieu d'apparition et l'espèce touchée, et surtout selon les modifications génétiques observées sur le gène HA (codant l'hémaglutinine). C'est ce même classement qui est utilisé pour le choix des souches à utiliser pour produire des vaccins (aviaires et humains) ou des candidats-vaccins prépandémiques adaptés au moment et au lieu.
L'étude des séquences génétiques codant l'hémagglutinine (H ou HA) de la majorité des virus H5N1 circulant chez les oiseaux et les êtres humains de 2003 à 2006 a permis de classer les virus H5N1 en deux groupes (ou clades phylogénétiques) distincts (un clade est un sous-groupe génétique apparaissant lors de l’évolution d’une espèce. On le traduit graphiquement par une branche sur l’arbre de l’évolution). Ces études seront à partir de mi-2006 facilités par l'ouverture des bases de données génétiques à tous les chercheurs (elles étaient antérieurement réservées aux laboratoires affiliés à l'OMS, faute d'accord des gouvernements des pays-membres de l'OMS pour leur ouverture publique). Selon l'OMS (mi-), des virus du Clade 1 ont circulé en 2004 et 2005 au Cambodge, en Thaïlande et au Vietnam où ils ont infecté l’être humain. C'est contre ces virus qu'ont été conçus les deux premiers prototypes de vaccins, le premier étant rapidement devenu désuet. Des virus du Clade 2 ont circulé chez les oiseaux en Chine et en Indonésie en 2003-2004 puis ils ont en 2005-2006 diffusé vers l'ouest, le Moyen-Orient, l’Europe et l’Afrique, devenant le principal responsable des infections humaine fin 2005 et début 2006 où un nouveau variant semble émerger en Asie du Sud-Est (Indonésie principalement). Six clades secondaires ont été distingués au sein du clade 2 ; trois (sous-clades 1, 2 et 3 respectivement principalement responsables des cas humains en Indonésie, au Moyen-Orient/Europe/Afrique, et en Chine et antigéniquement différent des virus précédents. Ces nouveaux sous-clades ; très pathogènes pour l'être humain, antigéniquement distinct du clade 1 et distinct entre eux, pourraient imposer la mise au point de nouveaux vaccins.
Le , l'O.M.S avait fait un point sur les mutations du H5N1[35]. Ces mutations modifiant le mode de transmission et la virulence du virus, mais sans, pour le moment selon l’OMS, augmenter le risque de transmission entre l’animal et l’être humain qui reste un évènement rare.
Les virus à ARN du groupe Influenza sont, par nature, génétiquement très instables. Ils varient selon deux mécanismes : les glissements antigéniques (antigenic drift) ou les cassures antigéniques (antigenic shift). Les glissements sont des variations antigéniques discrètes et continues qui ne modifient pas la structure antigénique globale du virus et permettent donc de conserver une immunité partielle à court terme.
- Ces glissements sont dus aux mutations qui se produisent au moment de la synthèse des ARN viraux en raison du taux élevé d'erreurs de l'ARN polymérase virale.
- Les cassures antigéniques correspondent à des changements radicaux de la structure de l'hémagglutinine ou de la neuraminidase virales. Elles résultent soit de réassortiments génétiques survenant entre des virus de sous-types différents, soit du passage direct d’un virus aviaire à l’être humain.
Chez l’animal
[modifier | modifier le code]Selon une information du [36] : Des experts, du département de biologie moléculaire de l'Institut Pasteur de Hanoï, dirigés par Cao Bao Van annonçaient avoir mis en évidence des variations des hémagglutinines et des neuraminidases présageant des mutations génétiques susceptibles d'augmenter la virulence du H5N1. Il faudrait toutefois un certain nombre (5) de mutations sur le génome dans des endroits bien précis pour que la souche s'adapte à l'être humain. Ces points sont surveillés en permanence par typage génétique des souches.
Chez l’être humain
[modifier | modifier le code]De nombreuses mutations ont été détectées depuis 2003, dont chez un patient turc en 2006 ; l'impact de ces mutations est généralement inconnu ou mineur selon l’OMS. Globalement le virus semble cependant de plus en plus agressif envers l'être humain (sauf pour la souche qui a sévi en Turquie).
Selon d'autres sources et d'autres chercheurs, l'une de l’américain Henri L. Niman, et l’autre italienne[37], les séquences de mutation s’accélèrent et les risques ne sont pas d’une réelle mutation, mais plutôt d’une recombinaison du virus qui a déjà commencé avec ceux des cygnes H1N1 et H1N2, ils œuvrent contre l'OMS qui séquestre les données[38]. L’OMS doit, selon eux, ouvrir les bases de données (humaines et animales) et publier les séquences virales et non les réserver aux 15 laboratoires-référents de l'OMS. L'OMS a entendu cet appel et ouvre ses bases de données (mi 2006) en encourageant avec l'OIE et la FAO tous les pays et chercheurs à partager leurs données.
Les souches et les séquences pourront ainsi être plus rapidement étudiées et comparées, pour mieux anticiper, détecter plus précocement et précisément les mutations ou recombinaisons et développer des stratégies vaccinales efficaces… et par exemple éviter de jeter 8 millions de doses à la poubelle aux États-Unis[39]. Autres problèmes : Les chercheurs doivent publier dans des revues à comité de lecture pour l'avancement de leur carrière et leur évaluation. Ceci freine la publication de découvertes importantes. De plus, ils peinent parfois à obtenir des crédits si les découvertes génétiques ne sont pas protégées par le secret industriel ou brevetés (ce qui peut les rendre inaccessibles aux pays pauvres), et l’OMS a jusque mi-2006 reflété l'opinion des pays-membres qui la constituent sur la protection intellectuelle. L’OMS considère que la principale difficulté est l’obtention des crédits de recherche, et non la protection des découvertes qui reste négociable de gré à gré entre laboratoires.
En 2013, le H5N1 n'a toujours pas acquis la capacité à se transmettre facilement par aérosol à l'être humain ou d'être humain à être humain via les gouttelettes respiratoires entre les êtres humains. Des mutations dirigées (substitutions d'acides aminés dans l’hémaglutinine et une dans la polymérase) ont cependant démontré (chez le furet, en laboratoire) que le virus pourrait chez les mammifères évoluer et acquérir cette capacité, sans besoin de recombinaison chez un hôte intermédiaire. Dans ce cas, les virus transmissibles étaient sensibles à l'oseltamivir[40],[41].
Taux de mortalité
[modifier | modifier le code]La pandémie de 1918-1919 a fait un nombre de morts estimé à trente à cent millions selon les estimations. Cette large fourchette estimative est due au fait que l'évaluation rétrospective du nombre de morts est rendue délicate pour cette période, par l'absence de statistiques ou de statistiques fiables pour les 2/3 des pays de l'époque, et parce que les faits de guerre, et l'énergie consacrée à la reconstruction des zones détruites après l'armistice ont pu faire perdre des informations utiles. De plus, ce type de virus peut aussi produire des formes atypiques de la maladie ou des symptômes qui peuvent avoir été confondus avec ceux de l'ypérite.
En 2006, une étude[42] a cherché à évaluer combien de morts aurait fait en 2004 un virus du type de celui de la Grippe espagnole. Le taux de mortalité a été rétrospectivement évalué à partir de données historiques (registres de décès de 27 pays pour les années 1918-20). Ces taux ont ensuite été extrapolés à la population de 2004. Les pays en développement seraient beaucoup plus touchés avec 96 % du total des morts, pour un nombre total de morts qui serait compris entre 51 et 81 millions, ce qui correspond à un doublement du nombre de morts normalement enregistré chaque année. Ce calcul reste très théorique, car seuls les pays riches et organisés disposaient à cette époque de statistiques relativement fiables (cf. contexte de guerre en 1918 et de reconstruction en 1919). Cette étude a aussi permis de rappeler que les gestionnaires de risques devaient anticiper des taux de mortalité très variés selon les pays et régions. En 1918, le taux de mortalité n’était par exemple que de 0,2 % au Danemark, mais a atteint 7,8 % en Inde. Dans certains villages, il atteignait 50 % voire 100 % exceptionnellement, alors que d’autres zones dans un même pays étaient épargnées. La promiscuité des individus et peut-être la promiscuité avec l’animal, souvent liée à la pauvreté ou à certains modes de vie (Inuits dans les igloos par exemple) était un facteur de risque.
Prévention
[modifier | modifier le code]La méthode de prévention des populations animales est le plus souvent la destruction des animaux infectés ou suspects. Des millions d’oiseaux domestiques ont dû être éliminés dans le Sud-Est asiatique.
David Nabarro, coordinateur des agences des Nations unies concernées par l'épizootie déclare le qu'« on peut réduire le risque en luttant de manière systématique contre chaque foyer épizootique, par abattage et mise en quarantaine et en protégeant les volailles domestiques par vaccination. Nous pouvons contrôler la situation mais sans doute plus envisager l'éradication » et que « nous allons devoir apprendre à vivre avec cela ».
Le CDC recommande aux voyageurs vers les zones de l’Asie où des émergences du H5N1 se sont produites d’éviter tous les élevages de volailles, et les animaux dans les marchés d’alimentation vivante. Les voyageurs devraient aussi éviter le contact avec les surfaces qui semblent avoir été contaminées par les matières fécales de toute espèce animale, particulièrement la volaille.
De même, la chasse devrait être immédiatement proscrite pour éviter tout contact avec les oiseaux (notamment les espèces migratrices tels que les canards) et espèces porcines (notamment les sangliers qui fouillent les excréments), même en cas de lâchers d’espèces élevées car celles-ci se mêlent et entrent en contact avec les espèces sauvages qu’il est alors impossible de distinguer.
Il est recommandé de ne jamais toucher les animaux trouvés morts ou malades et de prévenir les autorités sanitaires locales qui procéderont à des prélèvements pour analyse et à leur élimination en toute sécurité. Les associations de protection des oiseaux recommandent de ne plus accepter les animaux blessés ou malades dans les fermes de soin d’espèces sauvages, mêmes protégées, et d’informer le public sur les risques sanitaires encourus à leur contact. Elles recommandent également de suspendre toutes les prises aux fins de baguage pour le suivi des espèces migratoires.
Le contact direct avec les volatiles infectés, ou les surfaces et objets contaminés par leurs excréments, est actuellement considéré comme la voie principale d’infection humaine. Le risque d’exposition est maximum durant le plumage, le dépeçage et le vidage des volatiles, et la préparation des volatiles pour la cuisson, c’est pourquoi on recommandera l’utilisation de dispositifs de protection pour éviter tout contact direct. Il n’y a cependant aucune évidence que la consommation d’une viande de volaille convenablement cuite ou de produits dérivés soit source d’infection, le virus ne résistant pas à une cuisson normale.
De même des mesures de protections sont absolument nécessaires lors du nettoyage des poulaillers et autres lieux d’élevage, particulièrement en cas d’emploi d’instruments de nettoyage sous pression créant des aérosols contaminants. On préférera donc le nettoyage basse pression avec des agents de désinfection, le port de bottes et gants étanches, et de masque avec visière pour protéger la figure. Pour le nettoyage en milieu naturel, le port de combinaisons intégrales est hautement recommandé.
Dans les zones d’infections, on évitera tout contact des doigts et de la peau dans les yeux et les muqueuses de la sphère ORL. En cas de contact contaminant (y compris avec les instruments de nettoyage ou de découpe ou les vêtements de protections), la peau et les lipides à sa surface (au contraire des fragiles muqueuses ORL et des yeux) constituent une barrière protectrice efficace qu’il faut préserver pendant le lavage : un premier rinçage simple à l’eau froide, sans frotter, éliminera les impuretés les plus importantes avant l’application d’une solution de nettoyage antiseptique, puis un lavage soigné ôtera les résidus. Les plans d’hygiène et de sécurité doivent être mis en place et appliqués de façon stricte et les personnels concernés doivent pouvoir se décontaminer à tout moment en cas d’exposition jugée dangereuse et après tout travail. Dans les abattoirs et cuisines, les instruments de découpe ou de nettoyage doivent être aseptisés à haute température, ou avec une solution antiseptique.
À présent, il n’existe aucun vaccin pour la grippe H5N1, bien que des efforts de développement soient en cours d’après l’Organisation mondiale de la santé. Bien qu’il ne s’agisse pas d’un vaccin, l'oseltamivir, un agent antiviral, pourrait protéger des infections humaines par certaines variantes de virus grippaux et éviter le développement de complications graves (voir la section Traitement ci-dessous).
Toute forme de grippe étant hautement contagieuse, et la contagiosité intervenant dès les premiers jours d'exposition avant même le déclenchement de la maladie, il faut rappeler qu’il ne FAUT PAS se rendre à l’hôpital (où l’on se trouvera aussi facilement exposé à d’autres maladies) pour effectuer un diagnostic, mais faire appel rapidement à un médecin traitant local qui recommandera le maintien d’un traitement à domicile. Seul le médecin doit prendre la décision d’hospitalisation avec les précautions nécessaires.
En cas de maladie quelle qu'elle soit, il faut protéger les enfants (notamment les nourrissons où les évolutions sont rapides du fait qu'ils ne disposent pas encore d'une réponse immunitaire suffisante) et personnes dont le système immunitaire est affaibli (tout malade) en les éloignant si possible des personnes infectées. Il convient également de les protéger d'une infection (ou surinfection opportuniste) en se lavant les mains avant leur contact, et en portant un masque de protection de classe FFP2.
Les mesures habituelles d'hygiène doivent être renforcées, en incluant le nettoyage des objets courants (poignées et portes, boutons électriques ou de commande, jouets, vêtements, vaisselle et ustensiles de cuisine, toilettes, combiné de téléphone et claviers d'ordinateurs) avec des produits désinfectants adaptés. Le contact des mains avec les zones infectées lors du nettoyage n'est pas dangereux, la couche cornée et lipidique de la peau constituant une barrière protectrice très efficace, mais cela n'exclut pas le lavage des mains après exposition, et avant la manipulation de produits alimentaires ou avant les repas. La literie des malades doit être aérée et bien séchée tous les matins, les draps changés souvent.
- Samedi , confinement des chats et restriction aux déplacements des chiens dans l'Ain.
En France, un arrêté du ministre de l’Agriculture (JO du samedi ) stipule que dans la Dombes (Ain) et jusqu’à nouvel ordre « les chats doivent être enfermés et les chiens tenus à l'attache ou enfermés ». Les chiens peuvent circuler sur la voie publique « tenus en laisse ou sous le contrôle direct de leur maître ». Les chiens et chats peuvent être transportés en cage, en panier fermé ou à l'intérieur d'un véhicule. Dans les zones exemptes d'oiseaux infectés par le virus, le risque d'infection du chat est jugé nul selon l'AFSSA précise le ministère de l’agriculture. Le ministère demande aux propriétaires de « ne pas abandonner les animaux de compagnie, comme on l'a vu ces derniers jours » et de ne faut pas toucher les chiens et chats trouvés morts mais d’en informer les services vétérinaires départementaux.
Tableaux cliniques et radiologiques
[modifier | modifier le code]Les premiers tableaux cliniques ont été décrits à la suite des cas humains d'infections apparus en 1997. Depuis, les éléments du diagnostic clinique et radiologique se sont étoffés.
- La période d'incubation de la maladie est de cinq à sept jours pouvant aller jusqu'à dix-sept jours.
- Les premiers symptômes associent, une forte fièvre (supérieure à 38,5 °C) et un syndrome grippal classique : maux de tête, douleurs articulaires ou musculaires, catarrhe oculo-nasal (rhume), trachéite et/ou pharyngite. Une conjonctivite peut être associée. Des signes digestifs sont souvent décrits : douleurs abdominales, diarrhée, vomissements sont présents dans 67 à 100 % des cas selon les séries[43]. Deux cas d'encéphalopathie avec diarrhée et sans signe respiratoire ont été rapportés suggérant que le nombre de cas humains diagnostiqués a pu être sous-estimé. Au 5e jour après le début de la fièvre, une pneumonie apparaît avec une dyspnée (essoufflement) de type tachypnée (respiration rapide), une toux productive avec des expectorations souvent teintées de sang. L'atteinte pulmonaire peut aller jusqu'au syndrome de détresse respiratoire aiguë.
- Les anomalies radiologiques sont présentes au 7e jour de la maladie avec un infiltrat pulmonaire bilatéral extensif. Les atteintes de la plèvre sont exceptionnelles. Progressivement, les infiltrats s'étendent à l'ensemble du parenchyme complétant le tableau de détresse respiratoire. À ce stade, des lésions extra-pulmonaires peuvent aggraver le tableau : anomalies de la fonction rénale, troubles cardiaques (dilatation cardiaque, tachy-arythmie).
Chez les patients hospitalisés, la maladie évolue très souvent vers le décès, dans 33 % des cas en 1997 à 100 % des cas en 2004. Le décès survient entre neuf et dix jours après le début des signes cliniques, il est lié à la progression de la détresse respiratoire. Cependant, les patients présentant un tableau clinique moins sévère notamment sans détresse respiratoire évoluent vers la guérison dans un délai de huit à quinze jours après le début de la maladie.
Diagnostic (modalité de diagnostic)
[modifier | modifier le code]En , pour tenir compte des caractéristiques actuelles du H5N1, les CDC américains ont mis à jour leurs recommandations[44] concernant les tests à pratiquer pour le diagnostic d’une personne suspectées de grippe aviaire. Une analyse du liquide récupéré après un Lavage Broncho-Alvéolaire (ou LBA) est recommandée plutôt que l’écouvillonnage nasal ou de la gorge qui suffisaient pour la grippe saisonnière. En effet, le virus H5N1 est parfois indétectable dans la bouche ou le nez alors qu'il se développe dans la partie profonde des poumons. Cette méthode permet aussi de détecter d’éventuels microbes responsables de surinfections.
Diagnostic biologique
[modifier | modifier le code]Dans 60 à 80 % des cas, on note une leucopénie avec principalement une lymphopénie associée à une thrombocytopénie modérée. Une élévation modérée des transaminases est observée dans les mêmes proportions.
- Le diagnostic virologique de l'infection repose sur la mise en évidence du virus lui-même ou d'un de ses constituants (antigènes, fragment d'ARN).
- Les tests diagnostiques sont effectués sur différents types de prélèvements en fonction de la symptomatologie observée. En cas de signes respiratoires, une aspiration nasopharyngée, une expectoration, un prélèvement de gorge ou un liquide de lavage bronchoalvéolaire pourront être analysés. En cas de diarrhée, un prélèvement rectal et de selles doivent être testés. Chez les patients présentant une encéphalopathie, l'étude du liquide céphalo-rachidien (LCR) et du sérum peuvent permettre le diagnostic de la cause. La mise en évidence du virus se fait soit par isolement viral sur culture cellulaire, soit par détection spécifique de l'ARN viral par RT-PCR soit par l'association des deux méthodes.
- L'isolement viral est obtenu par culture sur des cellules de rein de chien (MDCK), accessoirement sur des cellules de rein de macaque rhésus (LLC-MK2) ou encore par l'inoculation d'œufs embryonnés de poulet. Comme les autres virus grippaux, le virus A/H5N1 ne donne pas de lésion spécifique au niveau cellulaire. Son identification se fait donc à partir des cellules en culture par immunofluorescence avec un anticorps monoclonal dirigé contre la protéine NP. On définit ainsi le sous-type A de la souche virale. Le sous-typage spécifique H5N1 se fait soit par RT-PCR à partir du surnageant de culture, soit par des tests d’inhibition de l’hémagglutination ou de l’activité neuraminidase avec un panel d’antisérums de référence spécifiques des différents sous-types.
- L'ARN viral est mis en évidence par une RT-PCR spécifique du virus A/H5N1. Différentes stratégies sont actuellement développées : amplification d'un fragment du gène M, commun aux virus de la grippe A, puis en cas de positivité, détermination du sous-type par l'amplification d'un fragment du gène de l'hémagglutinine H5, H1 et H3[45] ou amplification d'un fragment du gène de l'hémagglutinine H5 spécifique du virus A/H5N1.
- La recherche d'antigènes viraux par des tests commerciaux utilise une méthode d'immunofluorescence. Dans un premier temps, la présence de la nucléoprotéine (NP) des virus de la grippe A est recherchée puis, en cas de positivité, la recherche des antigènes H1, H3 et H5 permet de préciser le sous-type viral présent. Cette méthode est moins sensible et moins spécifique que la détection du génome viral par isolement en culture cellulaire. Un test diagnostique basé sur une méthode immunochromatographique sur membrane a été développée dans le commerce. Cette technique n'est pas spécifique du virus A/H5N1 et présente une sensibilité de 70 % par rapport à l'isolement du virus sur culture cellulaire. Pour ces différentes raisons, son utilisation n’est pas recommandée.
- Les tests sérologiques recherchant des anticorps dirigés contre le virus A/H5N1 ont un intérêt rétrospectif et servent pour les études épidémiologiques. La méthode d’inhibition de l’hémagglutination est la méthode standard pour le diagnostic sérologique des infections grippales : les anticorps développés par un patient infecté inhibent l’activité hémagglutinante de l’hémagglutinine virale. Cependant, les tests d’inhibition de l’hémagglutination actuellement disponibles semblent peu sensibles en raison soit de la faible immunogénicité des virus aviaires, soit de la faible avidité des anticorps produits, soit de la difficulté de détecter des taux faibles d’anticorps.
Le diagnostic virologique d'une infection par le virus A/H5N1 repose donc sur la positivité d'une culture virale ou d'une RT-PCR spécifique du virus A/H5N1, ou sur la positivité d'une immunofluorescence utilisant des anticorps monoclonaux dirigés contre l'hémagglutinine H5. Le diagnostic sérologique nécessite classiquement l'analyse de deux sérums prélevés à trois semaines d'intervalle et doit montrer une augmentation d'au moins quatre fois du titre d'anticorps.
Traitement
[modifier | modifier le code]Les inhibiteurs de neuraminidase sont une classe de médicaments qui agissent sur la neuraminidase, une protéine essentielle des virus de la grippe. Les médicaments de ce type incluent le zanamivir et l’oseltamivir, ce dernier étant autorisé pour le traitement prophylactique au Royaume-Uni. L’oseltamivir est mis sur le marché par le laboratoire Roche sous la marque commerciale Tamiflu, et ce produit est devenu le médicament de choix pour les gouvernements et organisations dans leurs préparations d’une possible pandémie de grippe aviaire après recombinaison du H5N1 avec un autre virus grippal touchant les humains. Cependant, le Tamiflu ne ferait que ralentir la progression du virus à travers les cellules de l'organisme et ne guérirait pas. En , Roche a accepté de fournir gratuitement deux millions de cures de Tamiflu à l’Organisation mondiale de la santé afin que celle-ci les déploie pour contenir une pandémie dans sa région d’origine. Le zanamivir est lui commercialisé par le britannique GlaxoSmithKline sous la marque commerciale Relenza.
Les inhibiteurs M2 sont une autre classe de médicaments, qui inclut l’amantadine et la rimantadine. Au contraire du zanamivir et de l’oseltamivir, ces médicaments sont peu onéreux et largement disponibles et l’OMS avait initialement prévu de les utiliser pour combattre une pandémie H5N1. Cependant le potentiel de ces médicaments a été considérablement réduit quand on a découvert que la Chine avait administré l’amantadine aux volailles avec les encouragements et le support du gouvernement depuis le début des années 1990, en dépit de règles internationales de gestion des stocks de sécurité ; il s’est ensuivi que la souche virale circulant maintenant dans le Sud-Est asiatique est largement immunisée au traitement et, de ce fait, significativement plus dangereuse pour les humains[46]. Cependant la souche de H5N1 qui s’est propagée au travers du Nord de la Chine, la Mongolie, le Kazakhstan et la Russie par les oiseaux migrateurs durant l’été 2005 n’est pas résistante à l’amantadine.
Dès 2005, on a montré[47] qu'une souche du virus H5N1 était déjà résistante à l’oseltamivir (ou Tamiflu), le médicament antiviral le plus stocké dans le monde en prévision d’une pandémie grippale. Cette souche a été identifiée chez une jeune fille de 14 ans au Viêt Nam, qui de plus aurait pu contracter le H5N1 via son frère, et non directement par des oiseaux infectés. Le décodage du génome montre une mutation qui la rend résistante à l’oseltamivir mais elle est sensible au zanamivir. En 2007, des résultats d'autopsie faites en Chine sur des morts du H5N1 a confirmé que l'attaque virale était systémique, c'est-à-dire que de nombreux organes sont touchés par le virus et non les seuls poumons), y compris chez un patient mort après un traitement de dix jours au Tamiflu, chez lequel on a trouvé des virus jusque dans le cerveau. Ces virus étaient encore sensibles au Tamiflu, mais le traitement n'était clairement pas suffisant pour le supprimer. Ceci, suggère que des dosages plus élevés et un traitement plus long puissent être nécessaires.
Le décodage génétique complet du virus pourrait à l'avenir identifier de nouveaux gènes et antigènes caractéristiques du virus (en plus des antigènes H et N) permettant de développer de nouvelles classes d’inhibiteurs de ces antigènes. Les recherches menées sur la grippe classique devraient aider au développement de tels traitements curatifs complémentaires aux traitements actuels.
Vaccin
[modifier | modifier le code]Vaccin contre la grippe saisonnière 2005/06 et H5N1
[modifier | modifier le code]Le vaccin contre la grippe saisonnière est un vaccin vivant atténué. Il est classiquement constitué de plusieurs souches virales sélectionnées par l'OMS, ayant circulé l'année précédant son utilisation. Ainsi, le vaccin de la saison 2005/06 contient les souches suivantes :
La vaccination anti-grippale est le meilleur moyen de se protéger contre les virus de la grippe en circulation, mais ne protège pas contre le virus de la grippe aviaire H5N1. Il diminue cependant les risques de recombinaisons entre un virus humain circulant et un virus animal ou un virus H5N1 en voie d'humanisation.
Les vaccins saisonniers sont constitués de virus inactivés produits par culture sur œufs embryonnés de poulet. La forte pathogénicité du virus A/H5N1 HP vis-à-vis de la poule et de son embryon rend impossible la production d’un vaccin par cette méthode. Différentes alternatives ont été développées pour contourner ce problème : méthode de génétique inverse, synthèse d’une hémagglutinine recombinante, vaccination par de l’ADN… sans résultats très satisfaisants à ce jour.
Toutes les personnes à risque pouvant être exposées au virus A/H5N1 ou à d’autres variétés grippales (notamment celles devant manipuler les cadavres d’oiseaux morts suspects ou procéder aux prélèvements et analyses, et les personnes travaillant dans les élevages ou abattoirs de volaille) doivent se faire vacciner (ce vaccin antigrippal apporte une protection annuelle). En France ce vaccin est gratuit et diffusé chaque année aux personnes les plus exposées aux complications (personnes âgées, personnels hospitaliers). Le vaccin antipneumococcique (actif pour cinq ans contre le pneumocoque) est également recommandé en complément aux personnes fragiles ou susceptibles d'être exposées au H5N1, car cette bactérie est le principal facteur de surinfection en cas de pneumopathie.
Mise au point d’un vaccin contre le H5N1
[modifier | modifier le code]: l’OMS annonce que de nouvelles formes du virus ont émergé en Asie, qui sont génétiquement et antigéniquement distinctes des deux souches vacciniques développée par l’OMS en 2004-2005 à partir des virus H5N1, A/Vietnam/1203/2004 et A/Vietnam/1194/2004. Un 3e prototype vaccinique contre H5N1 a été développé à partir d’un virus trouvé en Indonésie (A/Indonesia/5/2005), disponible en . Deux nouvelles souches vacciniques (A/Bar/Qinghai/1A/2005 et A/Whooping/Mongolia/244/2005) sont également disponibles auprès de l’OMS pour les fabricants de vaccins, plus représentative du subclade2 (groupes de formes virales plus récentes).
: l’OMS annonce qu’une nouvelle souche vaccinale (recombinant) H5N1, NIBRG-23 a été produite par le National Institute for Biological Standards and Control (Royaume-Uni), à partir de la souche A/turkey/Turkey/1/2005 proche de la majorité virus A (H5N1) circulant depuis début 2005. La souche vaccinale NIBRG-23 est disponible sous condition (Material Transfer Agreement MTA).
[48] : l’OMS a recommandé un choix de virus candidats pour un vaccins pré-pandémique à partir de virus jugés représentatif de souches susceptibles de devenir pandémiques :
Les virus ci-dessous ont été sélectionnés pour la préparation par génétique inverse de virus vacciniques réassortant modifiés à partir de la souche de laboratoire A/PR8/34.
Pour la sous-clade 1 :
- A/Indonesia/5/2005
Pour la sous-clade 2 :
- A/Bar/Qinghai/1A/2005 (trouvé sur oie à tête barrée),
- A/Whooper/Mongolia/244/2005 (cygne Cygnus cygnus)
- A/turkey/Turkey/1/2005
L’OMS ajoute que les données disponibles sur l’évolution du virus début 2006 incitent à produire aussi un vaccin adapté à la sous-clade 3 (groupe de virus se développant début 2006) à partir de la souche A/Anhui/1/2005.
De nombreux pays travaillent sur des projets de vaccins. Par exemple, mercredi , le ministre de la Santé hongrois Jenij Racz annonçait que son pays avait développé un prototype de vaccin humain contre le virus H5N1 : « Nous n’en sommes qu’aux résultats préliminaires mais je peux dire avec 99,9 % de certitude que le vaccin marche. Les essais cliniques (sur quelque 150 volontaires) se sont avérés positifs, le sang des cobayes ayant produit des anticorps. »
Ce vaccin a été développé à partir d’une souche aviaire de H5N1 apparu à Hong Kong en 1997 et isolée début 2005 sur une personne en Asie du Sud-Est par l’OMS. Depuis le H5N1 a évolué en trois groupes principaux, dont les caractéristiques antigéniques diffèrent déjà des premières souches vaccinales développées.
Les États-Unis, par la voix de Michael Levitt[49], reconnaissent avoir échoué dans leur première tentative de faire un vaccin. Ils ont dû reprendre le processus à son début car les huit millions de doses ne contenaient pas la seconde et nouvelle souche mutante d’origine indonésienne du virus H5N1. Ce vaccin, bien toléré, s’est avéré par ailleurs peu immunogène, et aurait donc été probablement moyennement efficace[50].
Recherche sur un vaccin antigrippal universel (M2)
[modifier | modifier le code]Samedi , une équipe de chercheurs belges annonce avoir expérimenté avec succès un prototype de vaccin universel contre toutes les formes de grippe (y compris le H5N1 et la grippe humaine saisonnière), visant l’antigène M2 présent sur toutes les formes de grippe, et non les antigènes H ou N spécifiques et trop facilement mutants de chaque variante grippale.
Contrairement aux vaccins actuels n'assurant qu'une protection partielle pendant une seule saison et à renouveler chaque année pour la grippe humaine (et plusieurs fois par an sur les grippes H2, H5 et H7 des animaux d'élevage), ce vaccin assurerait une immunité durant 10 ans, et serait moins coûteux à produire en plus grande quantité.
L’immunité obtenue a été confirmée chez les rats et les recherches continuent[réf. nécessaire].
Les chercheurs belges espèrent obtenir un soutien dans leurs recherches par les fonds de recherche publics européens ou d’autres pays voire de l’OMS, le succès d’un tel vaccin constituant une avancée majeure au niveau mondial dans le domaine de la santé publique humaine et vétérinaire.
Il n’y a pas encore de vaccins effectifs disponibles contre un virus pandémique. Des vaccins sont produits chaque année contre la grippe saisonnière, mais ils ne protègent nullement en cas de grippe pandémique. Bien qu’un vaccin contre le virus H5N1 soit en cours de développement dans plusieurs pays, aucun vaccin n’est prêt à être commercialisé et aucun vaccin ne pourra être largement disponible avant que plusieurs mois se soient écoulés depuis le début de la pandémie.
H5N1 faiblement pathogène
[modifier | modifier le code]Des variants faiblement pathogènes de tous les virus de grippe aviaire (HxNx) peuvent exister.
Les anglophones les désignent par l’expression « LPAI HxNx » ; « LP » signifiant « Low pathogenic » (peu pathogènes).
Remarques : Un virus peut être peu pathogène soit parce qu’il n’est pas adapté à une espèce, soit que celle-ci est immunisée. Un virus faiblement pathogène peut indirectement présenter un risque écoépidémiologique (dont pour l'être humain dans le cas d'une maladie zoonotique) s'il est facilement transmissible d'un individu à l'autre et/ou d'une espèce à l'autre, en cas de recombinaison génétique qui produirait un nouveau virus à la fois hautement pathogène et facilement transmissible (contagieux), ce qui en ferait un candidat potentiel comme facteur de panzootie et/ou d'épidémie plus grave, voire de pandémie[51]. Pour cette raison, le H5N1 faiblement pathogène fait aussi l'objet d'une attention soutenue de la part de l'OIE
Description
[modifier | modifier le code]Ils ont été détectés chez les oiseaux sauvages et la volaille, qui lors d'une infection ne manifestent alors pas ou peu de symptômes grippaux (indolence, diminution des pontes). Ces virus ne sont pas directement dangereux ; on ne pense pas qu’il affectent l’être humain, mais on peut craindre qu’ils puissent infecter la volaille et y subir une mutation le rendant très pathogène.
Le H5N1 faiblement pathogène est parfois nommé « Virus H5N1 nord-américain » parce que c'est au Canada et aux États-Unis qu'il a été d'abord décrit.
Conséquences
[modifier | modifier le code]De nombreux oiseaux sont porteurs sains (tout en excrétant de grandes quantités de virions) ou ne sont que faiblement affectés, mais certaines lésions virales peuvent évoluer en lésions macroscopiques via une surinfection bactérienne (par exemple par Pasteurella multocida ou Escherichia coli) éventuellement susceptibles de conduire un affaiblissement voire à la mort des animaux touchés[52].
Par ailleurs, le contact avec une souche faiblement pathogène peut parfois aussi rendre le système immunitaire plus efficace face à une infection ultérieure par un virus proche mais hautement pathogène pour un animal immunitairement naïf à son égard, selon un principe proche de celui de la vaccination[53].
Exemples
[modifier | modifier le code]- 1975 : un LPAI H5N1 est détecté chez un canard et une oie sauvages dans le Wisconsin (États-Unis).
- 1981 et 1985 : un LPAI H5N1 est détecté chez des canards aux États-Unis par l'université du Minnesota (États-Unis). Il est alors recherché et surveillé via des campagnes d’échantillonnages et des canards-sentinelles brièvement placés à proximité d’oiseaux sauvage pendant une période courte.
- 1983 : des goélands à bec cerclé sont infectés, en Pennsylvanie (États-Unis).
- 1986 : un canard sauvage est affecté dans l’Ohio (États-Unis).
- 2005 : des canards en sont porteurs dans Manitoba (Canada).
Législation
[modifier | modifier le code]Avant les années 2003 (et avant 2004 en Chine), la grippe aviaire n’était pas une maladie à déclaration obligatoire. Et les virus H5 ou H7 faiblement pathogènes n’ont pas toujours été recherchés ni rapportés chez les oiseaux sauvages en Amérique du Nord. En 2006, l’OIE a incité à rapporter tous les cas même faiblement pathogènes de grippe aviaire, H5 et H7, chez l’animal sauvage ou domestique et de basse-cour en raison de leur capacité démontrée à produire par mutation ou recombinaison des souches très pathogènes.
Notes et références
[modifier | modifier le code]- (en) « Virus Taxonomy: 2018b Release », ICTV, (consulté le ).
- Johnson N.P., Mueller J. « Updating the accounts: global mortality of the 1918-1920 "Spanish" influenza pandemic. », Bull Hist Med., printemps 2002, 76(1), p. 105-15. Citation : « This paper suggests that it was of the order of 50 million. However, it must be acknowledged that even this vast figure may be substantially lower than the real toll, perhaps as much as 100 percent understated. » Résumé.
- La FAO met en garde contre une résurgence de la grippe aviaire, consulté 31 août 2011
- Highly Pathogenic Influenza A(H5N1) Virus Survival in Complex Artificial Aquatic Biotopes, PLOS 2012-04-13
- étude néerlandaise dirigés par Juthatip Keawcharoen au centre médical Érasme de Rotterdam, spécialisé dans l’étude du H5N1(Emerging Infectious Diseases, avril 2008 ; annoncée le 24 mars 2008 par Bloomberg)
- (en) La Malaisie se déclare désormais exempte de grippe aviaire, article d’actualité sur Yahoo News India, le .
- (en) La grippe aviaire au Kazakhstan et en Mongolie, article d’actualités sur un site chinois consacré à la grippe, août 2005.
- (en) Les volailles néerlandaises enfermées à la suite de la découverte du virus en Russie occidentale, article de BBC News, août 2005.
- (en) Plan de trois ans pour contrer la dissémination de la maladie en Asie du Sud-Est, article de BBC News, septembre 2005.
- (en) La grippe aviaire détectée en Roumanie, article de CNN Europe,
- (fr) Le chien azéri est mort, selon le blog H5N1 mutation, le 9 mars 2006.
- (fr) Oiseaux morts en Israël et possible recombinaison du virus H5N1 avec la séquence S227 du H9N2 selon le blog H5N1 recombinaison, 16 mars 2006.
- ADIT, Faut-il publier dans Nature des recherches néerlandaises sur un virus mortel ?, BE Pays-Bas 38
- ADIT, Conférence internationale sur la grippe aviaire à la demande des Pays-Bas BE Pays-Bas 40 ; 11/06/2012
- (en) La grippe porcine chinoise, article des Nations unies, 3 août 2005.
- « There is speculation that pigs may serve as the intermediate host in genetic exchange between influenza viruses in avian and humans, but experimental evidence is lacking. » Evolution and ecology of influenza A viruses. Webster RG, Bean WJ, Gorman OT, Chambers TM, Kawaoka Y. Department of Virology and Molecular Biology, St. Jude Children's Research Hospital, Memphis, Tennessee 38101
- O.M.S, « Bulletins d'information sur les flambées épidémiques Grippe aviaire A(H5N1) - Viet Nam », (consulté le )
- (en) Statistiques de l’OMS au 29 septembre 2005
- (en) Actualité et Carte 2005 et 2006 de contamination en Asie et Europe selon Recombinomics
- (en) Les États-Unis commandent des doses supplémentaires du vaccin antiviral contre une future pandémie humaine, article du New York Times, .
- (en) Avian influenza, OMS, 27 décembre 2007
- Le Monde, 29 décembre 2007
- Gaidet, N., Cappelle, J., Takekawa, J. Y., Prosser, D. J., Iverson, S. A., Douglas, D. C., Perry, W. M., Mundkur, T. et Newman, S. H. « Potential spread of highly pathogenic avian influenza H5N1 by wildfowl: dispersal ranges and rates determined from large-scale satellite telemetry ». Journal of Applied Ecology ; volume 47, Issue 5, pages 1147–1157, , mis en ligne : ; doi:10.1111/j.1365-2664.2010.01845.x. ;
Cette étude a été coréalisée par le Cirad, la FAO, l’USGS et Wetlands International - A propos d'une étude intitulée Wild migratory birds may indeed play a role in the spread of bird flu, also known as highly pathogenic avian influenza H5N1.
- (en) La chute du taux de mortalité due au virus préfigure un nouveau danger, article du Boston News paru le .
- (en) Inquiétudes sur la transmission interhumaine après un décès inexplicable en Indonésie, article du Washington Post paru le .
- Dominic Dwyer, directeur du Virology Department at Westmead Hospital de Sydney Lire, commentant un rapport d'autopsie chinoise ayant en 2007 montré qu'un fœtus était infecté par le H5N1.
- Rapport chinois, publié par le centre d’étude des maladies infectieuses de Pékin, basé à l’université de Pékin, avec l’université de Columbia de New York)
- rapport d'autopsie chinois, publié par The Lancet en septembre 2007, et fait par le centre d’étude des maladies infectieuses de Pékin (université de Pékin), avec l’université de Columbia (New York)
- (en) Pitzer VE, Olsen SJ, Bergstrom CT, Dowell SF, Lipsitch M., Little evidence for genetic susceptibility to influenza A (H5N1) from family clustering data. Emerg Infect Dis [serial on the Internet]. [date cited]. Voir (anglais)
- Alexander DJ. The epidemiology and control of avian influenza and Newcastle disease, J Comp Pathol, 1995, 112, 105-26.
- Buxton-Bridges C et al. Risk of influenza A (H5N1) infection among health care workers exposed to patients infected with influenza A (A/H5N1), Hong Kong. J Infect Dis 2000 Jan ; 181 (1) : 344-48
- Bridges CB et al. Risk of influenza A (H5N1) infection among poultry workers, Hong Kong, 1997-1998. J Infect Dis, 15 avril 2002 ; 185 (8) : 1005-10.
- OMS http://www.who.int/mediacentre/factsheets/avian_influenza/fr/index.html
- (en) Communiqué de l’OMS du sur les mutations du H5N1.
- (fr) Études menées par l’Institut Pasteur de Hanoï sur les mutations virales nécessaires chez l’animal pour que le virus s’adapte à l’homme, Le Monde, (accès réservé aux abonnés).
- (fr) Grippe aviaire : publier et périr, agence Science-Presse, .
- (en) Séquestration des souches de séquencement par l’OMS, Recombinomics, .
- (en) Problèmes rencontrés lors du développement d’un vaccin antigrippal, CNN, le .
- (en) Sander Herfst et al. (2012), Airborne Transmission of Influenza A/H5N1 Virus Between Ferrets, Science, , vol. 336, no 6088, p. 1534-1541, DOI: 10.1126/science.1213362.
- (en) Colin A. Russell et al., « The Potential for Respiratory Droplet Transmissible A/H5N1 Influenza Virus to Evolve in a Mammalian Host », Science, , vol. 336, no 6088, p. 1541-1547, DOI: 10.1126/science.1222526.
- Étude de Christopher Murray et son équipe de l'Université de Harvard et de l'Université du Queensland (Australie), avec l'École de santé publique Johns Hopkins Bloomberg (Baltimore, Maryland, États-Unis), publiée fin 2006.
- (en) Ungchusak K, « Probable Person-to-Person Transmission of Avian Influenza A (H5N1) », N Engl J Med, , 352(4), 333-40.
- (en) Lab Testing of Persons with Suspected Avian Flu in U.S., document du CDC
- (en) Avian influenza A (H5N1). Jongh MD, Hien TT. J Clin Virol. 2006 Jan 35(1) ; 2-13.
- (en) « Immunité du H5N1 au traitement curatif à l’amantadine en Asie du Sud-Est », The Washington Post, .
- Étude anglaise publiée par le journal Nature du .
- http://www.who.int/entity/csr/disease/avian_influenza/guidelines/h5n1virus2006_08_18/en/index.html.
- (en) Échec de la fabrication d’un vaccin aux États-Unis, selon Michael Levitt, article de CNN, mars 2006.
- (en) J Treanor, J Campbell, K. Zangwill, T. Rowe, M. Wolff, Safety and Immunogenicity of an Inactivated Subvirion Influenza A (H5N1) Vaccine, New Eng. J. Med., 2006, 354:1343-1351.
- Peyre, M., Gaidet, N., Caron, A., Cappelle, J., Tran, A., & Roger, F. (2015). Influenza aviaire dans le monde : situation au 31 janvier 2015. Bull. Epid. Santé Anim. Alim, 67, 10-14
- Brugère-Picoux J (2006) L’influenza aviaire hautement pathogène ou peste aviaire. Cas particulier de la panzootie due au virus H5N1 asiatique. Sciences, 1(1er).
- Martine, C., Johan, R., Le Bras Marie-Odile, M. Y., & Véronique, J. Un modèle expérimental d’épreuve avec une souche de virus de la grippe aviaire de sous-type H7N1 «faiblement» pathogène pour évaluer la protection contre l’infection par ces virus.
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) Horimoto T. et Kawaoka Y., « Influenza », Nature reviews microbiology, vol. 3, pp.591-600 (2005).
- Grippe aviaire : ce qu'il faut savoir, par François Moutou et Pascal Orabi, Delachaux et Niestlé,
Articles connexes
[modifier | modifier le code]- Épidémie
- Pandémie
- Pandémie grippale
- Plan de crise pour une pandémie
- Risque pandémique lié à la grippe aviaire
- Histoire des épizooties de grippe aviaire
- Grippe (alias influenza ou flu en anglais)
- Grippe aviaire (alias peste aviaire)
- Grippe espagnole, pandémie de 1918.
- Épizootie
- Virus H2N2
- Virus H1N1
- Virus H7N9
- Virus H7N7
- Zoonose
Liens externes
[modifier | modifier le code]Sources officielles de veille sanitaire et médicale :
- (fr) Organisation mondiale de la santé animale (OIE, Office international des épizooties) (source officielle), alertes sanitaires et mesures de prévention au niveau mondial (sections en français).
- (fr) Santé animale : Rapports spéciaux (Influenza aviaire) (source officielle), Division de l’agriculture aux Nations unies (FAO).
- (fr) Institut de veille sanitaire (source officielle), organisme gouvernemental français.
- (fr) Sentiweb (site officiel et bases de données du réseau « Sentinelles » de veille sanitaire et médicale sur la situation épidémiologique en France), édité par l'INSERM (Institut national de la santé et de la recherche médicale).
- (en) Avian influenza resource (updated) (source officielle), Organisation mondiale de la santé (OMS).
- (en) Avian Influenza (source officielle), portail de l’Organisation mondiale de la santé animale (OIE) au sujet de la grippe aviaire.
- (en) Avian Flu Disease Monitoring, portail de veille sur les situations d’urgence et désastres dans le monde, par le Joint Research Centre (JRC) de la Commission européenne.
- (en) Avian Influenza Monitoring Page, portail de veille développé par le Programme alimentaire mondial (WFP).
Plan de prévention mondial ou par pays :
- (fr)[PDF] Plan de lutte contre une « pandémie grippale » (source officielle), ministère français de la santé.
- (fr) Les mesures du gouvernement suisse (source officielle), Office fédéral de la santé publique.
- (fr) Agence française de sécurité sanitaire des aliments (AFSSA) (source officielle), mesures sanitaires contre le risque grippal lié aux produits alimentaires.
- (en)[PDF] Le plan anglais de prévention d'une pandémie de grippe (source officielle), NHS / DOH : départements nationaux pour la santé.
- (en) Avian Influenza Response (source officielle), de l’AID (Agence pour le développement international), gouvernement américain.
Information du public :
- (fr) Documentaire en ligne sur la grippe aviaire... (source officielle), Institut de Recherche pour le Développement (IRD) (France).
- (en) Key Facts About Avian Influenza (Bird Flu) and Avian Influenza A (H5N1) Virus: May 24, 2005. (source officielle), Centers for Disease Control (USA).
- (en) informations sur la grippe aviaire (source officielle), Departments of Health (Royaume-Uni).
- (en) FAQ sur la grippe aviaire (source officielle), Health Protection Agency (Royaume-Uni).
- (en) Global statistics of avian influenza (source officielle), gouvernement de Hong Kong.
- (fr) Site web du gouvernement belge qui rassemble toute information sur la grippe saisonnière et la grippe aviaire
Autres sources non officielles :
- (fr) Veille informative sur la grippe aviaire et le virus h5n1 - Actualités, Situation, Prévention, F.A.Q.
- (en) Flu Wiki Wiki spécialisé sur les différentes formes de grippe (articles, cartes, nombreuses sources et références).
- (fr) influenza.h5n1 la grippe aviaire : le nouveau risque mondial ? Blogue spécialisé indépendant, reconnu par de nombreuses sources, tout en français, faisant une veille sanitaire de qualité journalistique au sujet de la grippe et du virus H5N1 en particulier.
- (en) Latest publications on H5N1, BioJournal.com.
- (fr) Dossier grippe aviaire : Questions - Réponses
- (en) liens et resources; Library of Congress


