Luciférase
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Les luciférases (du latin lucifer « qui apporte la lumière ») sont les enzymes clés de la réaction de bioluminescence. La luciférase la plus connue est celle de Photinus pyralis, soit une luciole de la famille des Lampyridae. Cette enzyme est classée comme une mono-oxygénase ATP-dépendante. C’est une enzyme bifonctionnelle puisqu’elle catalyse les réactions de deux voies métaboliques distinctes, soit la voie de bioluminescence et la voie de synthèse de l’acyl-CoA[1]. Le terme Luciférase est dû à Raphaël Dubois, pionnier de l'étude des principes chimiques de la bioluminescence.
Réactions enzymatiques
[modifier | modifier le code]Réaction de bioluminescence
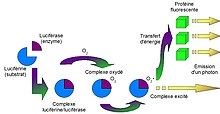
[modifier | modifier le code]La luciférase catalyse la réaction de bioluminescence en oxydant la luciférine en oxyluciférine en présence d’oxygène, d’ATP et de Mg2+. Ceci provoque alors l'émission d'un photon dont la lumière résultante est jaune-vert. Lors de cette réaction, l'ATP est hydrolysée en AMP. De plus, il est crucial que le substrat ait la bonne chiralité : D(-)-Luciférine pour que la réaction ait lieu[2].
Équations de la réaction de bioluminescence[2]
[modifier | modifier le code]Eq. 1. Luciférase + D-luciférine + ATP Luciférase: D-Luciférine-AMP + PPi
Eq. 2. Luciférase: D-Luciférine-AMP + O2 à Luciférase: Oxyluciférine*+ AMP +CO2
Eq. 3. Luciférase: Oxyluciférine* à Luciférase: Oxyluciférine + hv
Fonction catalytique dans la synthèse de l'acyle-CoA
[modifier | modifier le code]Cette enzyme possède aussi une fonction autre que la réaction de bioluminescence. En effet, lorsque la chiralité du substrat est inversée et que la réaction implique la L(+)-Luciférine, la luciféryl-CoA est formée. Les cofacteurs essentiels à cette réaction sont l’ATP, le Mg2+ et le coenzyme A. Il est à noter que les réactions sont inhibées en présence de leur énantiomère. Ainsi, [mcr1] la L(+)-Luciférine inhibe la réaction de bioluminescence alors que la D(-)-Luciférine inhibe la voie de synthèse de l’acyl-CoA[2].
Structure (P. pyralis)
[modifier | modifier le code]En 1987, le gène codant cette enzyme a été cloné et les séquences de nucléotides d’ADNc et d’ADN génomique ont été déterminées. Cette séquence contient 550 résidus d’acides aminés composant une seule chaine de polypeptides. Au niveau de la région C-terminus de la séquence se trouve un signal de localisation au peroxysome –Ser-Lys-Leu (-SKL). Le poids moléculaire moyen serait de 60,745 et le pI moyen de 6,42[2].
En 1996, la structure tertiaire de l’enzyme a été décrite. La molécule est composée deux domaines distincts, soit un gros domaine N-terminal (1-436 a.a.) et un petit domaine C-terminal (440-550 a.a.) qui sont reliés par un peptide linker flexible. Le domaine N-terminal est composé d’un baril-bêta antiparallèle et de deux feuillets bêta[2]. Lors de la réaction de l’enzyme, un changement conformationnel survient, les deux domaines de la molécule se replient l’un sur l’autre pour emprisonner le substrat.
Utilisations
[modifier | modifier le code]Ces enzymes sont largement utilisées comme gène rapporteur dans l'étude des séquences promotrices des gènes et sont à l'origine de la méthode d'ATPmétrie.
Utilisation comme gène rapporteur
[modifier | modifier le code]En clonage moléculaire, le gène de la luciférase peut être couplé avec un certain gène d’intérêt afin de s’assurer de l’efficacité de l’insertion de ce dernier. Puisque le gène rapporteur, soit le gène de la luciférase, et le gène d’intérêt sont fusionnés, ils seront toujours exprimés ensemble. La luminescence observée est donc directement liée à l’expression des gènes[3].
Dosage de l'ATP
[modifier | modifier le code]La réaction de bioluminescence catalysée par la luciférase est utilisée pour doser l’ATP, par exemple dans l’optique d’analyser la prolifération cellulaire ou bien la cytotoxicité de certaines cellules. La lumière émise, lors de cette réaction catalysée par la luciférase, est due au relâchement d’un photon lorsque l’un des intermédiaires de la réaction passe d’un état excité à un état relaxé. En plus du substrat, soit la D-luciférine, trois cofacteurs doivent être présents pour permettre la réaction, ainsi l’ATP, l’oxygène et le Mg2+ sont nécessaires à l’émission de lumière[2]. La concentration des réactifs influence ainsi l’activité de la luciférase. Le rôle de l’ATP en tant que cofacteur dans la réaction de bioluminescence sert ainsi à son dosage puisque lorsque la concentration d’ATP est limitante l’intensité de la lumière est proportionnelle à la concentration de cette molécule. Un luminomètre est utilisé pour mesurer l’intensité de lumière émise par la luciférase dans un échantillon donné[4].
Notes et références
[modifier | modifier le code]- (en) Yuichi Oba, « Firefly luciferase is a bifonctional enzyme: ATP-dependent monooxygenase and a long chain fatty acyl-CoA synthetase », FEBS, no 540, , p. 251-254
- (en) Satoshi Inouye, « Firefly luciferase: an adenylate-forming enzyme for multicatalytic functions », Cell. Mol. Life Sci., no 67, , p. 387-404
- « Luciferase Reporters », sur www.thermofisher.com (consulté le )
- « La bioluminescence de la luciole et son utilisation pratique », sur www.didier-pol.net (consulté le )


