Insuffisance cardiaque chez l'humain
| Causes | Infarctus du myocarde, hypertension artérielle, trouble du rythme cardiaque, alcoolisme, infection ou atteinte cardiaque (d) |
|---|---|
| Symptômes | Dyspnée, fatigue, œdème, ascite et anasarque |
| Traitement | Diurétique |
|---|---|
| Spécialité | Cardiologie |
| CISP-2 | K77 |
|---|---|
| CIM-10 | I50 |
| CIM-9 | 428.0 |
| DiseasesDB | 16209 |
| MedlinePlus | 000158 |
| eMedicine |
163062 emerg/108radio/189med/1367150ped/2636 |
| MeSH | D006333 |
| Patient UK | Heart-failure-diagnosis-and-investigation |
L’insuffisance cardiaque (IC) ou défaillance cardiaque correspond à un état dans lequel une anomalie de la fonction cardiaque est responsable de l'incapacité du myocarde à assurer un débit cardiaque suffisant pour couvrir les besoins énergétiques de l'organisme.
Cette défaillance peut être le reflet d'une anomalie de la contraction du muscle cardiaque ventriculaire (dysfonction systolique) ou de remplissage (dysfonction diastolique), voire des deux mécanismes.
Lorsque la défaillance atteint le ventricule gauche, on parle d'insuffisance ventriculaire gauche (IVG ou insuffisance cardiaque gauche) ; lorsqu'elle atteint le ventricule droit, on parle d'insuffisance ventriculaire droite (insuffisance cardiaque droite) ; lorsque la défaillance atteint les deux ventricules, on parle d'insuffisance cardiaque globale.
Il s'agit d'un syndrome pouvant être grave, avec un risque vital, et très souvent handicapant.
Épidémiologie
[modifier | modifier le code]C’est un syndrome fréquent inhérent aux pays industrialisés[1]. Le taux de mortalité à cinq ans est d'approximativement 50 %[2].
Au Royaume-Uni
[modifier | modifier le code]Selon une étude réalisée entre 2002 et 2014, il frappe chaque année deux à quatre personnes pour mille, tous âges confondus, soit à peu près autant que le nombre de nouveaux cas de cancer du sein, des poumons, de la prostate et colorectal confondus[1]. La prévalence de un à deux pour cent, tous âges confondus et augmente à dix pour cent chez les personnes âgées de 80 ans et plus[1]. La survie à un an, tous stades confondus, est de l’ordre de 65 %[3].
Aux États-Unis
[modifier | modifier le code]Près de 5 millions de personnes sont atteintes d’insuffisance cardiaque avec une incidence annuelle de 500 000. 12 à 15 millions de consultations par an et 6,5 millions d’hospitalisations y sont attribuables[4].
En France
[modifier | modifier le code]En 2001, le nombre d’insuffisants cardiaques s’élève à 500 000, avec 120 000 nouveaux cas chaque année ; l’incidence passe de 4 pour mille chez les hommes et 3 pour mille chez les femmes de 55 à 64 ans à 50 pour mille chez les hommes et 85 pour mille chez les femmes de 85 à 94 ans. Il y a 3,5 millions de consultations et 150 000 hospitalisations pour insuffisance cardiaque par an, avec une durée moyenne de séjour de 11 jours. L'insuffisance cardiaque est responsable de plus de 32 000 décès par an.
En 2018, selon une étude mise en place par le Groupe Insuffisance cardiaque et cardiomyopathies (GICC) de la Société française de cardiologie, le nombre d'insuffisants cardiaques a augmenté de 25 %, avec 1,5 million de personnes touchées. Elle provoque un décès toutes les 7 minutes et 70 000 morts par an[5]. En se fondant sur le vieillissement de la population française et en prenant en compte l'ensemble des maladies cardioneurovasculaires (hypertension, AVC et insuffisance cardiaque), l'Assurance maladie formule, d'ici 2020, l'hypothèse d'une augmentation de 13 % du nombre de personnes impactées, soit 5,1 millions de personnes qui représentent 600 000 de plus qu’en 2015[6].
Les dépenses liées à l’insuffisance cardiaque représentent plus de 1 % des dépenses médicales totales[7],[8].
L’âge moyen de survenue est de 73,5 ans ; 2/3 des patients ont plus de 70 ans.
La survie à cinq ans est semblable à celles des cancers du sein, de la vessie, du côlon, de l’ovaire et de la prostate[9]. Mais, on constate une amélioration des chiffres de la mortalité, grâce à une meilleure prise en charge médicamenteuse (Inhibiteur de l'enzyme de conversion et bêta-bloquants)[10].
Les progrès des traitements ont permis de très fortement diminuer la mortalité dans le post-infarctus. Cela fait augmenter le nombre de malades, tout comme l'augmentation de l’espérance de vie. L’insuffisance cardiaque est devenue en quelques décennies un problème majeur de santé publique[11].
Physiopathologie
[modifier | modifier le code]Les deux grands mécanismes responsables sont une dysfonction systolique (altération de la contraction du muscle qui réalise la systole ventriculaire, une éjection du sang en dehors du ventricule, vers l'aorte pour le ventricule gauche, vers l'artère pulmonaire pour le ventricule droit) et/ou une altération de la fonction diastolique seule (insuffisance cardiaque à fonction systolique préservée). Ces deux mécanismes entraînent une diminution du débit cardiaque.
Il existe des insuffisances cardiaques à débit élevé, ce sont des défaillances cardiaques où l'élévation permanente du débit est la cause de l'épuisement du muscle et non la conséquence[réf. nécessaire].
Conséquences de la diminution du débit cardiaque
[modifier | modifier le code]Le sang apporte des nutriments et de l'oxygène à l'ensemble de l'organisme. Il permet également d'en évacuer les déchets dont fait partie le gaz carbonique. Une diminution du débit sanguin ne permet donc pas d'assumer une fonction correcte de l'organisme[12].
En cas de baisse modérée du débit cardiaque, l'organisme tend à s'adapter en préservant au maximum le débit sanguin vers les organes vitaux (cerveau et cœur). Il diminue pour cela celui destiné aux autres organes par le biais d'une diminution du calibre des petites artères (vasoconstriction) par contraction des cellules musculaires incluses dans leur paroi. Cette redistribution du débit a plusieurs conséquences graves, notamment rénales. La baisse de la perfusion des reins entraîne, en réponse, une activation du système rénine-angiotensine-aldostérone qui provoque, d'une part une rétention d'eau et d'électrolytes avec diminution du volume de l'urine (antidiurèse), ce qui se traduit par une augmentation du volume sanguin circulant (pré-charge), et donc du travail du cœur; d'autre part une vasoconstriction avec élévation de la pression artérielle (post-charge), augmentant ainsi le travail du cœur. L'augmentation du travail du cœur, par élévation de la pré-charge et/ou de la post-charge est à l'origine d'un conflit biologique de fonctionnement. L'évolution naturelle de l'insuffisance cardiaque se fait donc vers une aggravation progressive et irrémédiable[réf. nécessaire].
Dans le cœur, l'incapacité à éjecter le sang correctement vers l'aval se traduit par une stagnation du sang dans le ventricule : la pression minimale (dite télédiastolique) est augmentée et passe de quelques millimètres de mercure à plus de 15 mmHg. Cette augmentation des pressions se répercute en amont : à gauche, vers l'oreillette gauche, les veines pulmonaires, les capillaires pulmonaires et l'artère pulmonaire, puis encore plus en amont, le ventricule droit, l'oreillette droite et le système veineux. La mesure de cette élévation de la pression télédiastolique, des veines (pression veineuse centrale) jusqu'au ventricule gauche. Un cathétérisme cardiaque ou plus souvent d'une échographie cardiaque, permettent le diagnostic d'une insuffisance cardiaque lorsque les autres éléments ne permettent pas de formuler un diagnostic.
Atteinte de la fonction systolique
[modifier | modifier le code]Le débit cardiaque dépend de la contractilité (correspondant à la fonction « pompe » du cœur), de la post-charge (correspondant globalement à la résistance à l'éjection ventriculaire) ou de la pré-charge (correspondant au remplissage des ventricules par du sang issu de l'amont). Toute altération de l'un de ces paramètres peut se traduire par un tableau d'insuffisance cardiaque. La loi de Frank-Starling fait office de référence.
Contractilité
[modifier | modifier le code]Le débit cardiaque est proportionnel à la fréquence cardiaque et au volume d'éjection systolique. Ce dernier correspond à la différence entre le volume diastolique (ventricule plein) et le volume systolique (volume du ventricule une fois vidé par la contraction de son muscle)[13]. Le rapport Volume d'éjection systolique/volume diastolique correspond à la fraction d'éjection, elle est une donnée clé pour analyser la fonction systolique. La fraction d'éjection est supérieure à 60 % chez l'individu normal et diminuée en cas d'anomalie de la contractilité, pouvant descendre jusqu'à 20 % en cas de dysfonction majeure.
Lorsque la fraction d'éjection est diminuée, l'organisme peut maintenir le débit de deux manières : en augmentant la fréquence cardiaque, ce qui explique la tachycardie, et en maintenant un volume d'éjection systolique constant en augmentant le volume diastolique. L'augmentation de ce dernier a pour conséquence visible une augmentation de la taille du cœur. Elle entraîne par ailleurs un étirement des fibres musculaires cardiaques, qui, en raison de ses propriétés élastiques, permet d'améliorer transitoirement sa contraction (mécanisme de Franck-Starling).
Lorsque ces mécanismes de compensation sont dépassés, le débit cardiaque diminue et devient insuffisant pour les besoins de l'organisme. Un tableau d'insuffisance cardiaque s'installe. La contractilité peut être atteinte dans les cardiomyopathies dilatées, les myocardites, les cardiopathies ischémiques, et de façon générale dans presque toutes les maladies cardiaques à un stade très avancé.
Pré-charge
[modifier | modifier le code]La pré-charge caractérise les conditions de remplissage des ventricules.
Les pressions de remplissage sont élevées lors d'une insuffisance cardiaque non traitée. Cette augmentation peut n'être que peu visible mais peut également se manifester par un œdème pulmonaire par extravasation de liquides à travers le capillaire pulmonaire vers les alvéoles. Elle peut être également visible au niveau veineux (dilatation des veines du cou, appelée turgescence jugulaire). Cette pré-charge est quantifiée par la mesure de la pression en fin de diastole (télédiastolique) du circuit sanguin. Elle peut être faite par l'introduction d'un cathéter dans une grosse veine (pression veineuse centrale dont la mesure ne se fait plus guère[Quoi ?]), dans les cavités cardiaques droites, dans l'artère pulmonaire jusqu'aux capillaires pulmonaires (par cathétérisme droit avec sonde de Swan-Ganz), dans le ventricule gauche (par cathétérisme par voie rétrograde au cours d'une coronarographie), ou indirectement par échographie-Doppler cardiaque.
Post-charge
[modifier | modifier le code]La post-charge correspond à la force que doit vaincre le myocarde pour éjecter le sang et elle peut être appréciée indirectement par la résistance à l'éjection du ventricule gauche (la pression artérielle est une appréciation approximative de la post-charge). Lorsqu'elle augmente de façon importante et prolongée, cela peut entraîner une insuffisance cardiaque. Elle est typiquement augmentée au cours de l'hypertension artérielle, du rétrécissement de la valve aortique ainsi que lors de certaines cardiomyopathies (cardiomyopathies obstructives).
Atteinte de la fonction diastolique
[modifier | modifier le code]La fonction diastolique cardiaque peut être atteinte lorsqu'il y a une anomalie de la relaxation et/ou de la compliance.
La relaxation du muscle cardiaque, correspondant au relâchement de ce dernier après sa contraction. Elle aboutit normalement à la diminution de la pression protodiastolique (en début de diastole) intraventriculaire en dessous de la pression de l'oreillette gauche, créant ainsi un véritable phénomène d'aspiration ventriculaire (remplissage ventriculaire rapide protodiastolique).
La compliance peut être assimilée à la relation entre la pression existante dans le ventricule et le volume de sang que ce ventricule contient. Elle est en rapport avec les propriétés élastiques du muscle qui peuvent être perturbées (par exemple, dans la cardiomyopathie restrictive).
L'altération de la relaxation et de la compliance vont entraîner une diminution du remplissage du ventricule gauche par perte de l'aspiration post-systolique (après la systole). De plus, en raison de la rigidité cardiaque, il y a augmentation de la pression diastolique et stase sanguine (et ce d'autant plus que le rythme cardiaque du sujet sera rapide).
Influence du rythme cardiaque
[modifier | modifier le code]Le débit cardiaque est, dans les conditions normales, proportionnel à la fréquence cardiaque. Si cette dernière est de manière chronique, trop basse (bradycardie), par bloc atrio-ventriculaire par exemple, un tableau d'insuffisance cardiaque peut s'installer. Si, au contraire, le rythme est trop rapide (tachycardie), le cœur n'a pas le temps de se remplir correctement entre chaque contraction : le remplissage en est donc altéré avec baisse du débit en conséquence.
Lors d'une fibrillation auriculaire, le rythme de l'oreillette est extrêmement rapide et désordonné et l'oreillette perd alors toute activité contractile efficace. Le remplissage des ventricules en est donc altéré et un tableau d'insuffisance cardiaque peut s'installer ou se majorer.
Mécanismes compensateurs
[modifier | modifier le code]Lorsqu'un état d'insuffisance cardiaque s'installe, l'organisme va mettre en œuvre une série de mécanismes (cardiaques ou extra-cardiaques) pour tenter de compenser la défaillance du muscle cardiaque.
Au niveau cardiaque, il existe ainsi une accélération de la fréquence cardiaque (tachycardie), une dilatation du ventricule gauche pour maintenir un volume d'éjection systolique suffisant, un épaississement du muscle cardiaque (hypertrophie ventriculaire gauche) pour diminuer la tension pariétale.
Au niveau périphérique (extra-cardiaque), il y a activation :
- du système adrénergique (effet tachycardisant et inotrope, vasoconstriction périphérique et stimulation du système rénine-angiotensine-aldostérone) ;
- du système rénine-angiotensine-aldostérone (vasoconstriction par le biais de l'angiotensine II et rétention hydrosodée par le biais de l'aldostérone) ;
- de la sécrétion d'arginine-vasopressine ou hormone antidiurétique (vasocontriction et effet antidiurétique) ;
- de la synthèse de l'endothéline (vasoconstriction) ;
- du facteur natriurétique auriculaire (vasodilatation et action diurétique) ;
- de la sécrétion de prostaglandines (vasodilatation).
Ces mécanismes sont parfois contradictoires et nocifs à long terme (une vasoconstriction entraîne, par exemple, une augmentation de la pression artérielle et donc de la post-charge, ce qui peut majorer l'insuffisance cardiaque). Les traitements proposés ont souvent pour but essentiel de régulariser ces mécanismes de compensation.
Diagnostic
[modifier | modifier le code]Signes fonctionnels
[modifier | modifier le code]Dans l'insuffisance ventriculaire gauche, on peut noter un essoufflement (dyspnée), une toux, des signes périphériques de bas débit cardiaque (asthénie, syndrome confusionnel, ralentissement psychomoteur, douleurs abdominales, nausées, vomissements et oligurie) et une hémoptysie.
Dans l'insuffisance ventriculaire droite, on peut noter une asthénie et/ou des douleurs hépatiques (hépatalgie) survenant à l'effort ou permanentes, voire des hépatalgies paroxystiques (tableau clinique proche de la colique hépatique).
Signes cliniques
[modifier | modifier le code]Dans l'insuffisance ventriculaire gauche, l'examen clinique peut retrouver une tachycardie. Les autres signes sont inconstants : à l'auscultation cardiaque peut exister un souffle d'insuffisance mitrale fonctionnelle, à l'auscultation pulmonaire, des râles crépitants et un épanchement pleural. Enfin des signes de la maladie cardiaque en cause peuvent être retrouvés.

Dans l'insuffisance ventriculaire droite, l'examen clinique retrouve également une tachycardie, et de manière inconstante, à l'auscultation cardiaque, un souffle d'insuffisance tricuspide fonctionnelle, un éclat du B2 (deuxième bruit cardiaque), une augmentation du volume du foie (hépatomégalie), un reflux hépato-jugulaire, des veines jugulaires externes trop apparentes en position assise (turgescence jugulaire), des œdèmes des membres inférieurs et parfois de l'ascite. Des signes de la maladie cardiaque en cause doivent être recherchées.
Examens complémentaires
[modifier | modifier le code]Biologie
[modifier | modifier le code]On peut doser le BNP ou le NT-proBNP, leur augmentation donnant des renseignements équivalents. Son taux est augmenté de manière importante et spécifique en cas d'insuffisance cardiaque systolique aiguë. Cette augmentation est moins constante en cas d'insuffisance cardiaque chronique ou si elle est de type diastolique. Elle est corrélée à la pression de remplissage du ventricule gauche. Sa mesure permet donc un débrouillage rapide des causes d'essoufflements dans un diagnostic d'urgences; dont un taux normal rendant très improbable une cause cardiaque[14]. En cas d'insuffisance cardiaque chronique, un taux élevé pourrait signifier un risque plus important de complications[15].
L'élévation du taux de troponine peut orienter vers un problème au niveau des artères coronaires. Elle a un intérêt pour évaluer le pronostic lors d'une poussée d'insuffisance cardiaque, une augmentation du taux de celle-ci étant plutôt péjorative[16].
Le retentissement rénal peut se traduire par une élévation du taux de la créatinine et de l'urée. Les effets secondaires des diurétiques peuvent retentir sur l'ionogramme sanguin.
Le retentissement hépatique (foie cardiaque) peut comporter des tableaux variés : cytolyse avec augmentation des transaminases, cholestase avec augmentation des phosphatases alcalines, une insuffisance hépatocellulaire avec baisse spontanée du taux de prothrombine, etc.
Électrocardiogramme
[modifier | modifier le code]Un électrocardiogramme est systématiquement réalisé à la recherche de signes en rapport avec la cardiopathie responsable. Il pourra mettre en évidence une tachycardie sinusale, et de manière inconstante, des signes d'hypertrophie ventriculaire gauche ou droite, des troubles de la conduction ou du rythme (flutter, fibrillation auriculaire et extrasystoles ventriculaires).
Radiographie standard
[modifier | modifier le code]Une radiographie pulmonaire peut mettre en évidence, suivant le degré d'insuffisance cardiaque :
- dans l'insuffisance ventriculaire gauche : une augmentation de taille de la silhouette cardiaque (cardiomégalie), une redistribution vasculaire aux sommets pulmonaires (stade précoce), de fines travées horizontales (lignes de Kerley B) traduisant la stase lymphatique et un épanchement pleural ;
- dans l'insuffisance ventriculaire droite : la silhouette cardiaque peut être de taille normale, une augmentation de volume des cavités cardiaques droites et/ou gauches (fonction de la maladie cardiaque responsable).
Échographie cardiaque
[modifier | modifier le code]La réalisation d'une échographie cardiaque est indispensable. Elle permet de renseigner sur la maladie cardiaque causale, de confirmer et de quantifier l'insuffisance cardiaque et de rechercher des complications (fuite mitrale, thrombus intra-auriculaire et hypertension artérielle pulmonaire).
En cas de dysfonction systolique, on notera une diminution de la fraction de raccourcissement (différence entre le diamètre ventriculaire en diastole et le diamètre en systole, rapporté au diamètre en diastole) et une diminution de la fraction d'éjection (différence entre le volume ventriculaire télédiastolique et le volume télésystolique, rapporté au volume ventriculaire télédiastolique). Le ventricule gauche apparaît, en règle[Quoi ?], dilaté et avec une contractilité diminuée (hypokinésie).
En cas de dysfonction diastolique, on notera l'absence de dilatation du ventricule gauche, une augmentation de l'épaisseur de sa paroi, d'où une augmentation des pressions entraînant une dilatation de l'oreillette gauche.
Autres
[modifier | modifier le code]La mesure de l'impédance thoracique varie avec le contenu en liquide : elle chute si cette dernière augmente, en cas de congestion pulmonaire par exemple. En pratique, cette impédance peut être mesurée et surveillée en continu, soit par une ou plusieurs électrodes externes (sur la peau) soit par une électrode interne, reliée à certains types de stimulateur cardiaque (pacemaker)[17]. Une variation de sa valeur pourrait être prédictif d'une décompensation à court terme[18].
Critères de Framingham pour le diagnostic d'insuffisance cardiaque
[modifier | modifier le code]L'intérêt est surtout historique, ces critères étant établis dans les années 1970, époque où l'on ne disposait pas des moyens d'investigation actuels. Le diagnostic était posé si deux critères majeurs ou un critère majeur et deux critères mineurs sont présents.
- Critères majeurs :
- dyspnée paroxystique nocturne ou orthopnée ;
- distension veineuse ;
- cardiomégalie ;
- râles crépitants ;
- œdème pulmonaire ;
- galop (B3) ;
- augmentation de la pression veineuse centrale ;
- reflux hépato-jugulaire.
- Critères mineurs :
- œdème bilatéral des chevilles ;
- toux nocturne ;
- dyspnée d'effort ;
- épanchement pleural ;
- hépatomégalie ;
- tachycardie (supérieure à 120 battements par minute) ;
- capacité vitale réduite de 30 %.
- Autres critères :
- perte de poids supérieure 4,5 kg en cinq jours en réponse à un traitement de l'insuffisance cardiaque.
Classifications
[modifier | modifier le code]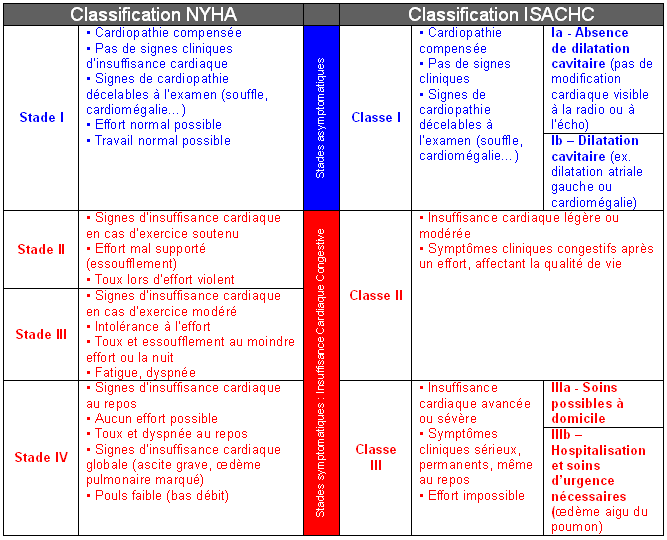
Il existe plusieurs façons de classer une insuffisance cardiaque : tout d'abord en fonction du côté du cœur atteint (insuffisance cardiaque gauche ou droite), et également selon que l'anomalie intéresse l'éjection ventriculaire (dysfonction systolique) ou le remplissage (on parle alors de dysfonction diastolique ou encore d'insuffisance cardiaque à fonction systolique conservée).
La classification NYHA (New York Heart Association) est fréquemment utilisée pour quantifier et surveiller le retentissement fonctionnel de l'insuffisance cardiaque pour un même individu :
- Stade I : pas de limitation, l'activité physique ordinaire n'entraîne pas de fatigue anormale, de dyspnée ou de palpitations ;
- Stade II : limitation modeste de l'activité physique : à l'aise au repos, mais l'activité ordinaire entraîne une fatigue, des palpitations ou une dyspnée ;
- Stade III : réduction marquée de l'activité physique : à l'aise au repos, mais une activité moindre qu'à l'accoutumée provoque des symptômes ;
- Stade IV : impossibilité de poursuivre une activité physique sans gêne : les symptômes de l'insuffisance cardiaque sont présents, même au repos et la gêne est accrue par toute activité physique.
Causes
[modifier | modifier le code]Certaines maladies peuvent entraîner une insuffisance cardiaque de plusieurs manières différentes. Le tabagisme et l'alcoolisme chroniques peuvent également amener à une insuffisance cardiaque, de même que certaines chimiothérapies.
Dysfonction systolique
[modifier | modifier le code]Insuffisance ventriculaire gauche par altération de la fonction musculaire
[modifier | modifier le code]- cardiopathies ischémiques ;
- myocardite : virale (coxsackie, VIH, covid ou protéine "spike"), bactérienne (rhumatisme articulaire aigu, typhoïde, légionellose) et/ou parasitaire (maladie de Chagas) ;
- cardiomyopathie dilatée à coronaires saines : primitive, toxique (alcool, anthracyclines), maladies de surcharge (maladie générale comportant une surcharge tissulaire ou cellulaire et dont les lésions sont liées directement ou indirectement à cette surcharge) et/ou certaines maladies de système : lupus érythémateux disséminé, périartérite noueuse ;
- maladies endocriniennes avec atteinte myocardique : thyréotoxicose, phéochromocytome et/ou acromégalie ;
- maladie neuromusculaire dégénérative (maladie de Steinert et/ou dystrophie de Duchenne de Boulogne) ;
- autres (cardiomyopathie du peripartum, cardiomyopathie de stress, etc.).
Insuffisance ventriculaire gauche par insuffisance de la pompe cardiaque
[modifier | modifier le code]- par surcharge de pression : hypertension artérielle, rétrécissement aortique, coarctation de l'aorte et/ou cardiomyopathie hypertrophique obstructive ;
- par surcharge de volume : insuffisance mitrale aiguë (rupture de cordage, dysfonction de pilier, endocardite), ou chronique, communication interventriculaire congénitale ou acquise (infarctus du myocarde) ;
- par surcharge en pression et en volume : insuffisance aortique aiguë (endocardite, dissection aortique), ou chronique, persistance du canal artériel.
Cardiopathies rythmiques
[modifier | modifier le code]L'insuffisance cardiaque est provoquée par une fréquence cardiaque trop rapide ou trop lente :
- fibrillation auriculaire et autres tachycardies supra-ventriculaires ;
- tachycardie ventriculaire (rarement) ;
- troubles de la conduction.
Insuffisance cardiaque à débit conservé
[modifier | modifier le code]- hyperthyroïdie ;
- anémie chronique ;
- carence en vitamine B1 ;
- fistule artério-veineuse congénitale ou acquise ;
- maladie osseuse de Paget.
Insuffisance ventriculaire droite
[modifier | modifier le code]- secondaire à une insuffisance ventriculaire gauche évoluée ;
- rétrécissement tricuspide serré ;
- hypertension artérielle pulmonaire primitive ou secondaire ;
- infarctus du myocarde du ventricule droit ;
- dysplasie arythmogène du ventricule droit.
Dysfonction diastolique
[modifier | modifier le code]- remodelage concentrique du ventricule gauche : cardiomyopathies primitives obstructives ou non, cardiomyopathies secondaires à une surcharge de pression (hypertension artérielle systolo-diastolique et/ou rétrécissement aortique) ;
- cardiopathie ischémique ;
- cardiopathie diabétique ;
- amylose cardiaque ;
- hémochromatose ;
- maladies de surcharge ;
- cardiomyopathie restrictive ;
- Maladie du péricarde (dont péricardite constrictive ou tamponnade).
Prise en charge
[modifier | modifier le code]Les objectifs du traitement sont de ralentir la progression de l'insuffisance cardiaque voire d'améliorer la fonction cardiaque, tout en corrigeant les facteurs aggravants. La prise en charge de l'insuffisance cardiaque a fait l'objet de la publication de plusieurs recommandations, les plus notables étant les américaines (2022[19]) et les européennes (actualisées en 2021[2]). Les traitements peuvent réduire la mortalité, approximativement, de 70 %[20].
L'insuffisance cardiaque aiguë a ses propres recommandations : celles de l'European Society of Cardiology datent de 2015[21].
Règles hygiéno-diététiques
[modifier | modifier le code]Elles sont impératives[22] et comportent plusieurs points :
- éducation du patient et de sa famille : une surveillance régulière du poids est nécessaire, avec la consigne en cas de prise de plus de 2 kg en 3 jours de consulter le médecin ou le cardiologue traitant. Certains patients peuvent, en outre, être éduqués à modifier eux-mêmes leurs doses de diurétiques en fonction des symptômes (prise de poids rapide par exemple) ;
- mesures diététiques : le contrôle de l’apport sodé est impératif, dont la sévérité dépend de la gravité de l'insuffisance cardiaque. Il peut être associé à une restriction hydrique plus ou moins importante, afin de lutter contre la baisse du taux de sodium secondaire à la prise de diurétiques. L’alcool est toléré en l’absence de cardiomyopathie alcoolique, dans la mesure d’un à deux verres de vin par jour[réf. nécessaire].
Certains médicaments sont à éviter. Ce sont ceux qui majorent une rétention d'eau ou de sel (anti-inflammatoires non stéroïdiens ou coxibs, corticoïdes, glitazones), ceux qui peuvent interférer avec les médicaments de l'insuffisance cardiaque (lithium), ceux qui peuvent diminuer la contraction du muscle cardiaque (certains inhibiteurs calciques, antidépresseurs tricycliques), ceux qui peuvent aggraver des troubles du rythme (anti-arythmiques de classe I).
Il faut encourager la poursuite des activités quotidiennes avec les adaptations qui s’imposent, la meilleure activité physique étant orientée vers l'endurance : marche à pied, vélo, promenade… L'exercice physique améliore marginalement le pronostic[23] mais surtout l'état général[24]. Le repos n'est préconisé qu'en cas de décompensation. Une réadaptation cardiaque dans un centre spécialisé peut être intéressante dans ce but.
La grossesse dans une insuffisance cardiaque de stade III, IV a peu de chances d’être menée à terme et présente un risque élevé de morbi-mortalité. Les produits faiblement dosés en œstrogènes et progestatifs ne présentent que de faibles risques thrombotiques, les dispositifs intra-utérins ne sont adaptés qu’en l’absence de valvulopathie. Une contraception efficace est donc possible et doit être proposée à toute femme insuffisante cardiaque en âge de procréer, en expliquant les risques encourus en cas de grossesse.
L’arrêt du tabac doit être activement encouragé et peut comprendre une aide médicalisée, l’utilisation de substituts nicotiniques, etc.
La télésurveillance de l'insuffisance cardiaque à domicile permet de réduire la mortalité et le nombre d'hospitalisation[25].
Traitement médicamenteux de l'insuffisance cardiaque systolique
[modifier | modifier le code]Inhibiteurs de l'enzyme de conversion
[modifier | modifier le code]Le traitement par inhibiteur de l'enzyme de conversion (IEC) est indiqué à tous les stades de l’insuffisance cardiaque liée à une dysfonction systolique[26] (fraction d’éjection inférieure à 45 % pour l’European Society of Cardiology, ou inférieure à 40 % selon les critères de la Haute Autorité de Santé)[27] avec ou sans surcharge volémique. Ils sont indiqués en première intention chez les patients dont la fraction d’éjection est altérée avec fatigue ou dyspnée modérée à l’effort sans signe de surcharge volémique. Le traitement par IEC doit, dans la mesure du possible, être donné aux doses ayant montré leur efficacité dans les études sur l’insuffisance cardiaque et ne pas se limiter à la dose minimum permettant une amélioration des symptômes. L'augmentation des doses peut cependant être limitée par la survenue d'une Insuffisance rénale aiguë (surveillance régulière par le dosage de créatinine sanguine) ou par une pression artérielle trop basse.
En cas de dysfonction du ventricule gauche (VG) asymptomatique, les IEC ralentissent la progression vers l’insuffisance cardiaque, et réduisent également le risque d’infarctus du myocarde et de mort subite (étude SOLVD).
En cas de rétention hydrosodée (œdèmes) ou si le patient reste symptomatique, les IEC doivent être associés aux diurétiques[26],[28]. Le traitement par IEC doit être débuté même si les symptômes d’insuffisance cardiaque sont transitoires après la phase aigüe de l'infarctus du myocarde, afin d’améliorer la survie et de réduire les récidives d’infarctus et les hospitalisations pour insuffisance cardiaque[29],[30].
Les effets secondaires liés aux IEC sont la toux, l’hypotension, l’insuffisance rénale et l’hyperkaliémie, plus rarement les syncopes et l’angiœdème. Les antagonistes des récepteurs de l’angiotensine II peuvent être utilisés comme une alternative efficace aux IEC. Les modifications de pression artérielle systolique et diastolique et l’augmentation de la créatinine sanguine sont habituellement modérées chez les patients normotendus.
Les IEC sont contre-indiqués en cas de sténose bilatérale des artères rénales et en cas d’antécédent d’angiœdème lors d’un traitement précédent par IEC.
On recommande un contrôle régulier de la fonction rénale, avant traitement, une à deux semaines après chaque palier et tous les trois à six mois. La fréquence de ces contrôles doit être augmentée en cas d'anomalie de l'ionogramme sanguin et/ou de la fonction rénale.
Antagonistes des récepteurs de l’angiotensine II (ARAII ou sartan)
[modifier | modifier le code]Pour les patients présentant une dysfonction systolique ventriculaire gauche, les ARAII peuvent être utilisés comme une alternative aux inhibiteurs de l'enzyme de conversion chez les patients symptomatiques intolérants à ces derniers[31],[32],[33]. Les ARAII et les IEC semblent avoir une efficacité comparable sur la morbi-mortalité de l’ICC, notamment dans les suites d'un infarctus du myocarde[34].
Les ARAII peuvent être associés aux IEC chez les patients qui restent symptomatiques, et permettent de réduire la mortalité et les réadmissions pour insuffisance cardiaque[34]. Mais chez les patients NYHA III restant symptomatiques sous diurétiques ICE et bêtabloquants il n’y a pas de preuve pour recommander l’ajout d’un ARAII[réf. nécessaire].
Antagoniste des récepteurs à l'Angiotensine/inhibiteur de la néprilisine (ARNI)
[modifier | modifier le code]Le LCZ696 (valsartan/sacubitril) est utilisé dans l'insuffisance cardiaque fraction d'éjection basse.
Ce médicament associe un ARA II avec un inhibiteur de la néprilysine. L'essai en phase III sur 8 000 patients au stade NYHA 2 à NYHA 4 a montré une diminution de 20 % des hospitalisations et de la mortalité cardiovasculaire et de 16 % de la mortalité toutes causes[35],[36]. L'essai a été réalisé sur des patients recevant le meilleur traitement possible avec un groupe recevant de l'énalapril, un IEC, et un autre du . À terme, ce médicament pourrait remplacer les IEC, ce qui constitue une avancée majeure depuis l'introduction des bêtabloquants dans l'IC stable. Il ne faut par contre jamais associer IEC et sacubutril/valsartan.
L'utilisation de cette molécule est recommandée dans les consignes européennes[37] et américaines[38] depuis . Les patients pouvant bénéficier de ce traitement doivent être semblables à ceux inclus dans l'étude « Paradygme »[36] qui a testé l'hypothèse selon laquelle les ARNI étaient supérieures à un traitement d'IEC ou de sartant. Il faut donc que le patient remplisse les critères suivants :
- plus de 18 ans ;
- symptomatique d'une insuffisance cardiaque (classe NYHA II à IV) ;
- fraction d'éjection du ventricule gauche de ≤35 % ;
- BNP ≥150 pg/mL ou NT proBNP ≥600 pg/mL si pas d'hospitalisation dans la dernière année ;
- BNP ≥100 pg/mL ou NT proBNP ≥400 pg/mL si hospitalisée pour une insuffisance cardiaque dans la dernière année ;
- traitement avec un IEC ou un sartant avec une dose stable les 4 semaines avant le début du traitement et prise d'une dose équivalente ou supérieure à 10 mg d'enalapril ;
- traitement avec un bêtabloquant avec une dose stable depuis 4 semaines.
Les critères d'exclusion de l'étude « Paradygme »[36] était :
- hypotension symptomatique, Tension artérielle inférieure à 95 mmHg ;
- eGFR <30 mL/min/1,73 m2
- potassium >5,2 mmol/L ;
- antécédent d'angio-œdème ;
- effets secondaires « inacceptables » sous IEC ou sartan.
Glifozines
[modifier | modifier le code]Ce sont des médicaments inhibiteurs du SGLT2. Développés initialement pour le traitement du diabète de type 2, ils permettent, en cas de fraction d'éjection basse, et même en l'absence de diabète, d'obtenir une excrétion urinaire du sodium, sans influencer le taux de potassium sanguin, contrairement aux diurétiques. Les principales molécules testées dans l'insuffisance cardiaque sont la dapagliflozine et l'empagliflozine. Ils permettent d'améliorer les symptômes[39]ainsi que le pronostic[40].
Diurétiques
[modifier | modifier le code]Les diurétiques de l’anse et les thiazidiques constituent un traitement symptomatique en cas de surcharge hydrosodée entraînant des œdèmes périphériques ou une surcharge pulmonaire. Il n’y a pas d’études contrôlées étudiant leur effet sur la survie. Les diurétiques doivent donc toujours être prescrits en association avec les IEC et des bêtabloquants s’ils sont tolérés.
Les diurétiques épargneurs de potassium (autre que la spironolactone) ne sont prescrits qu’en cas de diminution persistante du taux de potassium dans le sang (hypokaliémie) en dépit d’un traitement par IEC, ou dans les stades avancés de l’insuffisance cardiaque, d’un traitement associant IEC et de faibles doses de spironolactone. Ils sont cependant contre-indiqués en cas d'insuffisance rénale.
La spironolactone est un antagonistes des récepteurs à l’aldostérone. Son emploi est recommandé dans l’insuffisance cardiaque avancée (NYHA III – IV) en association avec les IEC les bêtabloquants et les diurétiques, car il améliore dans ce cas, la morbi-mortalité[41]. Un dérivé de la spironolactone, l'éplérénone, a également montré son efficacité en association aux IEC et bêtabloquants après un infarctus avec dysfonction systolique et signes d’insuffisance cardiaque ou diabète avec, également, une réduction de la morbi-mortalité[42].
Bêtabloquants
[modifier | modifier le code]Les bêtabloquants sont recommandés pour le traitement de tous les patients présentant une insuffisance cardiaque stable, de légère à sévère (NYHA II, III, IV), en association avec des diurétiques et des IEC (hors contre-indications)[43].
Le traitement par bêtabloquant réduit les hospitalisations (de toutes causes), améliore le stade NYHA et réduit la progression de l’insuffisance cardiaque. Ces effets bénéfiques ont été constatés chez tous les sous groupes quels que soient l’âge, le sexe, le stade NYHA, la fraction d'éjection et l’origine ischémique ou non de l’insuffisance cardiaque. Cela est particulièrement net dans les suites d'un infarctus du myocarde[44].
Seuls quatre bêtabloquants ont fait leurs preuves dans la réduction de la mortalité dans l'insuffisance cardiaque stable, le bisoprolol, le carvédilol, le métoprolol[45] et le nébivolol. D'autres bêtabloquants ont été testés avec des résultats décevants[46].
Le traitement doit être initié prudemment et augmenté très progressivement jusqu’à la dose cible utilisée dans les études. Les effets secondaires sont à type de bradycardie ou d'insuffisance cardiaque aigüe transitoire.
Glucosides cardiotoniques
[modifier | modifier le code]Les digitaliques sont spécifiquement indiqués pour l’insuffisance cardiaque systolique symptomatique s’accompagnant d’un rythme ventriculaire rapide lors d'une fibrillation auriculaire, avec ou sans dysfonction ventriculaire gauche.
L’association digoxine / bêta-bloquants est supérieure à ces deux produits utilisés séparément[22]. En rythme sinusal, la digoxine est recommandée pour améliorer l’état clinique des patients présentant une persistance des symptômes malgré l’association IEC-diurétiques. La digoxine ne réduit pas la mortalité mais réduit le taux d’hospitalisation pour décompensation cardiaque[47].
Dérivés nitrés
[modifier | modifier le code]Il s'agit d'un traitement adjuvant et symptomatique dans l’insuffisance cardiaque, en plus de son effet propre en cas d'angine de poitrine. Il n'y a cependant pas de preuve d'une efficacité sur la morbidité ou la mortalité et doit donc être donné, en plus des autres traitements[réf. nécessaire].
Inhibiteurs calciques
[modifier | modifier le code]Les inhibiteurs calciques ne sont pas recommandés dans le traitement de l'insuffisance cardiaque systolique, car, de par leur mécanisme d'action, ils peuvent théoriquement diminuer la contraction du muscle cardiaque (effet inotrope négatif). Le diltiazem et le vérapamil, par leur effet bradycardisant, sont de plus contre indiqués en association aux bêtabloquants.
L’ajout d’amlopidine ou de felodipine au traitement standard de l’insuffisance cardiaque n’améliore pas les symptômes et n’a pas d’impact sur la survie[48],[49]. Ces deux molécules neutres sur la survie à long terme peuvent éventuellement être utilisées comme traitement d’une HTA non contrôlée par les dérivés nitrés et les bêtabloquants[réf. nécessaire].
Agents inotropes positifs
[modifier | modifier le code]Ils peuvent être utilisés dans les épisodes de décompensation sévère, et en solution d’attente pré-transplantation.
Les agents inotropes par voie orale et/ou administrés de manière prolongée augmentent la mortalité et ne sont donc plus guère utilisés.
Traitements anticoagulants
[modifier | modifier le code]Ils n'ont pas d’indications en dehors de la fibrillation auriculaire ou d'une complication embolique ; les anticoagulants n’ont pas montré d’efficacité ni sur la mortalité ni sur la survenue d’évènements cardiovasculaires[22].
Anti arythmiques
[modifier | modifier le code]Les classes I doivent être évités car délétères[réf. nécessaire].
Les bêtabloquants réduisent la mort subite et peuvent être indiqués dans la prise en charge des tachyarythmies soutenues ou pas, seul ou en association avec l’amiodarone.
L’amiodarone est efficace sur les arythmies ventriculaires et supra ventriculaire, mais une administration de routine chez les patients insuffisants cardiaques n’est pas justifiée[22].
Autres
[modifier | modifier le code]L'ivabradine, ralentisseur de la fréquence cardiaque en association avec les bêta-bloquants donne des résultats mitigés[50],[51].
Traitements non médicamenteux
[modifier | modifier le code]L'activité physique pratiqué de manière régulière, notamment sous supervision d'un kinésithérapeute, diminue :
- le nombre d'hospitalisation à cause d'une décompensation cardiaque ;
- le nombre d'hospitalisations toutes causes confondues[52].
L'exercice physique d'autre part améliore la qualité de vie dans les 6 à 12 mois[52]. Le yoga et le Tai chi également[53].
En cas de bloc de branche (surtout gauche), se manifestant sur l'électrocardiogramme par un QRS élargi, il existe un asynchronisme de contraction : certaines parois du ventricule gauche se contractent en retard par rapport aux autres, entraînant une diminution du débit cardiaque et parfois une insuffisance mitrale. La pose d'un stimulateur cardiaque multi site permet de corriger partiellement cette anomalie. Elle consiste à implanter, en plus des sondes de stimulation classiques dans l'oreillette droite et dans le ventricule droit, une troisième sonde ventriculaire gauche placée dans une branche du sinus coronaire qui permet une stimulation directe du ventricule gauche par voie épicardique. La stimulation simultanée des deux ventricules permet de corriger l'asynchronisme et ses effets délétères. Par ailleurs, l'optimisation du délai entre stimulation auriculaire et ventriculaire permet d'améliorer le remplissage des cavités cardiaques et donc le débit cardiaque. La resynchronisation cardiaque améliore les symptômes de l'insuffisance cardiaque : moins d'essoufflement (dyspnée) et qualité de vie augmentée[54]. Elle diminue le risque de survenue de décompensation et d'hospitalisation, et améliore les paramètres de mesure de la fonction de pompe cardiaque[55], même pour les patients, initialement peu ou pas symptomatiques[56]. Elle abaisse également la mortalité toute cause et la mortalité par mort subite[54]. La stimulation bi-ventriculaire est actuellement indiquée chez des patients insuffisants cardiaques ayant une fraction d'éjection inférieure à 35 %, une dyspnée de stade III ou IV, un ventricule gauche dilaté, un bloc de branche, et ce malgré un traitement médical optimal.
En cas de fraction d'éjection effondrée (inférieure à 35 %), le risque de mort subite est par ailleurs très sensiblement accru malgré le traitement médicamenteux. La pose d'un défibrillateur automatique implantable prévient efficacement ce risque. Il peut être couplé dans le même appareil à une resynchronisation cardiaque.
En cas d'insuffisance cardiaque grave et réfractaire au traitement médicamenteux, une transplantation cardiaque peut être proposée si le terrain le permet (état général, âge et absence d'autres maladies graves). Une assistance ventriculaire ou un cœur artificiel peuvent être également préconisés.
La coenzyme Q10 pourrait avoir un effet bénéfique sur la mortalité toutes causes confondues, tandis que le régime méditerranéen pourrait réduire le risque de survenue d'une insuffisance cardiaque[57]. La supplémentation en vitamine D, en L-carnitine ou en thiamine peut améliorer la fraction d'éjection ventriculaire gauche, mais aucune étude de qualité ne permet d'évaluer son impact sur les résultats cliniques[57]. La supplémentation en vitamine E a entrainé une légère augmentation statistiquement significative du risque d'hospitalisation pour insuffisance cardiaque[57]. Cependant, une supplémentation modérée en oméga 3 est recommandée[58].
Traitement médicamenteux de l'insuffisance cardiaque diastolique
[modifier | modifier le code]Dans la population âgée, le pourcentage de patients hospitalisés pour insuffisance cardiaque présentant une fraction d’éjection préservée pourrait atteindre 35 à 45 %. Les chiffres dépendent de la limite que l’on pose arbitrairement, soit 45 % de fraction d’éjection pour l’European Society of Cardiology ou 40 % pour la Haute Autorité de Santé[59].
Insuffisance cardiaque avec fonction systolique préservée et insuffisance cardiaque due à une dysfonction diastolique ne sont pas synonymes. Le premier diagnostic implique la preuve d’une fonction systolique préservée, sans pour autant qu’une dysfonction diastolique ait été démontrée. Le diagnostic de dysfonction diastolique isolée requiert la preuve d’une anomalie de la fonction diastolique, ce qui peut être difficile à pointer. Les facteurs aggravants doivent être identifiés et corrigés, en particulier la tachyarythmie. Certaines maladies du myocarde entraînent spécifiquement un trouble de la relaxation : les cardiomyopathies restrictives, hypertrophiques obstructive et non obstructive, et les cardiomyopathies infiltratives. Cependant une grande majorité des patients insuffisants cardiaques chroniques à fonction systolique conservée n’ont pas de cardiomyopathie identifiée mais présentent une dysfonction diastolique. Cette maladie touche principalement la femme âgée souffrant d’hypertension. Par ailleurs le vieillissement du système cardiovasculaire altère plus profondément la fonction diastolique que systolique[60],[61].
Les recommandations pratiques pour le traitement font l’objet d’un consensus ; il n’y a pas de différence notable quant à l’utilisation des IEC, bêtabloquants, ARAII, diurétiques et de la spironolactone. La particularité du traitement tient plutôt à l’utilisation du vérapamil[22]. Les inhibiteurs de l'enzyme de conversion peuvent améliorer directement la relaxation et la distensibilité cardiaque et peuvent avoir un effet bénéfique à long terme de par leur action anti hypertensive et en faisant régresser l’hypertrophie ventriculaire gauche et la fibrose[réf. nécessaire]. Les diurétiques peuvent être nécessaires en cas de surcharge hydro sodée mais doivent être utilisés avec précautions afin de ne pas trop réduire la pré charge (réduisant de ce fait le débit cardiaque). Les bêtabloquants peuvent être institués pour réduire le rythme cardiaque et augmenter la période de remplissage de la diastole. Les inhibiteurs calciques comme le vérapamil peuvent être utilisés pour les mêmes raisons[62] notamment chez les patients porteurs d’une cardiomyopathie hypertrophique[63]. Des doses élevées d’inhibiteurs de l'angiotensine II peuvent réduire le nombre d’hospitalisations[64].
Les résultats du traitement médicamenteux restent mitigés : s'ils ont un effet démontré sur les symptômes, aucun ne démontrent une influence sur la mortalité[65].
Futurs traitements en développement
[modifier | modifier le code]L'utilisation des cellules souches pluripotentes (hiPSCs) du patient lui-même pourrait traiter l'insuffisance cardiaque de ce dernier[66]. Comme les cellules reprogrammées seraient dérivées du patient lui-même, cela pourrait éviter le problème de rejet des cellules comme corps étranger du système immunitaire des patients[67].
Évolution et complications
[modifier | modifier le code]L'évolution et le pronostic dépendent de la pathologie responsable de l'insuffisance cardiaque.
L’évolution peut être émaillée de complications dont les plus fréquentes sont les troubles du rythme (surtout la fibrillation auriculaire), les accidents thromboemboliques et l'insuffisance rénale.
Les facteurs de décompensation aiguë sont l'anémie, une infection, une embolie pulmonaire, l'insuffisance respiratoire, une hypo ou hyperthyroïdie, un excès de sel et/ou l'arrêt d'un traitement.
Notes et références
[modifier | modifier le code]- Cet article est partiellement issu d’une traduction de l’article en anglais : Heart failure.
- (en) V. N. Singh, Congestive Heart Failure. eMedicine.com. Congestive Heart Failure Imaging
- (en) Nathalie Conrad, Andrew Judge, Jenny Tran et Hamid Mohseni, « Temporal trends and patterns in heart failure incidence: a population-based study of 4 million individuals », The Lancet, (DOI 10.1016/s0140-6736(17)32520-5, lire en ligne, consulté le )
- (en) McDonagh TA, Metra M, Adamo M et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC, Eur Heart J, 2021;42:3599–3726
- (en) Cowie MR. Annotated references in epidemiology, Eur J Heart Fail, 1999;1:101-7
- (en) Hunt SA, Baker DW, Chin MH et als. ACC/AHA guidelines for the evaluation and management of chronic heart failure in the adult: executive summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to revise the 1995 Guidelines for the Evaluation and Management of Heart Failure), J Am Coll Cardiol, 2001;38:2101-13
- Insuffisance cardiaque : trop de symptômes ignorés par les français, publié le par Karelle Goutorbe, sur le site Le Quotidien du médecin (consulté le 24 juillet 2019)
- Les 5 chiffres marquants des dépenses de santé en France, publié le par Nicolas Raffin, sur le site 20 minutes (consulté le 24 juillet 2019)
- (en) Delahaye F, Roth O, Aupetit JF, de Gevigney G, Epidemiology and prognosis of cardiac insufficiency, Arch Mal Cœur Vaiss, 2001;94:1393-403
- Cliniciens : Insuffisance cardiaque, publié sur le site roche-diagnostics.fr (consulté le 24 juillet 2019)
- (en) Stewart S, McIntyre K, Hole DJ, Capewell S, McMurray JJ, More 'malignant' than cancer? Five-year survival following a first admission for heart failure, Eur J Heart Fail, 2001;3:315-22.
- (en) Schaufelberg M, Swedberg K, Koster M et als. Decreasing one year mortality and hospitalisation rates for heart failure in Sweden. Data from the Swedish Hospital Discharge Registry, Eur Heart J, 2004;25:300–307
- (en) Zannad F, Braincon S, Juillère Y et als. Incidence, clinical and etiologic features, and outcomes of advanced chronic heart failure: the EPICAL Study. Épidémiologie de l'Insuffisance Cardiaque Avancée en Lorraine, J Am Coll Cardiol, 1999; 33:734-42
- Insuffisance cardiaque, mise à jour le par Xavier Gruffat, sur le site Creapharma.ch (consulté le 29 mars 2018)
- On parle en toute rigueur de volume télésystolique et de volume télédiastolique, le terme télé signifiant fin de. Les volumes ainsi définis correspondent aux valeurs minimales et maximales des volumes ventriculaires.
- (en) Maisel AS, Krishnaswamy P, Nowak RM, et als. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure, N Engl J Med, 2002;347:161-167
- (en) Sugiura T, Takase H, Toriyama T, Goto T, Ueda R, Dohi Y, Circulating levels of myocardial proteins predict future deterioration of congestive heart failure, J Card Fail, 2005;11:504-509
- (en) Peacock WF, De Marco T, Fonarow GC et Als. Cardiac troponin and outcome in acute heart failure, N Eng J Med, 2008;358:2117-2126
- (en) Tang W, Tong W, Measuring impedance in congestive heart failure: Current options and clinical applications, Am Heart J, 2009;157:402-411
- (en) Packer M, Abraham WT, Mehra MR et als. Utility of impedance cardiography for the identification of short-term risk of clinical decompensation in stable patients with chronic heart failure, J Am Coll Cardiol, 2006;47:2245–2252
- Heidenreich PA, Bozkurt B, Aguilar D et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure, J Am Coll Cardiol, 2022;79:e263-e421
- (en) Vincenzo De Marzo, Gianluigi Savarese, Lucia Tricarico et Sofia Hassan, « Network meta-analysis of medical therapy efficacy in more than 90,000 patients with heart failure and reduced ejection fraction », Journal of Internal Medicine, vol. 292, no 2, , p. 333–349 (ISSN 1365-2796, PMID 35332595, PMCID 9546056, DOI 10.1111/joim.13487, lire en ligne, consulté le )
- (en) Mebazaa A, Yilmaz MB, Levy P et al. Recommendations on pre-hospital and early hospital management of acute heart failure: a consensus paper from the Heart Failure Association of the European Society of Cardiology, the European Society of Emergency Medicine and the Society of Academic Emergency Medicine, Eur Heart J, 2015;36:1958-1966
- (en) Swedberg K, Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005) The Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology, European Heart Journal, 2005;26:1115-1140
- (en) O’Connor CM, Whellan DJ, Lee KL et al. Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial, JAMA, 2009;301:1439-1450
- (en) Flynn KE, Piña IL, Whellan DJ, Effects of exercise training on health status in patients with chronic heart failure: HF-ACTION randomized controlled trial, JAMA, 2009;301:1439-1450
- Scholte N, Gürgöze M, Aydin D et al. Telemonitoring for heart failure: a meta-analysis, Eur Heart J, 2023;44:2911–2926
- (en) Flather M, Yusuf S, Kober L et als. Long-term ACE-inhibitor therapy in patients with heart failure or left-ventricular dysfunction: a systematic overview of data from individual patients. ACE-Inhibitor Myocardial Infarction Collaborative Group, Lancet, 2000;355:1575–1581.
- Les guides ALD de la Haute Autorité de Santé : Insuffisance cardiaque systolique symptomatique chronique. guide ALD no 5;
- (en) The Consensus Trial Study Group, Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS), N Engl J Med, 1987;316:1429–1435.
- (en) Pfeffer MA, Braunwald E, Moye LA et als. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial, N Engl J Med 1992;327:669–677.
- (en) Kober L, Torp-Pedersen C, Carlsen JE et als. Effects on mortality by trandolapril after myocardial infarction, N Engl J Med, 1995;333:1670–1676.
- (en) Pfeffer MA, Swedberg K, Granger CB et als. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme, Lancet, 2003;362:759–766.
- (en) Maggioni AP, Anand I, Gottlieb SO et als. Effects of valsartan on morbidity and mortality in patients with heart failure not receiving angiotensin-converting enzyme inhibitors, J Am Coll Cardiol, 2002;40:1414–1421.
- (en) Cohn JN, Tognoni G, A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure, N Engl J Med, 2001;345:1667–1675
- (en) Pfeffer MA, McMurray JJ, Velazquez EJ et als. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both, N Engl J Med, 2003;349:1893–1906.
- (en) (en) McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Solomon SD, Swedberg K, Zile MR; Paradigm-HF Investigators and Committees, « Angiotensin-neprilysin inhibition versus enalapril in heart failure », N Engl J Med, vol. 371, no 11, , p. 993-1004. (PMID 25176015, DOI 10.1056/NEJMoa1409077, lire en ligne [html])
- (en) John J.V. McMurray, Milton Packer, Akshay S. Desai et Jianjian Gong, « Angiotensin–Neprilysin Inhibition versus Enalapril in Heart Failure », New England Journal of Medicine, vol. 371, , p. 993–1004 (DOI 10.1056/nejmoa1409077, lire en ligne, consulté le )
- (en) Massimo F. Piepoli, Arno W. Hoes, Stefan Agewall et Christian Albus, « 2016 European Guidelines on cardiovascular disease prevention in clinical practice », European Heart Journal, , ehw106 (ISSN 0195-668X et 1522-9645, PMID 27222591, DOI 10.1093/eurheartj/ehw106, lire en ligne, consulté le )
- (en) Clyde W. Yancy, Mariell Jessup, Biykem Bozkurt et Javed Butler, « 2016 ACC/AHA/HFSA Focused Update on New Pharmacological Therapy for Heart Failure: An Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America », Circulation, , CIR.0000000000000435 (ISSN 0009-7322 et 1524-4539, PMID 27208050, DOI 10.1161/CIR.0000000000000435, lire en ligne, consulté le )
- Nassif ME, Windsor SL, Tang F et al. Dapagliflozin effects on biomarkers, symptoms, and functional status in patients With heart failure with reduced ejection fraction, The DEFINE-HF Trial, Circulation, 2019;140:1463–1476
- McMurray JJV, Solomon SD, Inzucchi SE et al. Dapagliflozin in patients with heart failure and reduced ejection fraction, N Engl J Med, 2019;381:1995-2008
- (en) Pitt B, Zannad F, Remme WJ et als. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study, N Engl J Med, 1999; 341:709-17.
- (en) Pitt B, Remme W, Zannad F et als. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction, N Engl J Med, 2003;348:1309–1321.
- (en) Lee S, Spencer A, Beta-blockers to reduce mortality in patients with systolic dysfunction: a meta-analysis, J Fam Pract, 2001; 50:499-504.
- (en) The Capricorn Investigators. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomised trial, Lancet, 2001;357:1385–1390.
- (en) Poole-Wilson PA, Swedberg K, Cleland JG et als. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol or Metoprolol European Trial (COMET): randomised controlled trial, Lancet, 2003;362:7–13
- (en) The Beta-Blocker Evaluation of Survival Trial Investigators. A trial of the beta-blocker bucindolol in patients with advanced chronic heart failure, N Engl J Med, 2001;344:1659–1667.
- (en) The Digitalis Investigation Group, The effect of digoxin on mortality and morbidity in patients with heart failure, N Engl J Med, 1997;336:525-33
- (en) Cohn JN, Ziesche S, Smith R et als. Effect of the calcium antagonist felodipine as supplementary vasodilator therapy in patients with chronic heart failure treated with enalapril: V-HeFT III, Circulation, 1997;96:856–863.
- (en) Thackray S, Witte K, Clark AL et als. Clinical trials update: OPTIME-CHF, PRAISE-2, ALL-HAT, Eur J Heart Fail, 2000;2:209–212.
- (en) Swedberg K, Komajda M, Böhm M et Als, on behalf of the SHIFT Investigators, Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study, Lancet, 2010;376:875-885
- (en) Fox K, Ford I, Steg PG, Tendera M, Ferrari Ron behalf of the beautiful Investigators, Ivabradine for patients with stable coronary artery disease and left-ventricular systolic dysfunction (BEAUTIFUL): a randomised, double-blind, placebo-controlled trial, Lancet, 2008;372:807-816
- (en) Linda Long, Ify R Mordi, Charlene Bridges et Viral A Sagar, « Exercise-based cardiac rehabilitation for adults with heart failure », Cochrane Database of Systematic Reviews, (ISSN 1465-1858, PMID 30695817, PMCID PMC6492482, DOI 10.1002/14651858.cd003331.pub5, lire en ligne, consulté le )
- (en) Sheryl L. Chow, Biykem Bozkurt, William L. Baker et Barry E. Bleske, « Complementary and Alternative Medicines in the Management of Heart Failure: A Scientific Statement From the American Heart Association », Circulation, , CIR.0000000000001110 (ISSN 0009-7322 et 1524-4539, DOI 10.1161/CIR.0000000000001110, lire en ligne, consulté le )
- (en) Cleland JG, Daubert JC, Erdmann E et als. The effect of cardiac resynchronization on morbidity and mortality in heart failure, N Engl J Med, 2005;352:1539–1549
- (en) St John Sutton MG, Plappert T, Abraham WT et als. Effect of cardiac resynchronization therapy on left ventricular size and function in chronic heart failure, Circulation, 2003;107:1985–1990
- (en) Linde C, Abraham WT, Gold MR et Als. Randomized trial of cardiac resynchronization in mildly symptomatic heart failure patients and in asymptomatic patients with left ventricular dysfunction and previous heart failure symptoms, J Am Coll Cardiol, 2008;52:1834-1843.
- (en) Muhammad Shahzeb Khan, Fiza Khan, Gregg C. Fonarow et Jayakumar Sreenivasan, « Dietary interventions and nutritional supplements for heart failure: a systematic appraisal and evidence map », European Journal of Heart Failure, vol. 23, no 9, , p. 1468–1476 (ISSN 1388-9842 et 1879-0844, DOI 10.1002/ejhf.2278, lire en ligne, consulté le )
- « Insuffisance cardiaque : les thérapies complémentaires qui ont fait leurs preuves », sur www.larevuedupraticien.fr (consulté le )
- Les guides ALD de la Haute Autorité de Santé : Insuffisance cardiaque à fonction systolique préservée symptomatique chronique. guide ALD no 5 ;
- (en) Hunt SA, Baker DW, Chin MH et als. ACC/AHA guidelines for the evaluation and management of chronic heart failure in the adult: executive summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to revise the 1995 Guidelines for the Evaluation and Management of Heart Failure), J Am Coll Cardiol, 2001; 38:2101-13.
- (en) Tsutsui H, Tsuchihashi M, Takeshita A, Mortality and readmission of hospitalized patients with congestive heart failure and preserved versus depressed systolic function, Am J Cardiol, 2001; 88:530-3.
- (en) Setaro JF, Zaret BL, Schulman DS et als. Usefulness of verapamil for congestive heart failure associated with abnormal left ventricular diastolic filling and normal left ventricular systolic performance, Am J Cardiol, 1990;66:981–986
- (en) Bonow RO, Dilsizian V, Rosing DR et als. Verapamil-induced improvement in left ventricular diastolic filling and increased exercise tolerance in patients with hypertrophic cardiomyopathy: short- and long-term effects, Circulation, 1985;72:853–864.
- (en) Yusuf S, Pfeffer MA, Swedberg K et als. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial, Lancet, 2003;362:777–781.
- (en) Holland DJ, Kumbhani DJ, Ahmed SH, Marwick TH, Effects of treatment on exercise tolerance, cardiac function, and mortality in heart failure with preserved ejection fraction: A meta-analysis, J Am Coll Cardiol, 2011;57:1676-1686
- (en) (en) Zwi-Dantsis L, Huber I, Habib M, Winterstern A, Gepstein A, Arbel G, Gepstein L, « Derivation and cardiomyocyte differentiation of induced pluripotent stem cells from heart failure patients », Eur Heart J, vol. 34, no 21, , p. 1575-86. (PMID 22621821, DOI 10.1093/eurheartj/ehs096)
- Un espoir pour l’insuffisance cardiaque, www.siliconwadi.fr, 24 mai 2012
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Chez le nouveau-né
- Dans d'autres espèces
Liens externes
[modifier | modifier le code]
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- L'insuffisance cardiaque en questions avec les remerciements de la Fédération française de cardiologie pour sa participation à la version française, publié sur le site (en) Heart Failure Matters Patient Website (consulté le ).


