Disulfure
En chimie, disulfure désigne généralement le groupe fonctionnel constitué de deux atomes de soufre liés par une liaison covalente simple.
Pont disulfure
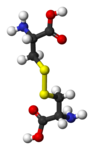
[modifier | modifier le code]On appelle pont disulfure tout groupe disulfure dont les atomes de soufre sont chacun liés par covalence à un atome de carbone d'un composé organique. Cela peut s'écrire de façon générique R1–S–S–R2, R1 et R2 étant des résidus organiques. C'est par exemple le cas du disulfure de diphényle C6H5–S–S–C6H5, de la cystine HOOC–HCNH2–CH2–S–S–CH2–HCNH2–COOH — dimère de cystéines liées par leur atome de soufre — ou encore de l'acide lipoïque HOOC–CH2–CH2–CH2–CH2–C3H5S2, dans lequel le disulfure ferme un hétérocycle.
Anion disulfure
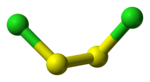
[modifier | modifier le code]L'anion disulfure a pour formule S22−, également écrit −S–S−. Contrairement à l'anion sulfure S2−, de nombre d'oxydation –2 avec la configuration électronique de l'argon (un gaz noble), l'anion disulfure S22− est constitué de deux anions de soufre S− dont le nombre d'oxydation est –1 et la configuration électronique est celle du chlore, un halogène : ces anions S− tendent ainsi à se lier avec d'autres anions S− pour former l'anion disulfure S22−. On trouve ce dernier par exemple dans le disulfure de fer FeS2
Par extension
[modifier | modifier le code]On parle également de disulfures pour désigner des composés qui contiennent deux anions sulfure S2−. Contrairement aux cas précédents, ces espèces chimiques ne contiennent pas de liaison covalente simple S–S. C'est typiquement le cas du disulfure de carbone CS2, dont la formule développée s'écrit S=C=S ; le disulfure de molybdène MoS2 ne possède pas non plus de liaison S–S.