Oxocarbono
Un oxocarbono u óxido de carbono es un compuesto inorgánico que consiste únicamente de carbono y oxígeno.[1][2]
Los más simples y más comunes de los oxocarbonos son el monóxido de carbono (CO) y el dióxido de carbono (CO2). Se conocen muchos otros óxidos estables o metaestables del carbono, pero son raramente encontrados, tales como el dióxido de tricarbono (C3O2 o O=C=C=C=O) y el anhídrido melítico (C12O9).
 |
|||||||
| CO Monóxido de carbono |
CO2 Dióxido de carbono |
C3O2 Dióxido de tricarbono |
C12O9 Anhídrido melítico |
Mientras que los libros de texto ocasionalmente listan solo los primeros tres, y raramente el cuarto, un gran número de otros óxidos son conocidos hoy, la mayoría de ellos sintetizados desde los años 1960s. Algunos de estos nuevos óxidos son estables a temperatura ambiente; otros son metaestables únicamente a muy bajas temperaturas, pero se descomponen a oxocarbonos más simples cuando son calentados. Muchos son inherentemente inestables y pueden ser observados únicamente de manera momentánea como intermediarios en reacciones químicas o son tan reactivos que pueden existir solo en fase gaseosa o bajo condiciones de aislamiento de matriz.
El inventario de oxocarbonos parece estar en crecimiento sostenido. La existencia del óxido de grafito y otros óxidos de carbono poliméricos estables con estructuras moleculares ilimitadas[3][4] sugiere que pueden ser descubiertos muchos más.
Visión general
[editar]El dióxido de carbono (CO2) se encuentra ampliamente en la naturaleza, y fue producido incidentalmente por humanos desde tiempos prehistóricos, mediante la combustión de sustancias que contienen carbono y fermentación de alimentos tales como la cerveza y el pan. Fue gradualmente reconocido como una sustancia química, llamado anteriormente spiritus sylvestre ("espíritu del bosque") o "aire fijo", por varios químicos en los siglos XVII y XVIII.
El monóxido de carbono puede encontrarse también como un producto de la combustión, y fue utilizado (aunque no reconocido) desde la antigüedad para el fundido (smelting) del hierro a partir de sus menas. Al igual que el dióxido, fue descrito y estudiado en Occidente por varios alquimistas y químicos desde la Edad Media. Su verdadera composición fue descubierta por William Cruikshank en 1800.
El dióxido de tricarbono o subóxido de carbono fue descubierto por Brodie en 1873, haciendo pasar una corriente eléctrica a través del dióxido de carbono.[5]
El cuarto óxido "clásico", el anhídrido mel (C12O9), fue obtenido aparentemente por Liebig y Wöhler en 1830 en su estudio de la melita, pero fue caracterizado solo hasta 1913, por Meyer y Steiner.[6][7][8]
Brodie también descubrió en 1859 un quinto compuesto llamado óxido de grafito, que consiste de carbono y oxígeno en relaciones que varían entre 2:1 y 3:1; pero la naturaleza y estructura molecular de la sustancia permaneció desconocida muchos años hasta que fue renombrado como óxido de grafeno y se volvió un tema de investigación en nanotecnología.[3]
Ejemplos notables de óxidos inestables o metaestables que fueron detectados solo en situaciones extremas son el radical monóxido de dicarbono (:C=C=O), el trióxido de carbono (CO3),[9] tetróxido de carbono (CO4),[10][11] pentóxido de carbono (CO5),[12] hexóxido de carbono (CO6)[13] y 1,2-dioxetanodiona (C2O4).[14][15] Algunos de estos óxidos de carbono reactivos fueron detectados dentro de nubes moleculares en el medio interestelar mediante espectroscopia rotacional.[16]
Muchos oxocarbonos hipotéticos han sido estudiados por métodos teóricos pero no han sido detectados aún. Ejemplos incluyen al anhídrido oxálico (C2O3 o O=(C2O)=O), la etenodiona (C2O2 o O=C=C=O)[17] y otros polímeros lineales o cíclicos del monóxido de carbono (-CO-)n (policetonas),[18] y polímeros lineales o cíclicos del dióxido de carbono (-CO2-)n, tales como el dímero 1,3-dioxetanodiona (C2O4)[19] y el trímero 1,3,5-trioxanotriona (C3O6).[19][20]
 |
 |
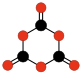 |
|||||||
| C2O3 Anhídrido oxálico |
C2O4 1,2-Dioxetano- diona |
C2O4 1,3-Dioxetano- diona |
C3O6 1,3,5-Trioxano- triona |
C2O2 Etenodiona |
Estructura general
[editar]Normalmente el carbono es tetravalente mientras que el oxígeno es divalente, y en la mayoría de oxocarbonos (como en la mayoría de otros compuestos de carbono) cada átomo de carbono puede estar enlazado a otros cuatro átomos, mientras que el oxígeno puede ser enlazado a dos. Además, mientras que el carbono puede conectarse con otros carbonos para formar cadenas o redes arbitrariamente largas, las cadenas de tres o más oxígenos son raramente observadas. De esta forma, los oxocarbonos eléctricamente neutros conocidos consisten generalmente de uno o más esqueletos de carbono (incluyendo estructuras cíclicas y aromáticas) conectadas y terminadas por grupos óxido (-O-, =O) o peróxido (-O-O-).
Se encuentran átomos de carbono con enlaces sin llenar en algunos óxidos, tales como el diradical C2O o :C=C=O, pero estos compuestos son generalmente muy reactivos para ser aislados en grandes cantidades.[21] La pérdida o ganancia de electrones puede resultar en oxígeno negativo monovalente (-O-), oxígeno positivo trivalente (≡O+), o carbono negativo trivalente (≡C-). Los últimos dos se encuentran en el monóxido de carbono, -C≡O+.[22] El oxígeno negativo ocurre en la mayoría de los aniones oxocarbono.
Dióxidos de carbono lineales
[editar]Una familia de óxidos de carbono tiene la fórmula general CnO2, o O=(C=)nO, una cadena lineal de átomos de carbono limitada por átomos de oxígeno en ambos extremos. Los primeros miembros son:
- CO2 o O=C=O, el conocido dióxido de carbono.
- C2O2 o O=C=C=O, la extremadamente inestable etenodiona.[17]
- C3O2 o O=C=C=C=O, el metaestable subóxido de carbono o dióxido de tricarbono.
- C4O2 o O=C=C=C=C=O, el dióxido de tetracarbono o 1,2,3-butatrieno-1,4-diona[23]
- C5O2 o O=C=C=C=C=C=O, el dióxido de pentacarbono,[24] estable en disolución a temperatura ambiente y puro hasta −90 °C.[25]
Algunos miembros mayores de esta familia han sido detectados en cantidades de traza en fase gaseosa de baja presión y/o experimentos de matriz criogénica, específicamente para n = 7[25]: p.97 y n = 17, 19, y 21.[26]: p.95
Monóxidos de carbono lineales
[editar]Otra familia de oxocarbonos son los monóxidos de carbono lineales CnO. El primer miembro, el ordinario monóxido de carbono CO, parece ser el único que es estable en estado puro a temperatura ambiente. La fotólisis de los dióxidos de carbono lineales en una matriz criogénica lleva a una pérdida de CO, resultando en cantidades detectables de monóxidos pares tales como C2O, C4O,[21] y C6O.[25] Los miembros superiores a n=9 han sido obtenidos también mediante una descarga eléctrica en C3O2 gaseoso diluido en argón.[27] Los primeros tres miembros han sido detectados en el espacio interestelar.[27]
Cuando n es par, se cree que las moléculas están en el estado triplete (tipo cumuleno), con los átomos conectados por dobles enlaces y un orbital semilleno en el primer carbono — como en :C=C=O, :C=C=C=C=O, y, en general, :(C=)n=O. Cuando n es impar, se cree que la estructura triplete entra en resonancia con un estado singlete (tipo acetileno) polar con una carga negativa sobre el carbono final y una positiva en el oxígeno final, como en -C≡C-C≡O+, -C≡C-C≡C-C≡O+ y, en general, -(C≡C-)n/2C≡O+.[27] El mismo monóxido de carbono sigue este patrón: su forma predominante se cree que es -C≡O+.[22]
Policetonas cíclicas tipo radialeno
[editar]Otra familia de oxocarbonos de interés son los oxocarbonos cíclicos tipo radialeno CnOn o (CO)n.[28] Pueden ser considerados como polímeros cíclicos del monóxido de carbono, o n-múltiples cetonas de cicloalcanos de n-átomos de carbono. El mismo monóxido de carbono (CO) puede considerarse como el primer miembro de la serie. Estudios teóricos indican que la etenodiona (C2O2 o O=C=C=O) y la ciclopropanotriona C3O3 no existen.[17][18] Los siguientes tres miembros — C4O4, C5O5, y C6O6 — son teóricamente posibles, pero se espera que sean bastante inestables,[18] y hasta ahora han sido sintetizados solo en cantidades de traza.[29][30]
 |
 |
 |
 |
||||||
| (CO)2 Etenodiona |
(CO)3 Ciclopropano- triona |
(CO)4 Ciclobutano- tetrona |
(CO)5 Ciclopentano- pentona |
(CO)6 Ciclohexano hexona |
Por otra parte, los aniones de estos oxocarbonos son bastante estables, y algunos de ellos han sido conocidos desde el siglo XIX.[28] Estos son:
- C2O22-, etinodiolato (Weiss y Büchner, 1963),[31]
- C3O32-, deltato (Eggerding y West, 1976),[32][33]
- C4O42-, escuarato (Cohen y otros, 1959),[34]
- C5O52-, croconato (Gmelin, 1825),[35] y
- C6O62-, rodizonato (Heller, 1837).[36][37]
El óxido cíclico C6O6 forma también los aniones estables de tetrahidroxi-1,4-benzoquinona (C6O64-) y bencenohexol (C6O66-),[38] La aromaticidad de estos aniones ha sido estudiada utilizando métodos teóricos.[39][40]
Nuevos óxidos
[editar]Muchos nuevos óxidos estables o metaestabes han sido sintetizados desde los años 1960s, tales como:
- C10O8, dianhídrido benzoquinonatetracarboxílico (Hammond, 1963).[41]
- C6O6, dianhídrido etilenotetracarboxílico, un isómero estable de la ciclohexanohexona (Sauer y otros, 1967).[42]
- C12O12 o C6(C2O4)3, trisoxalato de hexahidroxibenceno (Verter y Dominic, 1967); estable como un solvato de tetrahidrofurano.[43]
- C10O10 o C6O2(C2O4)2, bisoxalato de tetrahidroxi-1,4-benzoquinona (Verter y otros, 1968); estable como un solvato de tetrahidrofurano.[44]
- C8O8 o C6O2(CO3)2, biscarbonato de tetrahidroxi-1,4-benzoquinona (Nallaiah, 1984); se descompone alrededor de 45–53 °C.[45]
- C9O9 o C6(CO3)3, triscarbonato de hexahidroxibenzeno (Nallaiah, 1984); se descompone alrededor de 45–53 °C.[45]
- C24O6, un trímero cíclico del diradical 3,4-dialquinil-3-ciclobuteno-1,2-diona -C≡C-(C4O2)-C≡C- (Rubin y otros, 1990);[46]
- C32O8, un tetrámero de la 3,4-dialquinil-3-ciclobuteno-1,2-diona (Rubin y otros, 1990);[46]
- C4O6, dioxano tetracetona o anhídrido oxálico dimérico (Strazzolini y otros, 1998); estable en Et2O a -30 °C, se descompone a 0 °C.[47]
- C12O6, hexaoxotriciclobutabenceno (Hamura y otros, 2006)[48][49]
Muchos compuestos relacionados con estos óxidos han sido investigados teóricamente, y se espera que algunos sean estables, tales como otros ésteres carbonato y oxalato de la tetrahidroxi-1,2-benzoquinona y de los ácidos rodizónico, crocónico, escuárico, y déltico.[18]
Óxidos de carbono poliméricos
[editar]El subóxido de carbono se polimeriza espontáneamente a temperatura ambiente en un polímero de carbono-oxígeno, con una relación atómica entre ellos de 3:2 respectivamente. Se cree que el polímero es una cadena lineal de anillos de lactona de seis miembros fusionados, con un continuo esqueleto de carbono de enlaces sencillos y dobles alternados. Las medidas físicas indican que el número medio de unidades por molécula es alrededor de 5–6, dependiendo de la temperatura de formación.[4][50]
 |
 |
||||||||
| Unidades de terminación y repetición de C3O2 polimérico.[4] | |||||||||
 |
 |
 |
 |
||||||
| Oligómeros de C3O2 con 3 a 6 unidades.[4] | |||||||||
El monóxido de carbono comprimido a 5 GPa en una celda de yunque de diamante da un polímero algo similar a rojizo con un contenido ligeramente más alto de oxígeno, el cual es metaestable en condiciones ambientales. Se cree que el CO se dismuta en la celda para dar una mezcla de CO2 y C3O2; este último forma un polímero similar al descrito anteriormente pero con una estructura más irregular, que atrapa algo del CO2 en su matriz.[51][52]
Otro polímero de carbono-oxígeno, con una relación de 5:1 respectivamente o mayor, es el clásico óxido de grafito[3] y su versión de una sola hoja, el óxido de grafeno.
Referencias
[editar]- ↑ Unión Internacional de Química Pura y Aplicada (1995). «Oxocarbons». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ R. West, editor (1980), Oxocarbons. Academic Press, Nueva York.
- ↑ a b c William S. Hummers Jr., y Richard E. Offeman (1958), "Preparation of Graphitic Oxide". J. Am. Chem. Soc., 1958, 80 (6), 1339-1339 doi 10.1021/ja01539a017
- ↑ a b c d A. W. Snow, H. Haubenstock, N.-L. Yang (1978): "Poly(carbon suboxide). Characterization, Polymerization, and Radical Structure". Macromolecules, 11 (1), pp 77–86. doi 10.1021/ma60061a015
- ↑ Brodie B. C. (1873). «Note on the Synthesis of Marsh-Gas and Formic Acid, and on the Electric Decomposition of Carbonic Oxide». Proceedings of the Royal Society (Londres) 21 (139–147): 245-247. JSTOR 113037. doi:10.1098/rspl.1872.0052.
- ↑ (en alemán) J. Liebig, F. Wöhler (1830), Ueber die Zusammensetzung der Honigsteinsäure Poggendorfs Annalen der Physik und Chemie, vol. 94, núm. 2, pp.161–164. versión en línea Consultado el 08-07-2009.
- ↑ Meyer H, Steiner K (1913.). «Über ein neues Kohlenoxyd C12O9 (A new carbon oxide C12O9)». Berichte der Deutschen Chemischen Gesellschaft 46: 813-815. doi:10.1002/cber.191304601105.
- ↑ Bugge (1914), Chemie: En neues Kohenoxyd. Revisión del descubrimiento de Meyer y Steiner del C12O9. Naturwissenschaftliche Wochenschrift, vol. 13/29, núm. 12, 22 de marzo de 1914, p. 188. versión en línea Consultado el 09-07-2009.
- ↑ DeMore W. B., Jacobsen C. W. (1969). «Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide». Journal of Physical Chemistry 73 (9): 2935-2938. doi:10.1021/j100843a026.
- ↑ Laurence Y. Yeung, Mitchio Okumura, Jeffrey T. Paci, George C. Schatz, Jianming Zhang y Timothy K. Minton (2009), Hyperthermal O-Atom Exchange Reaction O2 + CO2 through a CO4 Intermediate. J. of the American Chemical Society, vol. 131, núm. 39, pp. 13940–13942. doi 10.1021/ja903944k
- ↑ Corey S. Jamieson, Alexander M. Mebel, Ralf I. Kaiser (2007). «Novel detection of the C2v isomer of carbon tetraoxide (CO4)». Chemical Physics Letters 440 (1–3): 105-109. Bibcode:2007CPL...440..105J. doi:10.1016/j.cplett.2007.04.043.
- ↑ Jamieson, Corey S.; Mebel, Alexander M., Kaiser, Ralf I. (26 de julio de 2007). «First detection of the C2 symmetric isomer of carbon pentaoxide (CO5) at 10K». Chemical Physics Letters 443 (1-3): 49-54. doi:10.1016/j.cplett.2007.06.009.
- ↑ Corey S. Jamieson, Alexander M. Mebel and Ralf I. Kaiser (4 de enero de 2008). «First detection of the Cs symmetric isomer of carbon hexaoxide (CO6) at 10 K». Chemical Physics Letters 450 (4-6): 312-317. doi:10.1016/j.cplett.2007.11.052.
- ↑ Herman F. Cordes, Herbert P. Richter, Carl A. Heller (1969), Mass spectrometric evidence for the existence of 1,2-dioxetanedione (carbon dioxide dimer). Chemiluminescent intermediate. J. Am. Chem. Soc., 1969, 91 (25), p 7209. doi 10.1021/ja01053a065
- ↑ Richard Bos, Neil W. Barnett, Gail A. Dyson, Kieran F. Lim, Richard A. Russell y Simon P. Watson (2003), Studies on the mechanism of the peroxyoxalate chemiluminescence reaction: Part 1. Confirmation of 1,2-dioxetanedione as an intermediate using 13C nuclear magnetic resonance spectroscopy. Analytica Chimica Acta, vol. 502, núm. 2, 30 de enero de 2004, pp. 141-147. doi 10.1016/j.aca.2003.10.014
- ↑ H. M. Pickett E. A. Cohen B. J. Drouin J. C. Pearson (2003), Submillimeter, Millimeter, and Microwave Spectral Line Catalog. NASA/JPL, versión en línea Consultado el 11-07-2009.
- ↑ a b c Detlef Schröder; Christoph Heinemann, Helmut Schwarz, Jeremy N. Harvey, Suresh Dua, Stephen J. Blanksby, John H. Bowie (1998). «Ethylenedione: An Intrinsically Short-Lived Molecule». Chemistry - A European Journal 4 (12): 2550-2557. doi:10.1002/(SICI)1521-3765(19981204)4:12<2550::AID-CHEM2550>3.0.CO;2-E.
- ↑ a b c d Haijun Jiao y Hai-Shun Wu (2003), Are Neutral Oxocarbons Stable? J. Org. Chem., vol. 68, 1475-1479. doi 10.1021/jo026243m
- ↑ a b Errol Lewars (1996), Polymers and oligomers of carbon dioxide: ab initio and semiempirical calculations. Journal of Molecular Structure: THEOCHEM, vol. 363, núm. 1, pp. 1–15
- ↑ Shirel Matthew L., Pulay Peter (1999). «Stability of Novel Oxo- and Chloro-Substituted Trioxanes». J. Am. Chem. Soc 121 (37): 8544-8548. doi:10.1021/ja984451j.
- ↑ a b Günter Maier y Hans Peter Reisenauer (2001), Carbenes in Matrices: Specrospcopy, Structure, and Photochemical Behavior. En Udo H. Brinker (ed.), Advances in carbene chemistry, pág. 135. Elsevier, 332 páginas. ISBN 0-444-50892-9, ISBN 978-0-444-50892-8
- ↑ a b W. Kutzelnigg (2002). Einführung in die Theoretische Chemie. Wiley-VCH. ISBN 3-527-30609-9.
- ↑ Günther Maier, Hans Peter Reisenauer, Heinz Balli, Willy Brandt, Rudolf Janoschek (1990): "C4O2 (1,2,3-Butatriene-1,4-dione), the First Dioxide of Carbon with an Even Number of C Atoms". Angewandte Chemie (edición internacional en inglés), vol. 29, núm. 8, pp. 905–908.
- ↑ Günther Maier, Hans Peter Reisenauer, Ulrich Schäfer, and Heinz Balli (1988). «C5O2 (1,2,3,4-Pentatetraene-1,5-dione), a New Oxide of Carbon». Angewandte Chemie International Edition in English 27 (4): 566-568. doi:10.1002/anie.198805661.
- ↑ a b c Frank W. Eastwood (1997), Gas Phase Pyrolytic Methods for the Preparation of Carbon-Hydrogen and Carbon-Hydrogen-Oxygen Compounds.. En Yannick Vallée Gas Phase Reactions in Organic Synthesis. CRC Press; ISBN 90-5699-081-0, ISBN 978-90-5699-081-7
- ↑ (en alemán) Roman Reusch (2005), Absorptionsspektroskopie von langen Kohlenstoff-Kettenmolekülen und deren Oxide in kryogenen Matrizen. Tesis, Ruprecht-Karls-Universität Heidelberg
- ↑ a b c Ogata Teruhiko, Tatamitani Yoshio (2008). «The Simplest Linear-Carbon-Chain Growth by Atomic-Carbon Addition and Ring Opening Reactions». J. Phys. Chem. A 112 (43): 10713-10715. PMID 18834097. doi:10.1021/jp806725s.
- ↑ a b Gunther Seitz, Peter Imming (1992). «Oxocarbons and pseudooxocarbons». Chem. Rev. 92 (6): 1227-1260. doi:10.1021/cr00014a004.
- ↑ Detlef Schröder,; Helmut Schwarz, Suresh Dua, Stephen J. Blanksby y John H. Bowie (mayo de 1999). «Mass spectrometric studies of the oxocarbons CnOn (n = 3–6)». International Journal of Mass Spectrometry 188 (1–2): 17-25. doi:10.1016/S1387-3806(98)14208-2.
- ↑ Richard B. Wyrwas y Caroline Chick Jarrold (2006), Production of C6O6- from Oligomerization of CO on Molybdenum Anions. J. Am. Chem. Soc. vol. 128 núm. 42, pp. 13688–13689. doi 10.1021/ja0643927
- ↑ Werner Büchner, E. Weiss (1963) Zur Kenntnis der sogenannten «Alkalicarbonyle» I Die Kristallstruktur des Kalium-acetylendiolats, KOC≡COK. Helvetica Chimica Acta, vol. 46 núm. 4, pp. 1121–1127. doi 10.1002/hlca.19630460404
- ↑ David Eggerding y Robert West (1976), Synthesis and Properties of Deltic Acid (Dihydroxycyclopropenone) and the Deltate Ion J. American Chemical Society, volume 98, p, 3641–3644. doi 10.1021/ja00428a043
- ↑ Eggerding David, West Robert (1975). «Synthesis of Dihydroxycyclopropenone (Deltic Acid)». J. American Chemical Society 97 (1): 207-208. doi:10.1021/ja00834a047.
- ↑ Cohen Sidney, Lacher John R., Park Joseph D. (1959). «Diketocyclobutanediol». J. American Chemical Society 81 (13): 3480. doi:10.1021/ja01522a083.
- ↑ Leopold Gmelin (1825), Ueber einige merkwürdige, bei der Darstellung des Kaliums nach der Brunner'schen Methode, erhaltene Substanzen. Poggendorfs Annalen der Physik und Chemie, vol. 4, p. 31. versión en línea Consultado el 08-07-2009.
- ↑ Johann Florian Heller (1837), Die Rhodizonsäure, eine aus den Produkten der Kaliumbereitung gewonnene neue Säure, und ihre chemischen Verhältnisse, Justus Liebigs Annalen der Pharmacie, vol. 24, núm. 1, pp. 1–16. versión en línea Consultado el 08-07-2009.
- ↑ Carl Löwig (1839), Chemie der organischen Verbindungen. F. Schultess, Zürich.
- ↑ Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Grey, Franck Dolhem, Jean-Marie Tarascon, y Philippe Poizot (2009), Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery J. Am. Chem. Soc., 131 (25), pp. 8984–8988 doi 10.1021/ja9024897
- ↑ R. West, J. Niu (1969, Non-benzenoid aromatics. Vol. 1. Editado por J. Snyder. Academic Press Nueva York.
- ↑ Schleyer, P. v. R.; Najafian, K.; Kiran, B.; Jiao, H. (2000). «Are Oxocarbon Dianions Aromatic?». J. Org. Chem. 65 (2): 426-431. PMID 10813951. doi:10.1021/jo991267n.
- ↑ Hammond P. R. (1963). «1,4-Benzoquinone Tetracarboxylic Acid Dianhydride, C10O8: A Strong Acceptor». Science 142 (3591): 502. Bibcode:1963Sci...142..502H. doi:10.1126/science.142.3591.502.
- ↑ Jürgen Sauer, Barbara Schröder, Richard Wiemer (1967), Eine Studie der Diels-Alder-Reaktion, VI. Kinetischer Nachweis des Moleküls C6O6 (Dianhydrid der Äthylentetracarbonsäure). Chemische Berichte vol. 100 núm. 1, pp. 306-314 doi 10.1002/cber.19671000135
- ↑ H. S. Verter, R. Dominic (1967), A new carbon oxide: synthesis of hexahydroxybenzene tris oxalate. Tetrahedron, vol. 23, núm. 10, pp. 3863-3864 doi 10.1016/S0040-4020(01)97894-9
- ↑ (H. S. Verter, H. Porter, y R. Dominic, 1968), A new carbon oxide: synthesis of tetrahydroxybenzoquinone bisoxalate. Chemical Communications (Londres), p. 973b–974. doi 10.1039/C1968000973b
- ↑ a b C. Nallaiah (1984), Synthesis of tetrahydroxy-1,4-benzoquinone biscarbonate and hexahydroxybenzene triscarbonate - new organic carbon oxides Tetrahedron, vol. 40, núm. 23, 1984, pp. 4897-4900 doi 10.1016/S0040-4020(01)91324-9
- ↑ a b Yves Rubin, Carolyn B. Knobler, y Francois Diederich (1990). «Precursors to the cyclo[n]carbons: from 3,4-dialkynyl-3-cyclobutene-1,2-diones and 3,4-dialkynyl-3-cyclobutene-1,2-diols to cyclobutenodehydroannulenes and higher oxides of carbon». J. Am. Chem. Soc. 112 (4): 1607-1617. doi:10.1021/ja00160a047.
- ↑ Paolo Strazzolini, Alberto Gambi, Angelo G. Giumanini and Hrvoj Vancik (1998). «The reaction between ethanedioyl (oxalyl) dihalides and Ag2C2O4: a route to Staudinger’s elusive ethanedioic (oxalic) acid anhydride». J. Chem. Soc., Perkin Trans. 1 (16): 2553-2558. doi:10.1039/a803430c.
- ↑ T. Hamura, Y. Ibusuki, H. Uekusa, T. Matsumoto, J. S. Siegel, K. K. Baldridge, K. Suzuki (2006). Dodecamethoxy- and Hexaoxotricyclobutabenzene: Synthesis and Characterization. J. Am. Chem. Soc. 128, 10032–10033. doi 10.1021/ja064063e
- ↑ Holger Butenschön (2007). «A new oxocarbon C12O6 via highly strained benzyne intermediates». Angew Chem Int Ed Engl 46 (22): 4012-4014. PMID 17508349. doi:10.1002/anie.200700926.
- ↑ B. D. Kybett, G. K. Johnson, C. K. Barker, y J. L. Margrave (1965), "The Heats of Formation and Polymerization of Carbon Suboxide". J. Phys. Chem., 69 (10), 3603–3606. doi 10.1021/j100894a060
- ↑ A. I. Katz, D. Schiferl, y R. L. Mills (1984), New phases and chemical reactions in solid carbon monoxide under pressure. J. Physical Chemistry, vol. 88 núm. 15, 3176–3179. doi 10.1021/j150659a007
- ↑ W. J. Evans, M. J. Lipp, C.-S. Yoo, H. Cynn, J. L. Herberg, R. S. Maxwell, y M. F. Nicol (2006), Pressure-Induced Polymerization of Carbon Monoxide: Disproportionation and Synthesis of an Energetic Lactonic Polymer. Chemistry of Materials, vol. 18, 2520–2531. doi 10.1021/cm0524446
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Oxocarbon» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.











