Fotosíntesis




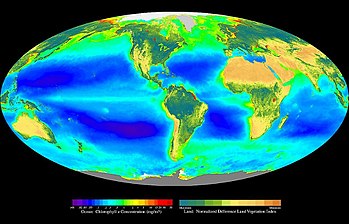
La fotosíntesis o función clorofílica es un proceso químico que consiste en la conversión de materia inorgánica a materia orgánica gracias a la energía que aporta la luz solar. En este proceso, la energía lumínica se transforma en energía química estable, siendo el NADPH (nicotín adenín dinucleótido fosfato) y el ATP (adenosín trifosfato) las primeras moléculas en las que queda almacenada esta energía química. Con posterioridad, el poder reductor del NADPH y el potencial energético del grupo fosfato del ATP se usan para la síntesis de hidratos de carbono a partir de la reducción del dióxido de carbono (CO2). La vida en nuestro planeta se mantiene fundamentalmente gracias a la síntesis que realizan en el medio acuático las algas, las cianobacterias, las bacterias rojas, las bacterias púrpuras, bacterias verdes del azufre,[1] y en el medio terrestre las plantas, que tienen la capacidad de sintetizar materia orgánica (imprescindible para la constitución de los seres vivos) partiendo de la luz y la materia inorgánica. De hecho, cada año los organismos fotosintetizadores fijan en forma de materia orgánica en torno a 100 000 millones de toneladas de carbono.[2][3]
La vida en la Tierra depende fundamentalmente de la energía solar. Esta energía es atrapada mediante la fotosíntesis, responsable de la producción de toda la materia orgánica de la vida (biomasa).
Los orgánulos citoplasmáticos encargados de la realización de la fotosíntesis son los cloroplastos, unas estructuras polimorfas y de color verde (esta coloración es debida a la presencia del pigmento clorofila) propias de las células vegetales. En el interior de estos orgánulos se halla una cámara que alberga un medio interno llamado estroma, que alberga diversos componentes, entre los que cabe destacar enzimas encargadas de la transformación del dióxido de carbono en materia orgánica y unos sáculos aplastados denominados tilacoides, cuya membrana contiene pigmentos fotosintéticos. En términos medios, una célula foliar tiene entre cincuenta y sesenta cloroplastos en su interior.[2]
Los organismos que tienen la capacidad de llevar a cabo la fotosíntesis son llamados, fotoautótrofos (otra nomenclatura posible es la de autótrofos, pero se debe tener en cuenta que bajo esta denominación también se engloban aquellas bacterias que realizan la quimiosíntesis) y fijan el CO2 atmosférico. En la actualidad se diferencian dos tipos de procesos fotosintéticos, que son la fotosíntesis oxigénica y la fotosíntesis anoxigénica. La primera de las modalidades es la propia de las plantas superiores, las algas y las cianobacterias, donde el dador de electrones es el agua y, como consecuencia, se desprende oxígeno. Mientras que la segunda, también conocida con el nombre de fotosíntesis bacteriana, la realizan las bacterias purpúreas y verdes del azufre, en las que el dador de electrones es el sulfuro de hidrógeno (H2S), y consecuentemente, el elemento químico liberado no será oxígeno sino azufre, que puede ser acumulado en el interior de la bacteria, o en su defecto, expulsado al agua.[4]
Se han encontrado animales capaces de favorecerse de la fotosíntesis, tales como Elysia chlorotica, una babosa marina con apariencia de hoja, y Ambystoma maculatum, una salamandra.[5][6][7][8][9]
A comienzos del año 2009, se publicó un artículo en la revista científica Nature Geoscience en el que científicos estadounidenses daban a conocer el hallazgo de pequeños cristales de hematita (en el cratón de Pilbara, en el noroeste de Australia), un mineral de hierro datado en el eón Arcaico, reflejando así la existencia de agua rica en oxígeno y, consecuentemente, de organismos fotosintetizadores capaces de producirlo. Según este estudio y atendiendo a la datación más antigua del cratón, la existencia de fotosíntesis oxigénica y la oxigenación de la atmósfera y océanos se habría producido desde hace más de 3.460 millones de años, de lo que se deduciría la existencia de un número considerable de organismos capaces de llevar a cabo la fotosíntesis para oxigenar la masa de agua mencionada, aunque solamente fuese de manera ocasional, si bien la formación biológica de dichos restos está cuestionada.[10][11][12]
Historia del estudio de la fotosíntesis
[editar]Desde la Antigua Grecia hasta el siglo XIX
[editar]Ya en la Antigua Grecia, el filósofo Aristóteles propuso una hipótesis que sugería que la luz solar estaba directamente relacionada con el desarrollo del color verde de las hojas de las plantas, pero esta idea no trascendió en su época, quedando relegada a un segundo plano. A su vez, la idea de que las hojas de las plantas asimilaban el aire fue propuesta por Empédocles,[13] y descartada por Aristóteles y su discípulo Teofrasto, quien sostenía que todo el «alimento» de las plantas provenía de la tierra.[14] De hecho, esas ideas no volvieron a ser recuperadas hasta el siglo XVII, cuando el considerado padre de la fisiología vegetal, Stephen Hales, hizo mención a las citadas hipótesis, y afirmó que el aire que penetraba por las hojas en las plantas era empleado por ellas como fuente de alimento.[15]

Durante el siglo XVIII comenzaron a surgir trabajos que relacionaban los incipientes conocimientos de la química con los de la biología. En la década de 1770, el clérigo inglés Joseph Priestley (a quien se le atribuye el descubrimiento del O2) estableció la producción de oxígeno por los vegetales, reconociendo que el proceso era, de forma aparente, el inverso de la respiración animal, que consumía tal elemento químico. Fue Priestley quien acuñó la expresión de aire deflogisticado para referirse a aquel que contiene oxígeno y que proviene de los procesos vegetales, así como también fue él quien descubrió la emisión de dióxido de carbono por parte de las plantas durante los periodos de penumbra, aunque en ningún momento logró interpretar estos resultados.[16]
En 1778, el médico neerlandés Jan Ingenhousz dirigió numerosos experimentos dedicados al estudio de la producción de oxígeno por las plantas (muchas veces ayudándose de un eudiómetro), mientras se encontraba de vacaciones en Inglaterra, para publicar al año siguiente todos aquellos hallazgos que había realizado durante el transcurso de su investigación en el libro titulado Experiments upon Vegetables. Algunos de sus mayores logros fueron el descubrimiento de que las plantas, al igual que sucedía con los animales, viciaban el aire tanto en la luz como en la oscuridad; que cuando los vegetales eran iluminados con luz solar, la liberación de aire cargado con oxígeno excedía al que se consumía y la demostración que manifestaba que para que se produjese el desprendimiento fotosintético de oxígeno se requería de luz solar. También concluyó que la fotosíntesis no podía ser llevada a cabo en cualquier parte de la planta, como en las raíces o en las flores, sino que únicamente se realizaba en las partes verdes de esta. Como médico que era, Jan Ingenhousz aplicó sus nuevos conocimientos al campo de la medicina y del bienestar humano, por lo que también recomendó sacar a las plantas de las casas durante la noche para prevenir posibles intoxicaciones.[15][17]
En la misma línea de los autores anteriores, Jean Senebier, ginebrino, realiza nuevos experimentos que establecen la necesidad de la luz para que se produzca la asimilación de dióxido de carbono y el desprendimiento de oxígeno. También establece, que aún en condiciones de iluminación, si no se suministra CO2, no se registra desprendimiento de oxígeno. J. Senebier sin embargo opinaba, en contra de las teorías desarrolladas y confirmadas más adelante, que la fuente de dióxido de carbono para la planta provenía del agua y no del aire.
Otro autor suizo, Nicolas-Théodore de Saussure, demostraría experimentalmente que el aumento de biomasa depende de la fijación de dióxido de carbono (que puede ser tomado del aire por las hojas) y del agua. También realiza estudios sobre la respiración en plantas y concluye que, junto con la emisión de dióxido de carbono, hay una pérdida de agua y una generación de calor. Finalmente, de Saussure describe la necesidad de la nutrición mineral de las plantas.
El químico alemán Justus von Liebig, es uno de los grandes promotores tanto del conocimiento actual sobre química orgánica, como sobre fisiología vegetal, imponiendo el punto de vista de los organismos como entidades compuestas por productos químicos y la importancia de las reacciones químicas en los procesos vitales. Confirma las teorías expuestas previamente por de Saussure, matizando que si bien la fuente de carbono procede del CO2 atmosférico, el resto de los nutrientes proviene del suelo.
La denominación como clorofila de los pigmentos fotosintéticos fue acuñada por Pelletier y Caventou a comienzos del siglo XIX. Dutrochet, describe la entrada de CO2 en la planta a través de los estomas y determina que solo las células que contienen clorofila son productoras de oxígeno. Hugo von Mohl, más tarde, asociaría la presencia de almidón con la de clorofila y describiría la estructura de los estomas. Sachs, a su vez, relacionó la presencia de clorofila con cuerpos subcelulares que se pueden alargar y dividir, así como que la formación de almidón está asociada con la iluminación y que esta sustancia desaparece en oscuridad o cuando los estomas son ocluidos. A Sachs se debe la formulación de la ecuación básica de la fotosíntesis:
- 6 CO2 + 6 H2O → C6H12O6 + 6 O2
Andreas Franz Wilhelm Schimper daría el nombre de cloroplastos a los cuerpos coloreados de Sachs y describiría los aspectos básicos de su estructura, tal como se podía detectar con microscopía óptica. En el último tercio del siglo XIX se sucederían los esfuerzos por establecer las propiedades físico-químicas de las clorofilas y se comienzan a estudiar los aspectos ecofisiológicos de la fotosíntesis.
Siglo XX
[editar]En 1905, Frederick Frost Blackman midió la velocidad a la que se produce la fotosíntesis en diferentes condiciones. En un primer momento se centró en observar como variaba la tasa de fotosíntesis modificando la intensidad lumínica, apreciando que cuando la planta era sometida a una luz tenue cuya intensidad se iba incrementando hasta convertirse en moderada, aumentaba la tasa fotosintética, pero cuando se alcanzaban intensidades mayores no se producía un aumento adicional. Con posterioridad investigó el efecto combinado de la luz y de la temperatura sobre la fotosíntesis, de modo que obtuvo los siguientes resultados: si bien, en condiciones de luz tenue un aumento en la temperatura no tenía repercusión alguna sobre el proceso fotosintético, cuando la intensidad luz y los grados aumentaban la tasa de fotosíntesis sí que experimentaba una variación positiva. Finalmente, cuando la temperatura superaba los 30 °C, la fotosíntesis se ralentizaba hasta que se sobrevenía el cesamiento del proceso.
A consecuencia de los resultados obtenidos, Blackman planteó que en la fotosíntesis coexistían dos factores limitantes, que eran la intensidad lumínica y la temperatura.

En la década de 1920, Cornelius Bernardus van Niel propuso, tras haber estudiado a las bacterias fotosintéticas del azufre, que el oxígeno liberado en la fotosíntesis provenía del agua y no del dióxido de carbono, extrayéndose que el hidrógeno empleado para la síntesis de glucosa procedía de la fotólisis del agua que había sido absorbida por la planta. Pero esta hipótesis no se confirmó hasta el año 1941, tras las investigaciones realizadas por Samuel Ruben y Martin Kamen con agua con oxígeno pesado y una alga verde (Chlorella).[2][15]
En 1937, Robert Hill logró demostrar que los cloroplastos son capaces de producir oxígeno en ausencia de dióxido de carbono, siendo este descubrimiento uno de los primeros indicios de que la fuente de electrones en las reacciones de la fase clara de la fotosíntesis es el agua. Aunque cabe destacar que Hill, en su experimento in vitro empleó un aceptor de electrones artificial. De estos estudios se derivó la conocida con nombre de Reacción de Hill, definida como la fotoreducción de un aceptor artificial de electrones por los hidrógenos del agua, con liberación de oxígeno.[18]
En la década de 1940, el químico estadounidense Melvin Calvin inició sus estudios e investigaciones sobre la fotosíntesis, que le valieron el Premio Nobel de Química de 1961. Gracias a la aplicación del carbono 14 radioactivo detectó la secuencia de reacciones químicas generadas por las plantas al transformar dióxido de carbono gaseoso y agua en oxígeno e hidratos de carbono, lo que en la actualidad se conoce como ciclo de Calvin.
Un personaje clave en el estudio de la fotosíntesis fue el fisiólogo vegetal Daniel Arnon. A pesar de que realizó descubrimientos botánicos de notable importancia (demostró que el vanadio y el molibdeno eran micronutrientes absorbidos por algas y plantas, respectivamente, y que intervenían en el crecimiento de las mismas), es principalmente conocido por sus trabajos orientados de cara a la fotosíntesis. Fue en 1954, cuando sus colegas y él emplearon componentes de las hojas de las espinacas para llevar a cabo la fotosíntesis en ausencia total de células para explicar como éstas asimilan el dióxido de carbono y cómo forman ATP.[15][19]
En el año 1982, los químicos alemanes Johann Deisenhofer, Hartmut Michel y Robert Huber analizaron el centro de reacción fotosintético de la bacteria Rhodopseudomonas viridis, y para determinar la estructura de los cristales del complejo proteico utilizaron la cristalografía de rayos X. Sin embargo, esta técnica resultó excesivamente compleja para estudiar la proteína mencionada y Michel tuvo que idear un método especial que permitía la cristalografía de proteínas de membrana.[20][21][22]
Cuando Michel consiguió las muestras cristalinas perfectas que requería su análisis, su compañero de investigación desenvolvió los métodos matemáticos para interpretar el patrón de rayos X obtenido. Aplicando estas ecuaciones, los químicos lograron identificar la estructura completa del centro de reacción fotosintética, compuesto por cuatro subunidades de proteínas y de 10 000 átomos. Por medio de esta estructura, tuvieron la oportunidad con detalle del proceso de la fotosíntesis, siendo la primera vez que se concretó la estructura tridimensional de dicha proteína.[15][20]
El cloroplasto
[editar]De todas las células eucariotas, únicamente las fotosintéticas presentan cloroplastos, unos orgánulos que usan la energía de la luz para impulsar la formación de ATP y NADPH, compuestos utilizados con posterioridad para el ensamblaje de azúcares y otros compuestos orgánicos. Al igual que las mitocondrias, cuentan con su propio ADN y se han originado a partir de bacterias simbióticas intracelulares (teoría endosimbiótica).
Desarrollo
[editar]
En las células meristemáticas se encuentran proplastos, que son orgánulos que no tienen ni membrana interna, ni clorofila, ni ciertos enzimas requeridos para llevar a cabo toda la fotosíntesis. En angiospermas y gimnospermas el desarrollo de los cloroplastos es desencadenado por la luz, puesto que bajo iluminación se generan los enzimas en el interior del proplasto o se extraen del citosol, aparecen los pigmentos encargados de la absorción lumínica y se producen con gran rapidez las membranas, dando lugar a los grana y las lamelas del estroma.[23]
A pesar de que las semillas suelen germinar en el suelo sin luz, los cloroplastos son una clase de orgánulos que exclusivamente se desarrollan cuando el vástago queda expuesto a la luz. Si la semilla germina en ausencia de luz, los proplastos se diferencian en etioplastos, que albergan una agrupación tubular semicristalina de membrana llamada cuerpo prolamelar. En vez de clorofila, estos etioplastos tienen un pigmento de color verde-amarillento que constituye el precursor de la misma: es la denominada protoclorofila.[23]
Después de estar por un pequeño intervalo de tiempo expuestos a la luz, los etioplastos se diferencian transformándose los cuerpos prolamelares en tilacoides y lamelas del estroma, y la protoclorofila, en clorofila. El mantenimiento de la estructura de los cloroplastos está directamente vinculada a la luz, de modo que si en algún momento estos pasan a estar en penumbra continuada puede desencadenarse que los cloroplastos vuelvan a convertirse en etioplastos.[23]
Además, los cloroplastos pueden convertirse en cromoplastos, como sucede a lo largo del proceso de maduración de los frutos (proceso reversible en determinadas ocasiones). Asimismo, los amiloplastos (contenedores de almidón) pueden transformarse en cloroplastos, hecho que explica el fenómeno por el cual las raíces adquieren tonos verdosos al estar en contacto con la luz solar.[23]
Estructura y abundancia
[editar]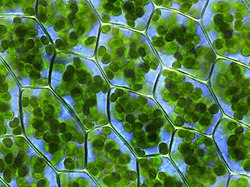
Los cloroplastos se distinguen por ser unas estructuras polimorfas de color verde, siendo la coloración que presentan consecuencia directa de la presencia del pigmento clorofila en su interior. Los cloroplastos están delimitados por una envoltura formada, en la mayoría de las algas y en todas las plantas, por dos membranas (externa e interna) llamadas envueltas, que son ricas en galactolípidos y sulfolípidos, pobres en fosfolípidos, contienen carotenoides y carecen de clorofila y colesterol. En algunas algas, las envueltas están formadas por tres o cuatro membranas, lo que se considera prueba de que se han originado por procesos de endosimbiosis secundaria o terciaria. Las envueltas de los cloroplastos regulan el tráfico de sustancias entre el citosol y el interior de estos orgánulos, son el lugar de biosíntesis de ácidos grasos, galactolípidos y sulfolípidos y son el lugar de reconocimiento y que contiene los elementos necesarios para permitir el transporte al interior de los orgánulos de las proteínas de cloroplastos codificadas en el núcleo celular.[24][25]
En las plantas superiores, la forma que con mayor frecuencia presentan los cloroplastos es la de disco lenticular, aunque también existen algunos de aspecto ovoide o esférico. Con respecto a su número, se puede decir que en torno a cuarenta y cincuenta cloroplastos coexisten, de media, en una célula de una hoja; y existen unos 500.000 cloroplastos por milímetro cuadrado de superficie foliar. No sucede lo mismo entre las algas, pues los cloroplastos de estas no se encuentran tan determinados ni en número ni en forma. Por ejemplo, en el alga Spirogyra únicamente existen dos cloroplastos con forma de cinta en espiral, y en el alga Chlamydomonas, solamente hay uno, de grandes dimensiones.
En el interior y delimitado por la membrana plastidial interna, se ubica una cámara que alberga un medio interno con un elevado número de componentes (ADN plastidial, circular y de doble hélice, plastorribosomas, enzimas e inclusiones de granos de almidón y las inclusiones lipídicas); es lo que se conoce por el nombre de estroma. Inmerso en él se encuentran una gran cantidad de sáculos denominados tilacoides, cuya cavidad interior se llama lumen o espacio tilacoidal. En las membranas de los tilacoides se ubican los complejos proteínicos y complejos pigmento/proteína encargados de captar la energía lumínica, llevar a cabo el transporte de electrones y sintetizar ATP. Los tilacoides pueden encontrarse como vesículas alargadas repartidos por todo el estroma (tilacoides del estroma), o bien, pueden tener forma discoidal y encontrarse apilados originando unos montones, denominados grana (tilacoides de grana).
Función
[editar]
La más importante función realizada en los cloroplastos es la fotosíntesis, proceso en la que la materia inorgánica es transformada en materia orgánica (fase oscura) empleando la energía bioquímica (ATP) obtenida por medio de la energía solar, a través de los pigmentos fotosintéticos y la cadena transportadora de electrones de los tilacoides (fase luminosa). Otras vías metabólicas de vital importancia que se realizan en el estroma, son la biosíntesis de proteínas y la replicación del ADN.
Fase luminosa o fotoquímica
[editar]La energía lumínica que absorbe la clorofila excita a los electrones externos de la molécula, los cuales pueden pasar a otra molécula adyacente (separación de cargas). Es decir, la energía lumínica impacta en los pigmentos fotosintéticos presentes en las membranas tilacoidales. Cuando la luz es absorbida por uno de estos pigmentos de la antena, la energía se traspasa de una molécula a otra del fotosistema mediante resonancia inducida hasta que alcanza una forma especial de “clorofila a” que forma parte del “centro reactivo" del fotosistema. Se produce una corriente electrónica (transporte de electrones) en el interior del cloroplasto a través de la cadena de transporte de electrones. El fotosistema II absorbe luz con longitudes de onda de hasta 680 nm y el fotosistema I absorbe luz con longitudes de onda de hasta 700 nm. La energía (procedente de la luz) de los electrones que se transportan es empleada indirectamente en la síntesis de ATP mediante la fotofosforilación (precisa transporte de protones desde el lumen tilacoidal al estroma), y directamente en la síntesis de NADPH (el NADP recibe los electrones procedentes del agua, al final de la cadena de transporte y se reduce a NADPH). Ambos compuestos son necesarios para la siguiente fase o Ciclo de Calvin, donde se sintetizarán los primeros azúcares que servirán para la producción de sacarosa y almidón. Los electrones que ceden las clorofilas son repuestos mediante la oxidación del H2O, proceso en el cual se genera el O2 que las plantas liberan a la atmósfera.
Existen dos variantes de fotofosforilación: acíclica y cíclica, según el tránsito que sigan los electrones a través de los fotosistemas. Las consecuencias de seguir un tipo u otro estriban principalmente en la producción o no de NADPH y en la liberación o no de O2.
Fotofosforilación acíclica (oxigénica)
[editar]El proceso de la fase luminosa, supuesto para dos electrones, es el siguiente: Los fotones inciden sobre el fotosistema II, excitando y liberando dos electrones, que pasan al primer aceptor de electrones, la feofitina. Los electrones los repone el dador último de electrones, el dador Z, con los electrones procedentes de la fotólisis del agua en el interior del tilacoide (la molécula de agua se divide en 2H+ + 2e- + 1/2O2). Los protones de la fotólisis se acumulan en el interior del tilacoide, y el oxígeno es liberado.
Los electrones pasan a una cadena de transporte de electrones, que invertirá su energía liberada en la síntesis de ATP. ¿Cómo? La teoría quimioosmótica nos lo explica de la siguiente manera: los electrones son cedidos a las plastoquinonas, las cuales captan también dos protones del estroma. Los electrones y los protones pasan al complejo de citocromos bf, que bombea los protones al interior del tilacoide. Se consigue así una gran concentración de protones en el tilacoide (entre estos y los resultantes de la fotólisis del agua), que se compensa regresando al estroma a través de las proteínas ATP-sintasas, que invierten la energía del paso de los protones en sintetizar ATP. La síntesis de ATP en la fase fotoquímica se denomina fotofosforilación.
Los electrones de los citocromos pasan a la plastocianina, que los cede a su vez al fotosistema I. Con la energía de la luz, los electrones son de nuevo liberados y captados por el aceptor A0. De ahí pasan a través de una serie de filoquinonas hasta llegar a la ferredoxina. Esta molécula los cede a la enzima NADP+-reductasa, que capta también dos protones del estroma. Con los dos protones y los dos electrones, reduce un NADP+ en NADPH + H+.
El balance final es: por cada molécula de agua (y por cada cuatro fotones) se forman media molécula de oxígeno, 1,3 moléculas de ATP, y un NADPH + H+.

Fase luminosa cíclica (Fotofosforilación anoxigénica)
[editar]En la fase luminosa o fotoquímica cíclica interviene de forma exclusiva el fotosistema I, generándose un flujo o ciclo de electrones que en cada vuelta da lugar a síntesis de ATP. Al no intervenir el fotosistema II, no hay fotólisis del agua y, por ende, no se produce la reducción del NADP+ ni se desprende oxígeno (anoxigénica). Únicamente se obtiene ATP.
El objetivo que tiene la fase cíclica tratada es el de subsanar el déficit de ATP obtenido en la fase acíclica para poder afrontar la fase oscura posterior.
Cuando se ilumina con luz de longitud de onda superior a 680 nm (lo que se llama rojo lejano) solamente se produce el proceso cíclico. Al incidir los fotones sobre el fotosistema I, la clorofila P700 libera los electrones que llegan a la ferredoxina, la cual los cede a un citocromo bf y este a la plastoquinona (PQ), que capta dos protones y pasa a (PQH2). La plastoquinona reducida cede los dos electrones al citocromo bf, seguidamente a la plastocianina y de vuelta al fotosistema I. Este flujo de electrones produce una diferencia de potencial en el tilacoide que hace que entren protones al interior. Posteriormente saldrán al estroma por la ATP-sintasa fosforilando ADP en ATP. De forma que únicamente se producirá ATP en esta fase.
Sirve para compensar el hecho de que en la fotofosforilación acíclica no se genera suficiente ATP para la fase oscura.
La fase luminosa cíclica puede producirse al mismo tiempo que la acíclica.
Fase oscura o sintética
[editar]
En la fase oscura, que tiene lugar en la matriz o estroma de los cloroplastos, tanto la energía en forma de ATP como el NADPH que se obtuvo en la fase fotoquímica se usa para sintetizar materia orgánica por medio de sustancias inorgánicas. La fuente de carbono empleada es el dióxido de carbono, mientras que como fuente de nitrógeno se utilizan los nitratos y nitritos, y como fuente de azufre, los sulfatos. Esta fase se llama oscura, no porque ocurra de noche, sino porque no requiere de energía solar para poder concretarse. La fase oscura incluye el ciclo de Calvin con las siguientes etapas (presentadas a continuación): 1. Fijación del carbono (a partir de CO2 y H2O), 2. Reducción y, 3. Regeneración.
- Síntesis de compuestos de carbono: descubierta por el bioquímico estadounidense Melvin Calvin, por lo que también se conoce con la denominación de ciclo de Calvin, se produce mediante un proceso de carácter cíclico en el que se pueden distinguir varios pasos o fases.
1. En primer lugar se produce la fijación del dióxido de carbono. En el estroma del cloroplasto, el dióxido de carbono atmosférico se une a la pentosa ribulosa-1,5-bifosfato, gracias a la enzima RuBisCO, y origina un compuesto inestable de seis carbonos, que se descompone en dos moléculas de ácido 3-fosfoglicérico. Se trata de moléculas constituidas por tres átomos de carbono, por lo que las plantas que siguen esta vía metabólica se llaman C3. Si bien, muchas especies vegetales tropicales que crecen en zonas desérticas, modifican el ciclo de tal manera que el primer producto fotosintético no es una molécula de tres átomos de carbono, sino de cuatro (un ácido dicarboxílico), constituyéndose un método alternativo denominado vía de la C4, al igual que este tipo de plantas.
2. Con posterioridad se produce la reducción del dióxido de carbono fijado. Por medio del consumo de ATP y del NADPH obtenidos en la fase luminosa, el ácido 3-fosfoglicérico se reduce a gliceraldehído 3-fosfato, que puede seguir caminos diversos. La primera vía consiste en la regeneración de la ribulosa 1-5-difosfato (la mayor parte del producto se invierte en esto). Otras rutas posibles involucran biosíntesis alternativas: el gliceraldehído 3-fosfato que queda en el estroma del cloroplasto puede destinarse a la síntesis de aminoácidos, ácidos grasos y almidón; el que pasa al citosol origina la glucosa y la fructosa, que al combinarse generan la sacarosa (azúcar de transporte de la mayoría de las plantas, presente en la savia elaborada, conducida por el floema) mediante un proceso parecido a la glucólisis en sentido inverso.
3. La regeneración de la ribulosa-1,5-difosfato se lleva a cabo a partir del gliceraldehído 3-fosfato, por medio de un proceso complejo donde se suceden compuestos de cuatro, cinco y siete carbonos, semejante a ciclo de las pentosas fosfato en sentido inverso (en el ciclo de Calvin, por cada molécula de dióxido de carbono que se incorpora se requieren dos de NADPH y tres de ATP).
- Síntesis de compuestos orgánicos nitrogenados: gracias al ATP y al NADPH obtenidos en la fase luminosa, se puede llevar a cabo la reducción de los iones nitrato que están disueltos en el suelo en tres etapas.
En un primer momento, los iones nitrato se reducen a iones nitrito por la enzima nitrato reductasa, requiriéndose el consumo de un NADPH. Más tarde, los nitritos se reducen a amoniaco gracias, nuevamente, a la enzima nitrato reductasa y volviéndose a gastar un NADPH. Finalmente, el amoniaco que se ha obtenido y que es nocivo para la planta, es captado con rapidez por el ácido α-cetoglutárico originándose el ácido glutámico (reacción catalizada por la enzima glutamato sintetasa), a partir del cual los átomos de nitrógeno pueden pasar en forma de grupo amino a otros cetoácidos y producir nuevos aminoácidos.
Sin embargo, algunas bacterias pertenecientes a los géneros Azotobacter, Clostridium y Rhizobium y determinadas cianobacterias (Anabaena y Nostoc) tienen la capacidad de aprovechar el nitrógeno atmosférico, transformando las moléculas de este elemento químico en amoniaco mediante el proceso llamada fijación del nitrógeno. Es por ello por lo que estos organismos reciben el nombre de fijadores de nitrógeno.

- Síntesis de compuestos orgánicos con azufre: partiendo del NADPH y del ATP de la fase luminosa, el ion sulfato es reducido a ion sulfito, para finalmente volver a reducirse a sulfuro de hidrógeno. Este compuesto químico, cuando se combina con la acetilserina produce el aminoácido cisteína, pasando a formar parte de la materia orgánica celular.
Fotorrespiración
[editar]
Este proceso, que implica el cierre de los estomas de las hojas como medida preventiva ante la posible pérdida de agua, se sobreviene cuando el ambiente es cálido y seco. Es entonces cuando el oxígeno generado en el proceso fotosintético comienza a alcanzar altas concentraciones (por ejemplo debido a que plantas crecen muy juntas y el aire está muy calmado, altas temperaturas o humedades bajas).
Cuando existe abundante dióxido de carbono, la enzima RuBisCO (mediante su actividad como carboxilasa) introduce el compuesto químico en el ciclo de Calvin con gran eficacia. Pero cuando la concentración de dióxido de carbono en la hoja es considerablemente inferior en comparación a la de oxígeno, la misma enzima es la encargada de catalizar la reacción de la RuBisCO con el oxígeno (mediante su actividad como oxigenasa), en lugar del dióxido de carbono. Esta reacción es considerada la primera fase del proceso fotorrespiratorio, en el que los glúcidos se oxidan a dióxido de carbono y agua en presencia de luz. Además, este proceso supone una pérdida energética notable al no generarse ni NADH ni ATP (principal rasgo que lo diferencia de la respiración mitocondrial). Además, la fotorrespiración conlleva a que se pierde ribulosa 1,5-bifosfato (necesaria para el Ciclo de Calvin), solo una parte del carbono vuelve al cloroplasto, se produce CO2 y, en conclusión, la fotorrespiración resulta en un lastre para la planta al deshacer parte de lo conseguido en la fotosíntesis.
Cuando una molécula de RuBisCO reacciona con una de oxígeno, se origina una molécula de ácido fosfoglicerico y otra de ácido fosfoglicólico, que prontamente se hidroliza a ácido glicólico. Este último sale de los cloroplastos para posteriormente introducirse en los peroxisomas (orgánulos que albergan enzimas oxidativos), lugar en el que vuelve a reaccionar con oxígeno para producir ácido glioxílico y peróxido de hidrógeno (la acción de la enzima catalasa catalizará la descomposición de este compuesto químico en oxígeno y agua). Sin embargo el ácido glioxílico se transforma en glicina, aminoácido que se traspasa a la mitocondrias para formarse una molécula de serina a partir de dos de ácido glioxílico (este proceso conlleva la liberación de una molécula de dióxido de carbono).
Ruta de Hatch-Slack o de las plantas C4
[editar]En los vegetales propios de las zonas con clima tropical
, donde la fotorrespiración podría revestir un problema de notable gravedad, se presenta un proceso diferente para captar el dióxido de carbono. En estas plantas se distinguen dos variedades de cloroplastos: existen unos que se hallan en las células internas, contiguos a los vasos conductores de las hojas, y otros que están en las células del parénquima clorofílico periférico, lo que se llama mesófilo. Es en este último tipo de cloroplasto en el que se produce la fijación del dióxido de carbono. La molécula aceptora de este compuesto químico es el ácido fosfoenolpirúvico (PEP), y la enzima que actúa es la fosfoenolpiruvato carboxilasa, que no se ve afectada por una alta concentración de oxígeno.
Partiendo del ácido fosfoenolpirúvico y del dióxido de carbono se genera el ácido oxalacético, constituido por cuatro carbonos (es de aquí de donde proviene el nombre de plantas C4). El susodicho ácido se transforma en ácido málico, y este pasa a los cloroplastos propios de las células internas a través de los plasmodesmos. En estos se libera el dióxido de carbono, que será apto para proseguir el ciclo de Calvin. A consecuencia de ello, en estas plantas no se produce ningún tipo de alteración a consecuencia de la respiración.
Las plantas CAM
[editar]La sigla CAM es empleada como abreviación de la equívoca expresión inglesa crassulacean acidic metabolism, que puede ser traducida al español como metabolismo ácido de las crasuláceas. Esta denominación se acuñó dado que en un principio este mecanismo únicamente fue atribuido a las plantas pertenecientes a esta familia, es decir, a las crasuláceas. No obstante, en la actualidad se conocen a varias especies de plantas CAM, que pertenecen a diferentes familias de plantas crasas o suculentas (Crassulaceae, Cactaceae, Euphorbiaceae, y Aizoaceae son algunos ejemplos). Por norma general, las plantas CAM son vegetales originarios de zonas con unas condiciones climáticas desérticas o subdesérticas, que se encuentran sometidas a una intensa iluminación, a altas temperaturas y a un déficit hídrico permanente. Pueden ser enumeradas muchas peculiaridades de estas plantas, como que el tejido fotosintético es homogéneo, siendo apreciable además la inexistencia de vaina diferenciada y de clorénquima en empalizada.[11]

Las plantas CAM están adaptadas a las condiciones de aridez extremas, por lo que resulta lógico que sus estomas se abran durante la noche, para evitar en la medida de lo posible la pérdida de agua por transpiración, fijando dióxido de carbono en oscuridad por una reacción de carboxilación de PEP (ácido fosfoenolpirúvico) catalizada por la enzima PEP-carboxilasa en el citosol. Como resultado, se produce la formación de oxalacetato y malato que es almacenado en la vacuola, sobreviniéndose una acidificación nocturna de la hoja. El malato almacenado en la vacuola es liberado durante el día mientras los estomas que permanecen cerrados, siendo llevado al cloroplasto. Una vez en este orgánulo, el malato es descarboxilado por la enzima málico NADP dependiente y el dióxido de carbono que se desprende es fijado en el ciclo de Calvin. El ácido pirúvico se convierte nuevamente en azúcares, para finalmente convertirse en almidón. La fijación y reducción del carbono en las plantas CAM presenta unos requerimientos energéticos, en términos de ATP, mayores que en las plantas C3 y C4. Su rendimiento fotosintético por unidad de tiempo es menor y su crecimiento es más lento. Como consecuencia de la adaptación de estas plantas a sus hábitats extremos, los mecanismos que regulan el equilibrio entre transpiración y fotosíntesis están encaminados fuertemente hacia la minimización de las pérdidas de agua, asegurando así la supervivencia en el medio desértico, aunque a costa de una menor productividad.[11]
También se tiene constancia de la existencia de plantas que poseen la capacidad de adaptar su metabolismo a las condiciones ambientales, de modo que pueden presentar un ciclo CAM de carácter adaptativo, es decir, aunque se comportan como C3 pueden llevar a cabo el ciclo CAM cuando están sometidas a ciertas circunstancias. Son las denominadas CAM facultativas, siendo ejemplo representativo de ellas la Mesembryanthemum crystallinum, la cual realiza ciclo C3 en condiciones normales de no estrés, pero cambia a ciclo CAM en respuesta a situaciones de estrés.[11]
Cuadro comparativo de plantas C3, C4 y CAM
| CARACTERÍSTICA | PLANTAS C3 | PLANTAS C4 | PLANTAS CAM |
|---|---|---|---|
| Metabolismo | Ninguno | Transferencia de CO2 | Almacenan CO2 |
| Fotorrespiración | Alta | Baja | Moderada |
| Apertura de estomas | Día | Día | Noche |
| Incorporación directa de CO2 | Sí | No | No |
| Temperatura óptima para la fotosíntesis | 15-25 °C | 30-47 °C | > 35 °C |
| Región Climática | templada | Tropical | Árida |
| Ejemplos | Trigo, diente león, eucalipto | Maíz, caña de azúcar, remolacha | Áloe, cactus, piña |
Fotosistemas y pigmentos fotosintéticos
[editar]Los fotosistemas
[editar]Los pigmentos fotosintéticos se hallan alojados en unas proteínas transmembranales que forman unos conjuntos denominados fotosistemas, en los que se distinguen dos unidades diferentes: la antena y el centro de reacción.
En la antena, que también puede aparecer nombrada como LHC (abreviatura del inglés Light Harvesting Complex), predominan los pigmentos fotosintéticos sobre las proteínas. De hecho, existen entre doscientas y cuatrocientas moléculas de pigmentos de antena de varios tipos y tan solo dos proteínas intermembranales. Sin embargo, la antena carece de pigmento diana. Un ejemplo es el complejo de captación de luz LH-2 de Rs. Molishchianum, el cual consta de 8 unidades alfa con 56 residuos cada unidad, y 8 unidades beta con 45 residuos por unidad, los cuales se disponen en 2 anillos concéntricos simétricos. Además, también posee 24 moléculas de bacterioclorofila A, y 8 moléculas de licopeno; tanto la bacterioclorofila A y el licopeno se encuentran entre los anillos concéntricos alfa y beta.[26]
En el centro de reacción, mentado en algunas ocasiones como CC (abreviatura del inglés Core Complex), las proteínas predominan sobre los pigmentos. En el centro de reacción es donde está el pigmento diana, el primer aceptor de electrones y el primer dador de electrones. En término generales, se puede decir que existe una molécula de pigmento diana, unas cuantas de pigmentos no diana, una de primer dador de electrones y una de primer aceptor. Mientras existen entre dos y cuatro proteínas de membrana.
Fotosistema I y Fotosistema II
[editar]- El Fotosistema I (PSI) capta la luz cuya longitud de onda es menor o igual a 700 nm y en las plantas superiores, su antena se caracteriza por encerrar dentro de sí una gran proporción de clorofila α, y una menor de clorofila β. En el centro de reacción, la molécula diana es la clorofila αI que absorbe a 700 nm, siendo llamada por ello clorofila P700. El aceptor primario de electrones se denomina aceptor A0 y el dador primario es la plastocianina. Sobre todo, se hallan presentes en los tilacoides del estroma.
- El Fotosistema II (PSII) capta luz cuya longitud de onda es menor o igual a 680 nm.
Los pigmentos fotosintéticos y la absorción de la luz
[editar]Los pigmentos fotosintéticos son lípidos unidos a proteínas presentes en algunas membranas plasmáticas, y que se caracterizan por presentar alternancia de enlaces sencillos con enlaces dobles. Esto se relaciona con su capacidad de aprovechamiento de la luz para iniciar reacciones químicas, y con poseer color propio. En las plantas estos pigmentos son las clorofilas y los carotenoides, en las cianobacterias y las algas rojas también existe ficocianina y ficoeritrina, y, finalmente, en las bacterias fotosintéticas está la bacterioclorofila.
La clorofila está formada por un anillo porfirínico con un átomo de magnesio en el centro, asociado a un metanol y a un fitol (monoalcohol de compuesto de veinte carbonos). Como consecuencia, se conforma una molécula de carácter anfipático, en donde la porfirina actúa como polo hidrófilo y el fitol como polo lipófilo. Se distinguen dos variedades de clorofila: la clorofila a, que alberga un grupo metilo en el tercer carbono porfirínico y que absorbe luz de longitud de onda cercana a 630 nm, y la clorofila b, que contiene un grupo formilo y que absorbe a 660 nm.
Los carotenoides son isoprenoides y absorben luz de 440 nm, pudiendo ser de dos clases: los carotenos, que son de color rojo, y las xantófilas, derivados oxigenados de los nombrados anteriormente, que son de color amarillento. Las ficocianinas y las ficoeritrinas, de color azul y rojo respectivamente, son lípidos asociados a proteínas originando las ficobiliproteínas.
Como los pigmentos fotosintéticos tienen enlaces covalentes sencillos que se alternan con enlaces covalentes dobles, se favorece la existencia de electrones libres que no pueden atribuirse a un átomo concreto.
Cuando incide un fotón sobre un electrón de un pigmento fotosintético de antena, el electrón capta la energía del fotón y asciende a posiciones más alejadas del núcleo atómico. En el supuesto caso de que el pigmento estuviese aislado, al descender al nivel inicial, la energía captada se liberaría en forma de calor o de radiación de mayor longitud de onda (fluorescencia). Sin embargo, al existir diversos tipos de pigmentos muy próximos, la energía de excitación captada por un determinado pigmento puede ser transferida a otro al que se induce el estado de excitación. Este fenómeno se produce gracias a un estado de resonancia entre la molécula dadora relajada y la aceptora. Para ello se necesita que el espectro de emisión del primero coincida, al menos en parte, con el de absorción del segundo. Los excitones se transfieren siempre hacia los pigmentos que absorben a mayor longitud de onda, continuando el proceso hasta alcanzar el pigmento fotosintético diana.
Solo el 40 % de la energía que llega al cloroplasto es luz visible, que es la única energía útil para realizar la fotosíntesis.
Factores externos que influyen en la fotosíntesis
[editar]Mediante la comprobación experimental, los científicos han llegado a la conclusión de que la temperatura, la concentración de determinados gases en el aire (tales como dióxido de carbono y oxígeno), la intensidad luminosa y la escasez de agua son aquellos factores que intervienen aumentando o disminuyendo el rendimiento fotosintético de un vegetal.
- La temperatura: cada especie se encuentra adaptada a vivir en un intervalo de temperaturas. Dentro de él, la eficacia del proceso oscila de tal manera que aumenta con la temperatura, como consecuencia de un aumento en la movilidad de las moléculas, en la fase oscura, hasta llegar a una temperatura en la que se sobreviene la desnaturalización enzimática, y con ello la disminución del rendimiento fotosintético.[27][28]

- La concentración de dióxido de carbono: si la intensidad luminosa es alta y constante, el rendimiento fotosintético aumenta en relación directa con la concentración de dióxido de carbono en el aire, hasta alcanzar un determinado valor a partir del cual el rendimiento se estabiliza.[27][28]
- La concentración de oxígeno: cuanto mayor es la concentración de oxígeno en el aire, menor es el rendimiento fotosintético, debido a los procesos de fotorrespiración.[27]
- La intensidad luminosa: cada especie se encuentra adaptada a desarrollar su vida dentro de un intervalo de intensidad de luz, por lo que existirán especies de penumbra y especies fotófilas. Dentro de cada intervalo, a mayor intensidad luminosa, mayor rendimiento, hasta sobrepasar ciertos límites, en los que se sobreviene la fotooxidación irreversible de los pigmentos fotosintéticos. Para una igual intensidad luminosa, las plantas C4 (adaptadas a climas secos y cálidos) manifiestan un mayor rendimiento que las plantas C3, y nunca alcanzan la saturación lumínica.[27][28]
- El tiempo de iluminación: existen especies que desenvuelven una mayor producción fotosintética cuanto mayor sea el número de horas de luz, mientras que también hay otras que necesitan alternar horas de iluminación con horas de oscuridad.[28][29]
- La escasez de agua: ante la falta de agua en el terreno y de vapor de agua en el aire disminuye el rendimiento fotosintético. Esto se debe a que la planta reacciona, ante la escasez de agua, cerrando los estomas para evitar su desecación, dificultando de este modo la penetración de dióxido de carbono. Además, el incremento de la concentración de oxígeno interno desencadena la fotorrespiración. Este fenómeno explica que en condiciones de ausencia de agua, las plantas C4 sean más eficaces que las C3.[27][28]
- El color de la luz: la clorofila α y la clorofila β absorben la energía lumínica en la región azul y roja del espectro, los carotenos y xantofilas en la azul, las ficocianinas en la naranja y las ficoeritrinas en la verde. Estos pigmentos traspasan la energía a las moléculas diana. La luz monocromática menos aprovechable en los organismos que no tienen ficoeritrinas y ficocianinas es la luz. En las cianofíceas, que si poseen estos pigmentos anteriormente citados, la luz roja estimula la síntesis de ficocianina, mientras que la verde favorece la síntesis de ficoeritrina. En el caso de que la longitud de onda superase los 680 nm, no actúa el fotosistema II con la consecuente reducción del rendimiento fotosintético al existir únicamente la fase luminosa cíclica.[29]
Fotosíntesis anoxigénica o bacteriana
[editar]Las bacterias únicamente son poseedoras de fotosistemas I, de manera que, al carecer de fotosistemas II, no pueden usar al agua como dador de electrones (no hay fotólisis del agua), y en consecuencia, no producen oxígeno al realizar la fotosíntesis. En función de la molécula que emplean como dador de electrones y el lugar en el que acumulan sus productos, es posible diferenciar tres tipos de bacterias fotosintéticas: las sulfobacterias purpúreas, que se caracterizan por emplear sulfuro de hidrógeno (H2S) como dador de electrones y por acumular el azufre en gránulos de azufre en su interior; las sulfobacterias verdes, que también utilizan al sulfuro de hidrógeno, pero a diferencia de las purpúreas no acumulan azufre en su interior; y finalmente, las bacterias verdes carentes de azufre que usan materia orgánica, tal como ácido láctico, como donadora de electrones.
En las bacterias purpúreas, los fotosistemas I están presentes en la membrana plasmática, mientras que en las bacterias verdes, estos se encuentran en la membrana de ciertos orgánulos especiales. Los pigmentos fotosintéticos están constituidos por las bacterioclorofilas a, b, c, d y e, así como también por los carotenos. Por otra parte, lo más frecuente es que la molécula diana sea la denominada P890.
Al igual que sucede en la fotosíntesis oxigénica, existe tanto una fase dependiente de luz como una independiente de luz, distinguiéndose en la primera un transporte de electrones acíclico y otro cíclico. Mientras en el cíclico únicamente se obtiene ATP, en el acíclico se reduce el NAD+ a NADH, que posteriormente es empleado para la reducción del CO2, NO3-, entre otros. El NADH también puede ser obtenido en ausenca de luz, gracias al ATP procedente del proceso cíclico.
Fotosíntesis artificial de las plantas
[editar]Actualmente, existe un gran número de proyectos químicos destinados a la reproducción artificial de la fotosíntesis, con la intención de poder capturar energía solar a gran escala en un futuro no muy lejano. A pesar de que todavía no se ha conseguido sintetizar una molécula artificial capaz de perdurar polarizada durante el tiempo necesario para reaccionar de forma útil con otras moléculas, las perspectivas son prometedoras y los científicos son optimistas.[30]
Intentos de imitación de las estructuras fotosintéticas
[editar]Desde hace cuatro décadas, en el ambiente científico se ha extendido el interés por la creación de sistemas artificiales que imiten a la fotosíntesis. Con frecuencia, lo que se hace es reemplazar a la clorofila por una amalgama de compuestos químicos, ya sean orgánicos o inorgánicos, que tienen la capacidad de captar la luz. Sin embargo, se desconoce lo que se debe de hacer con los electrones liberados en el proceso fotosintético.[31]

En el año 1981 fue fabricado el primer cloroplasto artificial,[32] constituido por una mezcla de compuestos orgánicos sintéticos relacionados con la clorofila y que, al iluminarse, tenía la capacidad de llevar a cabo la reacción de fotólisis del agua, generando hidrógeno y oxígeno en estado gaseoso. El tamaño físico del cloroplasto artificial era mucho mayor que el de los cloroplastos naturales, y además, su eficacia de conversión de energía lumínica en química era notablemente inferior. Este primer experimento fue todo un hito y supuso el primer paso hacia la construcción de un dispositivo fotosintético obtenido artificialmente que funcionara.[31]
En 1998, el equipo de Thomas Moore, profesor de química del Centro de Bioenergía y Fotosíntesis de la Universidad Estatal de Arizona, decidió incorporar al cloroplasto artificial desarrollado años antes, una vesícula rodeada de una cubierta parecida a las membranas de los cloroplastos naturales. En ella se hallaban las clorofilas tratadas sintéticamente, junto con otros compuestos que se añadieron con la intención de generar una acumulación de iones H+ en la parte interna de la membrana. Pero el hecho más destacable del experimento fue la incorporación de la enzima ATP-sintetasa, principal responsable del aprovechamiento del desequilibrio en la concentración de H+ para producir ATP. Con estas modificaciones, Moore consiguió un comportamiento similar al de los cloroplastos reales, sintetizando ATP a partir de energía solar, pero con un número más reducido de componentes que la cadena fotosintética natural. Tal fue la repercusión del experimento, que en la actualidad se continúan explorando sus aplicaciones prácticas.[31]
En 1999, científicos estadounidenses unieron químicamente cuatro moléculas de clorofila, dando lugar a una cadena por la que podían circular los electrones y en cuyo remate, se encontraba una bola de fullereno C60. Tras incidir la luz en el sistema, los electrones emitidos eran trasportados hasta la bola de buckminsterfullereno que se quedaba cargada eléctricamente y mantenía estable su carga. Pero el principal defecto de este imaginativo proyecto es que los científicos que lo lideraban desconocían la posible aplicación del fullereno cargado que se había obtenido por medio del proceso mencionado.[31]
Célula de Grätzel
[editar]Las células de Grätzel son dispositivos fotovoltaicos de dióxido de titanio nanoestructurado sensitivizado con colorante, cuyos mecanismos para la transferencia electrónica se caracterizan por ser parecidos a los que se producen en la planta durante el proceso fotosintético. De hecho, el colorante, que puede ser de naturaleza sintética o natural, permite el empleo de la clorofila para este tipo de dispositivos.
A pesar de que ya en 1972, el alemán Helmunt Tributsch había creado células solares fotoelectroquímicas sensitivizadas con colorante, con capacidad para producir electricidad, usando electrodos densos convencionales. Los desarrollos con electrodos de óxidos sensitivizados generaron eficiencias próximas al 2,5 % limitadas por la reducida superficie fotoactiva de estos electrodos.
La principal traba de este proyecto es su eficiencia, que se sitúa en torno al 11 % en un laboratorio, pero si se extrapola a un nivel industrial disminuye de forma notoria. Es por ello por lo que investigadores de todo el mundo (algunos ejemplos son el grupo de trabajo encabezado por el Michael Grätzel en Lausana o los científicos de la Universidad Pablo de Olavide) trabajan para incrementar la eficiencia, así como para descubrir configuraciones alternativas y más prácticas.
A pesar de que su introducción en el mercado es todavía muy limitada, ya existen empresas como la australiana Sustainable Technologies International que en el año 2001, y tras un programa de desarrollo que alcanzó el coste de doce millones de dólares, implantó de forma pionera una planta de producción a gran escala de células solares de titanio sensitivizado.
Disoluciones homogéneas
[editar]El 31 de agosto de 2001 se publicó el la revista Science, un artículo en el que se recogía el resultado de un experimento realizado por unos investigadores del Instituto Tecnológico de Massachusetts, consistente en obtener hidrógeno por medio de disoluciones de ácido clorhídrico, usando como catalizador un compuesto orgánico de naturaleza sintética contenedor de átomos de rodio como centro activo.[31]
El hecho de que la regeneración del catalizador de rodio no sea perfecta, obliga a tener que reabastecerlo cada cierto período para mantener la reacción, por lo que en la actualidad se sigue investigando para obtener el catalizador que mejor se adecue.[31]
Casos excepcionales en animales relacionados con la fotosíntesis
[editar]Si bien la fotosíntesis es un mecanismo inherente a plantas, algas, bacterias y otros organismos, hay animales que, mediante ciertas situaciones aprovechan la fotosíntesis producida por algas para obtener oxígeno.
Esta babosa marina practica un fenómeno denominado cleptoplastia, que consiste en digerir el alga Vaucheria litorea parcialmente, de tal forma que sus cloroplastos (organelos encargados en la fotosíntesis) quedan intactos y son almacenados por E. chlorotica en su vía digestiva para aprovecharse de su capacidad fotosintética y así obtener la energía necesaria para subsistir varios meses sin necesidad de recurrir a organismos externos. Producto de la presencia de la clorofila dentro de los cloroplastos almacenados en E. chlorotica, esta adquiere un característico color verde presente en organismos fotosintetizadores.[5][33][6]
El alga Oophila amblystomatis ingresa al huevo de A. maculatum y se implanta en la membrana. El revestimiento de la membrana del huevo previene su deshidratación, pero a su vez inhibe el intercambio de gases como el oxígeno, un factor elemental para el desarrollo del embrión de la salamandra. Esta falta de oxígeno es proporcionada por la fotosíntesis de O. amblystomatis, contribuyendo al desarrollo de A. maculatum, mientras que esta última metaboliza dióxido de carbono, el cual es consumido por el alga, estableciendo así una relación simbiótica entre ambos organismos.[34][7][8][9]
Véase también
[editar]Referencias
[editar]- ↑ Rawn, J. D. (2015). «La fotosíntesis». Bioquímica. Madrid: Interamericana de España y McGraw-Hill. p. 489. ISBN 84-7615-428-3.
- ↑ a b c Universidad Politécnica de Valencia. «La Fotosíntesis». Consultado el 5 de diciembre de 2009.
- ↑ Field, C. B., Behrenfeld, M. J., Randerson, J. T., Falkowski, P. (1998). «Primary production of the biosphere: integrating terrestrial and oceanic components». Science 281: 237-240.
- ↑ Antonio Jimeno, Manuel Ballesteros Vázquez, Luis Ugedo Ucar (2003). Biología (2º de Bachillerato). Santillana. p. 210. ISBN 978-84-294-8385-7.
- ↑ a b Green sea slug can steal plant genes and produce chlorophyll. Digital Journal, 15 de enero de 2010.
- ↑ a b Rumpho ME, Worful JM, Lee J, et al. (November 2008). "Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug Elysia chlorotica". Proc. Natl. Acad. Sci. U.S.A. 105 (46): 17867–17871. doi:10.1073/pnas.0804968105. PMC 2584685. PMID 19004808.
- ↑ a b Burns, John A; Zhang, Huanjia; Hill, Elizabeth; Kim, Eunsoo; Kerney, Ryan (2 May 2017). "Transcriptome analysis illuminates the nature of the intracellular interaction in a vertebrate-algal symbiosis". eLife. 6. doi:10.7554/eLife.22054. PMC 5413350. PMID 28462779.
- ↑ a b Hutchison, Victor H.; Hammen, Carl S. (1958). "Oxygen Utilization in the Symbiosis of Embryos of the Salamander, Ambystoma maculatum and the Alga, Oophila amblystomatis". Biological Bulletin. 115 (3): 483–489. doi:10.2307/1539111. JSTOR 1539111.
- ↑ a b Petherick, Anna (30 July 2010). "A solar salamander". Nature. doi:10.1038/news.2010.384.
- ↑ Agencia EFE. «La vida en la Tierra surgió 800 millones de años antes de lo que se pensaba». Archivado desde el original el 18 de marzo de 2012. Consultado el 27 de noviembre de 2009.
- ↑ a b c d Elena Pérez-Urria Carril (Facultad de Ciencias Biológicas de la Universidad Complutense de Madrid). «Fotosíntesis: Aspectos Básicos». Consultado el 27 de noviembre de 2009.
- ↑ «Un español replantea la forma de detectar la vida primitiva». Archivado desde el original el 3 de febrero de 2012. Consultado el 27 de diciembre de 2007.
- ↑ Lambridis, Helle (1976). Empedocles. A Philosophical Investigation. Studies in the humanities; no. 15 : Philosophy. Alabama: Tuscaloosa University of Alabama Press. ISBN 978-0-8173-6615-5.
- ↑ Wayne, Randy O. (2009). Plant Cell Biology: From Astronomy to Zoology. San Diego, California: Academic Press. p. 208. ISBN 978-0-12-374233-9. Consultado el 18 de noviembre de 2015.
- ↑ a b c d e Universidad Nacional de Colombia. «Fisiología vegetal (descubrimientos importantes para la teoría fotosintética)». Archivado desde el original el 6 de septiembre de 2008. Consultado el 24 de noviembre de 2009.
- ↑ Armstrong, Frank Bradley (1982). Bioquímica. Reverté. p. 320. ISBN 84-291-7008-1.
- ↑ Isely, Duane (2002). One Hundred and One Botanists. pp. 104, 105 y 106. ISBN 1-55753-283-4.
- ↑ Universidad de Las Américas. Instituto de Ciencias Naturales (Laboratorio de Fisiología Vegetal). «Fotosíntesis (1. Reacción de Hill)». Consultado el 29 de noviembre de 2009.
- ↑ Biblioteca Premium Microsoft Encarta 2006, Daniel Arnon
- ↑ a b Biblioteca Premium Microsoft Encarta 2066, Johann Deisenhofer
- ↑ Biblioteca Premium Microsoft Encarta 2006, Hartmut Michel
- ↑ Biblioteca Premium Microsoft Encarta 2006, Robert uber
- ↑ a b c d Zeiger, Eduardo y Lincoln Taiz (2006). Fisiología Vegetal. Publicacions de la Universitat Jaume I. pp. 26, 27. ISBN 978-84-8021-601-2.
- ↑ Block, Maryse A., Roland Douce, Jacques Joyard, Norbert Rolland. «Chloroplast envelope membranes: a dynamic interface between plastids and the cytosol.» Photosynthesis Research (2007) 92:225-244.
- ↑ Larkum, Anthony W. D., Peter J. Lockhart y Christopher J. Howe. «Shopping for plastids.» Trends in Plant Science Vol.12 No.5. 2007.
- ↑ «ENZIMAS y PROTEÍNAS». La vida con ciencia. Consultado el 6 de febrero de 2021.
- ↑ a b c d e Jimeno, Antonio; Manuel Ballesteros Vázquez, Luis Ugedo Ucar (2003). Biología (2º de Bachillerato). Santillana. p. 220. ISBN 978-84-294-8385-7.
- ↑ a b c d e Puigdomènech, Pedro (1986). Enciclopedia de las Ciencias; Las plantas, el mundo de la botánica. Ediciones Orbis S. A. p. 19. ISBN 978-84-294-8385-7.
- ↑ a b Jimeno, Antonio; Manuel Ballesteros Vázquez, Luis Ugedo Ucar (2003). Biología (2º de Bachillerato). Santillana. p. 221. ISBN 978-84-294-8385-7.
- ↑ Biblioteca Premium Microsoft Encarta 2006, Fotosíntesis (apartado Fotosíntesis Artificial)
- ↑ a b c d e f Owen Wangensteen. «Fotosíntesis Artificial (Apartado de Ingeniería)». Archivado desde el original el 18 de diciembre de 2009. Consultado el 31 de diciembre de 2009.
- ↑ Rius de Riepen,Magdalena y Carlos Mauricio Castro-Acuña (1989). La química hacia la conquista del Sol. p. 77. ISBN 968-16-6615-1.
- ↑ Mujer, C.V., Andrews, D.L., Manhart, J.R., Pierce, S.K., & Rumpho, M.E. (1996). Chloroplast genes are expressed during intracellular symbiotic association of Vaucheria litorea plastids with the sea slug Elysia chlorotica. Cell Biology, 93, 12333-12338
- ↑ Rumpho ME, Worful JM, Lee J, et al. (November 2008). "Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug Elysia chlorotica". Proc. Natl. Acad. Sci. U.S.A. 105 (46): 17867–17871. doi:10.1073/pnas.0804968105. PMC 2584685. PMID 19004808.
Bibliografía básica
[editar]- Azcón-Bieto, J. y M. Talón (eds.). Fundamentos de Fisiología Vegetal. Madrid: McGraw-Hill/Interamericana, Edicions Universitat de Barcelona, 2000.
- Buchanan, B. B., W. Gruissem, R. Jones. Biochemistry and Molecular Biology of plants. Rockville (USA): American Society of Plant Physiologists, 2000.
- Dennis, D. T. y D. H. Turpin (eds). Plant metabolism. Plant physiology, Biochemistry, and Molecular Biology. Orlando, USA: Academic Press, 1998.
- Heldt, H. W. Plant Biochemistry and Molecular Biology. Oxford (U.K.): Oxford University Press, 2004.
- Salisbury, Frank B. y Cleon W. Ross. Fisiología Vegetal. México: Grupo Editorial Iberoamericana, 1994. (traducción de la 4.ª edición original en inglés: Plant Physiology. Wadsworth, 1992; existe también una reedición de la versión española en tres volúmenes: Madrid: Paraninfo, 2000).
- Taiz, L. y E. Zeiger. Plant Physiology. Sunderland, Massachusetts: Sinauer Associates Inc., 2002.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Fotosíntesis.
Wikimedia Commons alberga una categoría multimedia sobre Fotosíntesis. Wikcionario tiene definiciones y otra información sobre fotosíntesis.
Wikcionario tiene definiciones y otra información sobre fotosíntesis.- Fotosíntesis, Nociones ¿Sustituto de los combustibles fósiles? barrameda.com.ar
- Esquema de la fotosíntesis. Educaplus.org
- Fotosíntesis en recursos.cnice.mec.es


