Anas platyrhynchos
| Ánade real | ||
|---|---|---|
 | ||
| Estado de conservación | ||
 Preocupación menor (UICN 3.1)[1] | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Aves | |
| Orden: | Anseriformes | |
| Familia: | Anatidae | |
| Género: | Anas | |
| Especie: |
A. platyrhynchos Linnaeus, 1758 | |
| Distribución | ||
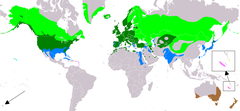 Distribución natural y por introducción. Área de cría. Área de ocupación permanente. Área de migración. Área de invernada. Vagrant (estacionalidad incierta). Área de probablemente extinto e introducción. Área de introducción (estacionalidad incierta).
Área de introducción supuesta (estacionalidad incierta). | ||
| Subespecies | ||
| ||
El ánade real, ánade azulón o pato de collar (Anas platyrhynchos)[2] es una especie de ave anseriforme de la familia Anatidae. Es un ánade de superficie muy común y extendido por el hemisferio norte. Habita áreas de temperatura templada de Norteamérica, Europa, Asia y el norte de África. Como ave migratoria también frecuenta Centroamérica y el Caribe, y ha sido introducido en Australia y Nueva Zelanda.
Taxonomía y evolución
[editar]El ánade fue una de las muchas aves descritas científicamente por Carlos Linneo en su obra Systema naturæ de 1758, y todavía lleva su nombre binomial original.[3]


Los ánades reales hibridan con sus parientes más cercanos dentro del género Anas, como el ánade sombrío, y con algunas especies más alejadas como el ánade rabudo, produciendo diversos híbridos que pueden ser totalmente fértiles.[4] Este inusual fenómeno que se produce entre las especies de ánades se debe a que el azulón y los demás patos del género Anas han evolucionado muy rápido y recientemente, a finales del Pleistoceno. Los linajes de esta radiación se mantienen separados al no coincidir sus áreas de distribución o por motivos de comportamiento, pero todavía no son genéticamente incompatibles.[5] Además los azulones son conespecíficos de los patos domésticos (Anas platyrhynchos domesticus) y completamente fértiles en su cruzamiento.
A juzgar por su biogeografía el azulón parece estar más próximo a sus parientes indopacíficos que a los americanos. Según las secuencias de su ADN mitocondrial de los bucles de desplazamiento,[6] habría evolucionado en una región de Siberia y alrededores. Además aparece repentinamente entre los restos fósiles de Europa sin que haya un candidato claro para ser su ancestro en la zona. La paleoespecie de gran tamaño que formaban al menos las poblaciones europeas y del oeste de Asia durante el Pleistoceno se ha denominado Anas platyrhynchos palaeoboschas.
Existen diferencias en el ADN mitocondrial entre los ánades reales de Norteamérica y Eurasia,[7] pero no se encuentra un patrón claro de diferenciación en su genoma nuclear.[8] Aparecen haplotipos típicos de los parientes cercanos norteamericanos y del ánade picopinto en los azulones de los alrededores del mar de Bering.[6] Hay una población de ánades reales en las islas Aleutianas que parece estar evolucionando hacia una subespecie, ya que su flujo genético con las demás poblaciones es muy reducido.[9]
El tamaño de los ánades reales varía clinalmente, por lo que los individuos de Groenlandia son más grandes, robustos y con el pico más corto que las poblaciones del sur. Algunos ornitólogos separan a los azulones de Groenlandia en una subespecie (A. p. conboschas).
Descripción
[editar]

El ánade real es un ave de tamaño medio, aunque ligeramente más pesado que la mayoría de los patos de superficie. Mide entre 50-65 cm de largo (de los cuales dos tercios corresponden al cuerpo), tiene una envergadura alar de 81-98 cm,[10] y suele pesar entre 0,72-1,58 kg.[11][12] Sus medidas corporales estándar son: cuerda máxima del ala entre 25,7 y 30,6 cm, pico entre 4,4 y 6,1 cm y tarso entre 4,1 y 4,8 cm.[13]
Presenta un marcado dimorfismo sexual en su plumaje. El macho en plumaje reproductivo es inconfundible. Su cabeza y cuello son de color verde oscuro brillante enmarcados con una lista blanca a modo de collar. Su pecho es castaño con tonos púrpura. El resto de su plumaje es grisáceo (más oscuro en las partes superiores) salvo el obispillo y las plumas centrales de la cola, rizadas hacia arriba, que son negros, las plumas laterales de la cola, que son blancas, y el espejuelo de las alas.[14] La hembra tiene un plumaje de colores más apagados, predominantemente veteado en tonos pardos, de marcado contraste entre tonos claros y oscuros debido a que cada pluma puede ser en parte desde el pardo oscuro al crema claro. Esta coloración es compartida por la mayoría de las hembras de patos de superficie. Su cabeza es principalmente de tonos crema con una lista ocular y píleo oscuros.[14] Ambos sexos tienen un característico espejuelo en sus plumas secundarias de color azul iridiscente (o morado según el ángulo en que se vea) con un borde interior negro y otro exterior blanco. En el caso de la hembra, el espejuelo permite diferenciarla de las hembras de otras especies de patos. El pico del macho es amarillo con la punta negra, mientras que el de la hembra es más oscuro, oscilando del naranja manchado al pardo negruzco. Las patas de ambos son de color naranja. Tras la época de cría, los machos mudan su plumaje pasando al plumaje de eclipse, de tonos similares al de las hembras. Al final de esta muda estival, ambos sexos pierden las plumas de vuelo aproximadamente durante un mes (periodo de mancada), por lo que temporalmente carecen de su característico espejuelo.

Al nacer los patitos están cubiertos de plumón de color amarillo en las partes inferiores y el rostro, y pardo negruzco en las superiores, con algunas motas amarillas. Sus patas y pico son negruzcos. Con el primer emplumado los patitos adquieren un plumaje de tonos pardos similar al de las hembras, aunque más veteado, y sus patas y pico se van aclarando.[14] El periodo de emplumado termina a los dos meses tras la eclosión. Los juveniles empiezan a volar a los tres o cuatro meses, cuando sus alas y musculatura están completamente desarrolladas. Los juveniles pueden distinguirse por el color de su pico, amarillo para los machos y naranja o pardo para las hembras; su pecho, que es pardo rojizo en el caso de los machos, y las plumas centrales de la cola, que están rizadas hacia arriba en los machos y son rectas en las hembras.
Al acercarse al periodo de madurez sexual (entre los 6-10 meses), el plumaje de las hembras permanece igual mientras que el de los machos va cambiando paulatinamente hasta alcanzar los tonos del adulto. Este cambio en el plumaje es similar al de los machos adultos al llegar la primavera y volver a adquirir el plumaje reproductivo. La madurez sexual de los azulones se produce a los catorce meses y tienen una esperanza de vida de tres años.[15]
Los patos domésticos pueden ser de coloración similar a los patos silvestres, blancos y de otros colores no presentes en las poblaciones salvajes.
Son una especie ruidosa, los machos emiten un graznido nasal agudo a modo de bocinazo, mientras que las hembras producen el cuac más grave que en general se atribuye a los patos.[16][17]
Distribución y hábitat
[editar]
Los ánades reales están ampliamente distribuidos por el hemisferio norte y han sido introducidos en algunas regiones del hemisferio sur. Se encuentran de forma natural en Norteamérica desde Alaska y Groenlandia hasta México, las islas de Hawái, la mayor parte de Eurasia desde Islandia y Escandinavia por el oeste hasta Siberia, China y Japón por el este, además del norte de África.[10] Ha sido introducido en Australia y Nueva Zelanda. Es un ave migratoria de larga distancia en las partes septentrionales de su área de distribución, pasando el invierno en las del sur. Por ejemplo, los de Norteamérica pasan el invierno en México, y también se adentran regularmente en América Central y el Caribe entre septiembre y mayo.[18]
Los azulones habitan en una gran variedad de hábitats y climas, desde la tundra ártica a las regiones subtropicales. Se encuentra tanto en humedales de aguas dulces como saladas, incluidos los lagos, las lagunas, los ríos, pantanos y estuarios, además de las ensenadas someras y el mar abierto cercano a la costa; y también los parques y zonas urbanas. Prefieren las aguas poco profundas, de menos de un metro, y suelen evitar las más profundas. Y se sienten atraídos por las masas de agua con vegetación acuática.[17]
Comportamiento
[editar]Es un ave muy gregaria fuera de la época de cría, y puede formar grandes bandadas.[19] Es un pato bastante arisco y desconfiado, que raramente permite el acercamiento a corta distancia, siendo normalmente el primero que huye ante la presencia humana (salvo los residentes en las urbes). Se agrupa para sestear durante el día y por la noche se desplaza a los comederos. Su gran capacidad de adaptación y aprovechamiento de distintas fuentes de alimentos son las razones de su numerosa población.

Alimentación
[editar]
Generalmente se alimentan en la superficie del agua, llegando a sumergir medio cuerpo, o pastan cerca de las orillas. Los ánades reales son omnívoros y muy flexibles respecto a sus elecciones alimenticias. Su dieta puede variar según varios factores, como la época de su ciclo de reproducción, variaciones en la disponibilidad de alimentos y la competencia inter e intraespecífica.[20] La mayor parte de la dieta del azulón se compone de gran variedad de semillas y otra materia vegetal, incluidas raíces y tubérculos, e invertebrados como gasterópodos, insectos (entre los que se encuentran los escarabajos, moscas, mariposas, libélulas y figáneas), crustáceos y gusanos, también se ha registrado que comen pequeñas ranas. Se ha registrado que durante la época de cría los machos consumen un 37,6 % materia animal y un 62,4 % de materia vegetal, especialmente Echinochloa crus-galli, y las hembras que no ponen huevos comen un 37,0 % de materia animal y un 63,0 % de materia vegetal. En cambio las hembras que van a poner huevos consumen un 71,9 % de materia animal y solo un 28,1 % materia vegetal.[21] El resto del año la mayoría de la dieta de este pato está formada por plantas, especialmente durante la migración de otoño y el invierno.[22][23]
Reproducción
[editar]
Los ánades reales generalmente forman parejas (en octubre y noviembre en su área autóctona) solo hasta que las hembras ponen los huevos al principio de la primavera. En este periodo el macho la deja y se une a otros machos en espera de la época de muda estival que empieza en junio (en el hemisferio norte). Una vez adquiridas las plumas de contorno del plumaje de eclipse los machos pierden las plumas de vuelo quedando durante un mes aproximadamente sin capacidad de vuelo, por lo que permanecen escondidos entre la vegetación acuática. Las hembras no sufrirán este proceso hasta haber terminado de criar a su nidada. En el periodo previo a la muda los machos todavía están sexualmente activos y algunos permanecen a la espera para engendrar puestas de reposición, con aquellas hembras que han perdido o abandonado la anterior) o para aparearse por la fuerza con cualquier hembra de pato que aparezca aislada, sin importar su especie o si está criando una prole de patitos.

El periodo de anidamiento puede ser muy estresante para las hembras, ya que pueden poner más de la mitad de su peso en huevos. Para ello necesita mucho descanso y una zona de alimentación libre de depredadores. Cuando busca un lugar para anidar la hembra prefiere zonas ocultas, inaccesibles para los depredadores terrestres, o que tengan pocos depredadores en los alrededores. La puesta consta de entre ocho y trece huevos, que son incubados durante veintisiete o veintiocho días hasta su eclosión. La hembra cuida a sus crías en solitario, que tardan entre cincuenta y sesenta días en desarrollarse. Sus patitos son nidífugos y capaces de nadar y alimentarse solos desde el primer día. Los polluelos al nacer están recubiertos de plumón amarillo o marrón con la cara y otras manchas amarillas. La impronta les impulsa a seguir y quedarse junto a su madre, así no solo los protege y da calor, sino que aprenden lo que necesitan sobre su hábitat y dónde y cómo alimentarse. Cuando los patitos se han convertido en juveniles capaces de volar, aprenden y recuerdan sus rutas migratorias tradicionales al permanecer junto a su madre hasta la siguiente época de cría.
Con frecuencia cuando se forman las parejas uno o varios machos quedan de lado. Estos grupos a veces persiguen a hembras de pato aisladas, incluso a las de otras especies, hasta que las cansan y entonces copulan con ella por turnos. Lebret (1961) y Cramp y Simmons (1977) denominaron a este comportamiento «vuelo de intento de violación». Los machos de azulón ocasionalmente persiguen a los machos de otras especies de patos, o incluso entre ellos, con la misma intención. En un caso se documentó «necrofilia homosexual», un macho copuló con otro macho al que había perseguido en vuelo y estaba muerto tras chocar con una ventana de vidrio.[24] Esta investigación fue galardonada con el premio Ig Nobel de 2003.[25]
Los ánades reales son en ocasiones objetivo de parásitos de puesta oportunistas como los porrones americanos, malvasías canelas, porrones bola, ánades frisos, ánades rabudos, patos cuchara, cercetas coloradas, porrones osculados y otros azulones. Estos huevos generalmente son aceptados cuando se parecen a sus propios, pero si no la hembra de azulón intenta expulsarlos o incluso abandona el nido si el parasitismo se produce durante la puesta.[26]
Estado de conservación
[editar]
A diferencia de otras aves acuáticas el ánade real se ha beneficiado de las alteraciones humanas del medio ambiente. Son muy adaptables y son capaces de vivir, e incluso prosperar, en medios humanizados y urbanos, que antes podían haber sustentado a otras especies de patos más sensibles. Su población y área de distribución son enormes, y aunque se cree que su población está disminuyendo ligeramente no se acerca ni de lejos a los umbrales de amenaza, por lo que la UICN lo considera una especie bajo preocupación menor.[1]
La suelta de azulones en regiones donde no son nativos causa problemas debidos a la hibridación con los patos nativos, ya que se producen híbridos fértiles que contaminan genéticamente las poblaciones locales, y merman la posibilidad de supervivencia de los patos autóctonos más escasos. Los azulones son considerados una especie invasora en Nueva Zelanda y Sudáfrica.[10][27] Allí, y en otros lugares, los ánades reales se están extendiendo con ayuda de la creciente expansión urbana e hibridan con sus parientes cercanos locales.[28] Con el tiempo la hibridación ha creado un continuo de formas intermedias entre estas especies y el azulón, empezando así a revertirse el proceso de especiación.[29] Esto ha causado preocupación por parientes del ánade real como el pato de Hawái,[28][30] la subespecie A. s. superciliosa del ánade cejudo,[28][31][32][33] el ánade sombrío,[28][34][35][36] el ánade jaspeado,[28][37][38] el ánade malgache,[39] el ánade picolimón,[29] el pato mexicano,[28][38] en este último caso llegando incluso a cuestionarse si estas aves deberán considerarse una especie.[40] En Florida se ha prohibido la posesión y cría de ánades reales para evitar así la hibridación con los patos jaspeados nativos.[41] El ánade picopinto está sufriendo introgresión por parte de la población de azulones del Krai de Primorie, posiblemente debida a los cambios del hábitat debidos al calentamiento global.[6]
A su vez el acervo genérico de los ánades reales silvestres, que son los ancestros de los patos domésticos, puede contaminarse por la hibridación de los patos domésticos y los patos asilvestrados.[42][43][27]
Genoma
[editar]El genoma del ánade real fue secuenciado en 2013.[44] En él se observaron características importantes, como la contracción de familias de genes de la inmunidad con respecto a sus familias equivalentes en mamíferos. Además, dado que esta ave es un reservorio natural del virus de la gripe aviar, se identificaron genes cuyos patrones de expresión se alteran en respuesta a la infección de este virus, concretamente tras la infección con el subtipo H5N1.[44]
Depredadores
[editar]Los depredadores de estos patos son el halcón peregrino, el gavilán, el águila real, el águila calva, la garza real, el búho real, la lechuza, el cuervo, la urraca, la cigüeña, la gaviota, la rata, el mapache, el zorro, la mofeta, la zarigüeya, el armiño, la comadreja, el vison, el hurón el coyote, el gato, el lince canadiense, el perro, la nutria, el tejón y la tortuga mordedora. Tanto en Europa y en América del Norte.
Véase también
[editar]Referencias
[editar]- ↑ a b BirdLife International (2012). «Anas platyrhynchos». Lista Roja de especies amenazadas de la UICN 2015.2 (en inglés). ISSN 2307-8235. Consultado el 24 de agosto de 2015.
- ↑ Bernis, F; De Juana, E; Del Hoyo, J; Fernández-Cruz, M; Ferrer, X; Sáez-Royuela, R; Sargatal, J (1994). «Nombres en castellano de las aves del mundo recomendados por la Sociedad Española de Ornitología (Primera parte: Struthioniformes-Anseriformes)». Ardeola. Handbook of the Birds of the World (Madrid: SEO/BirdLife) 41 (1): 79-89. ISSN 0570-7358. Consultado el 11 de diciembre de 2013.
- ↑ Linnaeus, Carl (1758). Systema naturæ per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata (en latín). Estocolomo: Laurentius Salvius. p. 125.
- ↑ Phillips, John C. (enero de 1915). «Experimental studies of hybridization among ducks and pheasants». Journal of Experimental Zoology 18 (1): 69-143. doi:10.1002/jez.1400180103.
- ↑ Kraus, Robert HS; Kerstens, Hindrik HD; van Hooft, Pim; Megens, Hendrik-Jan; Elmberg, Johan; Tsvey, Arseny; Sartakov, Dmitry; Soloviev, Sergej A.; Crooijmans, Richard P. M. A.; Groenen, Martien A. M.; Ydenberg, Ronald C.; Prins, Herbert H. T. (2012). «Widespread horizontal genomic exchange does not erode species barriers among sympatric ducks». BMC Evolutionary Biology 12 (1): 45. doi:10.1186/1471-2148-12-45.
- ↑ a b c Kulikova, Irina V.; Zhuravlev, Yury N.; McCracken, Kevin G. (2004). «Asymmetric hybridization and sex-biased gene flow between Eastern Spot-billed Ducks (Anas zonorhyncha) and Mallards (A. platyrhynchos) in the Russian Far East» (PDF). The Auk 121 (3): 930. doi:10.1642/0004-8038(2004)121[0930:AHASGF]2.0.CO;2. Archivado desde el original el 10 de agosto de 2007.
- ↑ Kraus, R. H.; Zeddeman, A.; van Hooft, P.; Sartakov, D.; Soloviev, S. A.; Ydenberg, R. C.; Prins, H. H. (17 de noviembre de 2011). «Evolution and connectivity in the world-wide migration system of the mallard: inferences from mitochondrial DNA». BMC genetics 12: 99. PMID 22093799. doi:10.1186/1471-2156-12-99.
- ↑ Kraus, Robert H. S.; van Hooft, Pim; Megens, Hendrik-Jan; Tsvey, Arseny; Fokin, Sergei Y.; Ydenberg, Ronald C.; Prins, Herbert H. T. (enero de 2013). «Global lack of flyway structure in a cosmopolitan bird revealed by a genome wide survey of single nucleotide polymorphisms». Molecular Ecology 22 (1): 41-55. PMID 23110616. doi:10.1111/mec.12098.
- ↑ Kulikova, Irina V.; Drovetski, Sergei V.; Gibson, Daniel D.; Harrigan, Ryan J.; Rohwer, Sievert; Sorenson, Michael D.; Winker, Kevin; Zhuravlev, Yuri N. et al. (de 2005). «Phylogeography of the Mallard (Anas platyrhynchos): hybridization, dispersal, and lineage sorting contribute to complex geographic structure» (PDF). The Auk 122 (3): 949-965. doi:10.1642/0004-8038(2005)122[0949:POTMAP]2.0.CO;2. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ a b c Cramp 1977, p. 505.
- ↑ «Mallard, Life History». All About Birds. Cornell Lab of Ornithology. 23 de agosto de 2012.
- ↑ John B. Dunning Jr., ed. (1992). CRC Handbook of Avian Body Masses. CRC Press. ISBN 978-0-8493-4258-5.
- ↑ Madge, Steve, Waterfowl: An Identification Guide to the Ducks, Geese, and Swans of the World. Houghton Mifflin Harcourt (1992), ISBN 978-0-395-46726-8
- ↑ a b c Cramp 1977, p. 506.
- ↑ BTO: Mallard Anas platyrhynchos.
- ↑ Rogers, D. (2001). «Anas platyrhynchos». Animal Diversity Web. Museum of Zoology, University of Michigan. Consultado el 8 de diciembre de 2006.
- ↑ a b Cramp 1977, p. 507.
- ↑ Herrera, Néstor; Rivera, Roberto; Ibarra Portillo, Ricardo; Rodríguez, Wilfredo (2006). «Nuevos registros para la avifauna de El Salvador» [New records for the avifauna of El Salvador] (PDF). Boletín de la Sociedad Antioqueña de Ornitología 16 (2): 1-19.
- ↑ «Baltimore Bird Club. Group Name for Birds: A Partial List». Consultado el 3 de junio de 2007.
- ↑ Krapu, Gary L.; Reinecke, Kenneth J. (1992). «Foraging ecology and nutrition». En Batt, Bruce D. J.; Afton, Alan D.; Anderson, Michael G.; Ankney, C. Davison; Johnson, Douglas H.; Kadlec, John A.; Krapu, Gary L., ed. Ecology and Management of Breeding Waterfowl. Minneapolis: University of Minnesota Press. pp. 1-30 (10). ISBN 978-0-8166-2001-2.
- ↑ Swanson, George A.; Meyer, Mavis I.; Adomaitis, Vyto A. (1985). «Foods consumed by breeding mallards on wetlands of south-central North Dakota». Journal of Wildlife Management 49 (1): 197-203. JSTOR 3801871. doi:10.2307/3801871.
- ↑ Gruenhagen, Ned M.; Fredrickson, Leigh H. (1990). «Food use by migratory female mallards in northwest Missouri». Journal of Wildlife Management 54 (4): 622-626. JSTOR 3809359. doi:10.2307/3809359.
- ↑ Combs, Daniel L.; Fredrickson, Leigh H. (1990). «Foods used by male mallards wintering in southeastern Missouri». Journal of Wildlife Management 60 (3): 603-610. JSTOR 3802078. doi:10.2307/3802078.
- ↑ Moeliker, C. W. (2001). «The first case of homosexual necrophilia in the Mallard Anas platyrhynchos (Aves: Anatidae)» (PDF). Deinsea 8 (243-247).
- ↑ MacLeod, Donald (8 de marzo de 2005). «Necrophilia among ducks ruffles research feathers». The Guardian. Consultado el 9 de diciembre de 2006.
- ↑ Drilling, Nancy; Titman, Roger; Mckinney, Frank (2002). «Mallard (Anas platyrhynchos)». En Poole, A., ed. The Birds of North America Online. Ithica: Cornell Lab of Ornithology. doi:10.2173/bna.658. Consultado el 1 de febrero de 2011.
- ↑ a b Invasive Alien Bird Species Pose A Threat, Kruger National Park. Siyabona Africa Travel (Pty) Ltd – South Africa Safari Travel Specialist. Krugerpark.co.za. Consultado el 23 de agosto de 2012.
- ↑ a b c d e f Rhymer, Judith M.; Simberloff, Daniel (1996). «Extinction by hybridization and introgression». Annual Review of Ecology and Systematics 27: 83-109. doi:10.1146/annurev.ecolsys.27.1.83.
- ↑ a b Rhymer, Judith M. (2006). «Extinction by hybridization and introgression in anatine ducks» (PDF). Acta Zoologica Sinica 52 (Supplement): 583-585. Archivado desde el original el 3 de diciembre de 2013. Consultado el 29 de septiembre de 2014.
- ↑ Griffin, C. R.; Shallenberger, F. J.; Fefer, S. I. (1989). «Hawaii's endangered waterbirds: a resource management challenge». En R. R. Sharitz & I. W. Gibbons, ed. Proceedings of Freshwater Wetlands and Wildlife Symposium. Aiken, South Carolina: Savannah River Ecology Lab. pp. 155-169.
- ↑ Gillespie, Grant D. (1985). «Hybridization, introgression, and morphometric differentiation between Mallard (Anas platyrhynchos) and Grey Duck (Anas superciliosa) in Otago, New Zealand» (PDF). The Auk 102 (3): 459-469.
- ↑ Rhymer, Judith M.; Williams, Murray J.; Braun, Michael J. (1994). «Mitochondrial analysis of gene flow between New Zealand Mallards (Anas platyrhynchos) and Grey Ducks (A. superciliosa)» (PDF). The Auk 111 (4): 970-978. doi:10.2307/4088829.
- ↑ Williams, Murray; Basse, Britta (2006). «Indigenous gray ducks, Anas superciliosa, and introduced mallards, A. platyrhynchos, in New Zealand: processes and outcome of a deliberate encounter» (PDF). Acta Zoologica Sinica 52 (Supplement): 579-582. Archivado desde el original el 19 de febrero de 2014. Consultado el 29 de septiembre de 2014.
- ↑ Johnsgard, Paul A. (1967). «Sympatry changes and hybridization incidence in Mallards and Black Ducks». American Midland Naturalist 77 (1): 51-63. doi:10.2307/2423425.
- ↑ Avise, John C.; Ankney, C. Davison; Nelson, William S. (1990). «Mitochondrial gene trees and the evolutionary relationship of Mallard and Black Ducks» (PDF). Evolution 44 (4): 1109-1119. doi:10.2307/2409570.
- ↑ Mank, Judith E.; Carlson, John E.; Brittingham, Margaret C. (2004). «A century of hybridization: decreasing genetic distance between American black ducks and mallards». Conservation Genetics 5 (3): 395-403. doi:10.1023/B:COGE.0000031139.55389.b1.
- ↑ Mazourek, J. C.; Gray, P. N. (1994). «The Florida duck or the mallard?» (DOC). Florida Wildlife 48 (3): 29-31. Archivado desde el original el 10 de agosto de 2007. Consultado el 29 de septiembre de 2014.
- ↑ a b McCracken, Kevin G.; Johnson, William P.; Sheldon, Frederick H. (2001). «Molecular population genetics, phylogeography, and conservation biology of the mottled duck (Anas fulvigula)» (PDF). Conservation Genetics 2 (2): 87-102. doi:10.1023/A:1011858312115. Archivado desde el original el 7 de septiembre de 2006.
- ↑ Young, H. Glyn; Rhymer, Judith M. (1998). «Meller's duck: A threatened species receives recognition at last». Biodiversity and Conservation 7 (10): 1313-1323. doi:10.1023/A:1008843815676.
- ↑ American Ornithologists' Union (AOU) (1983). Check-list of North American Birds (6th edición). Washington, DC: American Ornithologists' Union.
- ↑ «Mallard Possession Rule». Florida Fish and Wildlife Conservation Commission. Archivado desde el original el 5 de marzo de 2016. Consultado el 11 de enero de 2011.
- ↑ «Mottled Ducks : The Problem : Hybridization; Florida Fish and Wildlife Conservation Commission». Myfwc.com. Archivado desde el original el 20 de abril de 2006. Consultado el 23 de agosto de 2012.
- ↑ Environmental assessment for control of free-ranging resident mallards in Florida, May 2002, Contact: Frank Bowers, U.S. Fish and Wildlife Service Archivado el 6 de septiembre de 2010 en Wayback Machine.. Fws.gov. Retrieved on 23 August 2012.
- ↑ a b Huang, Y.; Li, Y.; Burt, D. W.; Chen, H.; Zhang, Y.; Qian, Wubin; Kim, Heebal; Gan, Shangquan; Zhao, Yiqiang; Li, Jianwen; Yi, Kang; Feng, Huapeng; Zhu, Pengyang; Li, Bo; Liu, Qiuyue; Fairley, Suan; Magor, Katharine E.; Du, Zhenlin; Hu, Xiaoxiang; Goodman, Laurie; Tafer, Hakim; Vignal, Alain; Lee, Taeheon; Kim, Kyu-Won; Sheng, Zheya; An, Yang; Searle, Steve; Herrero, Javier; Groenen, Martien A. M. et al. (2013). «The duck genome and transcriptome provide insight into an avian influenza virus reservoir species». Nature Genetics (Nature Publishing) 45 (7): 776-783. PMID 23749191. doi:10.1038/ng.2657.
Bibliografía
[editar]- Bagemihl, Bruce (1999). Biological Exuberance: Animal Homosexuality and Natural Diversity. St. Martin's Press. pp. 479-481. ISBN 978-0-312-19239-6.
- Cramp, Stanley, ed. (1977). Handbook of the Birds of Europe the Middle East and North Africa, the Birds of the Western Palearctic, Volume 1: Ostrich to Ducks. Oxford: Oxford University Press. ISBN 978-0-19-857358-6.
- Johnson, Kevin P.; Sorenson, M. D. (1999). «Phylogeny and biogeography of dabbling ducks (genus Anas): a comparison of molecular and morphological evidence» (PDF). The Auk 116 (3): 792-805. doi:10.2307/4089339.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Anas platyrhynchos.
Wikimedia Commons alberga una categoría multimedia sobre Anas platyrhynchos. Wikispecies tiene un artículo sobre Anas platyrhynchos.
Wikispecies tiene un artículo sobre Anas platyrhynchos.- Vídeos de Anas platyrhynchos en Internet Bird Collection.
- Ficha de la especie (PDF), por Javier Blasco-Zumeta & Gerd-Michael Heinze.
- Ficha de la especie en proyectoavis.com.
- Sonidos y mapa de distribución de Anas platyrhynchos en Xeno-canto.


