Iodosobenzol
| Strukturformel | |||
|---|---|---|---|
| |||
| _ C _ H _ I _ O | |||
| Allgemeines | |||
| Name | Iodosobenzol | ||
| Andere Namen |
| ||
| CAS-Nummer | 536-80-1 | ||
| EG-Nummer | 208-648-8 | ||
| ECHA-InfoCard | |||
| Monomer | Iodosobenzol-Monomer | ||
| Summenformel der Wiederholeinheit | C6H5IO | ||
| Molare Masse der Wiederholeinheit | 219,94 g·mol−1 | ||
| PubChem | 92125 | ||
| Kurzbeschreibung |
gelblich-grauweiße Flocken[1] | ||
| Eigenschaften | |||
| Aggregatzustand |
fest[1] | ||
| Kristallinität | |||
| Löslichkeit |
| ||
| Sicherheitshinweise | |||
| |||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||
Iodosobenzol ist eine chemische Verbindung und ein Polymer.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Iodosobenzol kann durch basische Hydrolyse von Iodbenzoldichlorid[1] oder von Diacetoxyiodbenzol[4] gewonnen werden. Es kann auch durch Oxidation von Iodbenzol mit Ozon synthetisiert werden.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
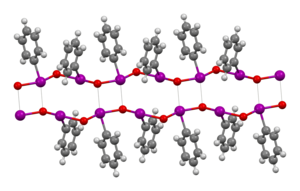
[Bearbeiten | Quelltext bearbeiten]Man ging lange Zeit davon aus, Iodosobenzol sei amorph.[1] Wegeberg et al. fanden jedoch 2016 ein monoklines Kristallsystem mit der Raumgruppe P21/c. Die Gitterparameter bestimmten sie zu a=14,306(4) Å, b=5,868(1) Å, c=7,407(4) Å, α=90 °, β=101,04(3) °C, γ=90 °C. Die Autoren erklärten mit der doppelschichtigen Kristallstruktur die schlechte Löslichkeit in den meisten Lösungsmitteln.[2] Die Iod–Sauerstoff-Bindung ist im Gegensatz zu vielen früher gezeigten Elektronenformeln eine σ-Bindung, keine π-Bindung. Zudem geht man nach theoretischen Betrachtungen davon aus, dass im Monomer dementsprechend eine zwitterionische Iod–Sauerstoff-Bindung vorliegt, was der Oktettregel entspräche.[5] Dass üblicherweise jedoch eine polymere Form mit Iod-Sauerstoff-Ketten vorliegt, schlossen Hans Siebert und Monika Handrich schon 1976 aus Schwingungsspektren. Dieser Schluss kam zum einen dadurch zustande, dass I–O-Valenzschwingungen im selben Bereich auftraten wie bei Diiodpentoxid, in welchem ebenfalls I–O-Einfachbindungen vorliegen und zum anderen dadurch, dass nicht eine einzelne derartige I–O-Valenzschwingung, sondern zwei verschiedene beobachtet wurden. Die entsprechenden Banden liegen im Bereich 400–500 cm−1.[6]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Alkohole sind imstande das Iodosobenzol langsam zu Iodbenzol zu reduzieren. Dabei oxidieren die Alkohole selbst zu Aldehyden. Bei Erwärmen disproportioniert es zu Iodylbenzol[7] und Iodbenzol. Diese Mischung explodiert heftig bei 210 °C. Ameisensäure wird von Iodosobenzol zu Kohlenstoffdioxid oxidiert. Es reagiert außerdem heftig mit Anilin.[1] Bei Glycalen führt Iodosobenzol in saurer, wasserfreien Umgebung zu Ringverengung.[8]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Iodosobenzol wird in chemischen Synthesen als Sauerstoff-Transfer-Reagenz verwendet.[2] Typisch ist die Erzeugung von Nitriloxiden aus Aldoximen mittels diesen Reagenzes.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h C. Willgerodt: Die organischen Verbindungen mit mehrwertigem Iod. In: J. Schmidt (Hrsg.): Chemie in Einzeldarstellungen. Band 7. Verlag von Ferdinand Enke, Stuttgart 1914, S. 30–33.
- ↑ a b c C. Wegeberg, C. G. Frankær, C. J. McKenzie: Reduction of hypervalent iodine by coordination to iron(III) and the crystal structures of PhIO and PhIO2. In: Dalton Transactions. Band 45, Nr. 44, 2016, S. 17714–17722, doi:10.1039/C6DT02937J.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. Saltzman, J. G. Sharefkin: IODOSOBENZENE. In: Organic Syntheses. Band 43, 1963, S. 60, doi:10.15227/orgsyn.043.0060.
- ↑ A. S. Ivanov, I. A. Popov, A. I. Boldyrev, V. V. Zhdankin: The I=X (X= O,N,C) Double Bond in Hypervalent Iodine Compounds: Is it Real? In: Angewandte Chemie International Edition. Band 126, Nr. 36, 2014, S. 9771–9775, doi:10.1002/anie.201405142.
- ↑ H. Siebert, M. Handrich: Schwingungsspektren und Struktur von Jodosyl-und Jodyl-Verbindungen. In: Zeitschrift für anorganische und allgemeine Chemie. Band 426, Nr. 2, 1976, S. 173–183, doi:10.1002/zaac.19764260206.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Iodylbenzol: CAS-Nr.: 696-33-3, ECHA-InfoCard: 100.220.923, GESTIS: 496329, PubChem: 101840, ChemSpider: 92012, Wikidata: Q83096903.
- ↑ K. M. Engstrom, M. R. Mendoza, M. Navarro-Villalobos, D. Y. Gin: Total Synthesis of (+)-Pyrenolide D. In: Angewandte Chemie International Edition. Band 40, Nr. 6, 16. März 2001, S. 1128–1130, doi:10.1002/1521-3773(20010316)40:6<1128::AID-ANIE11280>3.0.CO;2-J.
- ↑ N. Chatterjee, P. Pandit, S. Halder, A. Patra, D. K. Maiti: Generation of nitrile oxides under nanometer micelles built in neutral aqueous media: Synthesis of novel glycal-based chiral synthons and optically pure 2, 8-dioxabicyclo[4.4.0]decene core. In: The Journal of Organic Chemistry. Band 73, Nr. 19, 2008, S. 7775–7778, doi:10.1021/jo801337k.
