Amoniwm clorid
 | |
 | |
| Enghraifft o'r canlynol | math o endid cemegol |
|---|---|
| Math | clorid |
| Màs | 53.003227 uned Dalton |
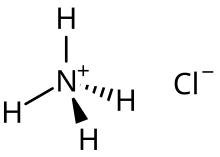
| Fformiwla gemegol | Clh₄n |
| Yn cynnwys | nitrogen, hydrogen, clorin |
| Gwneuthurwr | Pfizer |


Yn ei ffurf buraf, halwyn o grisialau gwynion ydy Amoniwm clorid (NH4Cl) (hefyd: Sal Amoniac, salmiac, sal armagnac neu sal armoniac). Gall hydoddi'n hawdd mewn dŵr ac mae'n asid gwan. Gellir ei gloddio fel mwyn o'r ddaear a gelwir y mwyn hwn yn "sal amoniac". Gall hefyd ffurfio pan losgir tomenni glo drwy gyddwyso o nwyon y glo; fe wnâ hyn hefyd ar losgfynyddoedd.
Ei greu mewn diwydiant
[golygu | golygu cod]Gellir ei gynhyrchu (ar ffurf isgynnyrch) mewn labordy yn y broses o greu sodiwm carbonad.[1]
Caiff ei gynhyrchu mewn diwydiant drwy greu adwaith cemegol rhwng amonia (NH3) a hydrogen clorid (HCl). Gan fod y ddau gemegolyn hyn yn gyrydol (Sa: corrosive) mae'r broses hon yn cael ei wneud mewn cynhwysyn enfawr wedi'i leinio gyda defnydd sydd ddim yn cyrydu ee gwydr, enamel, plwm neu upvc.[1]
- NH3 + HCl → NH4Cl
Gall yr adwaith hwn hefyd ddigwydd yn y cartref neu'r labordy pan gedwir dwy botel o'r cemegolion amonia (neu amoniwm hydrocsid) ac asid hydroclorig ochr yn ochr, a'r rheiny heb eu selio'n iawn. Bydd grisialau'n ffurfio o amgylch yr agoriadau di-sel.
Gweler hefyd
[golygu | golygu cod]Cyfeiriadau
[golygu | golygu cod]- ↑ 1.0 1.1 Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0123526515
Dolenni allanol
[golygu | golygu cod]- (Saesneg) Ychwaneg o wybodaeth

