Trombopoetina
La trombopoetina (TPO) és una hormona implicada en l'hematopoesi –síntesi de cèl·lules i elements sanguinis– en particular és el principal factor de regulació de la producció de megacariòcits, les cèl·lules sintetitzadores de plaquetes, tant en la seva producció com en la seva maduració. És una glicoproteïna que actua com a lligand del receptor c-Mpl, situat a la membrana plasmàtica de nombroses cèl·lules hematopoètiques com els megacariòcits. La producció d'aquesta citocina en humans està codificada pel gen TPO i té lloc en el fetge (majoritàriament) i en els ronyons.[6]
Descobriment
[modifica]L'any 1958, Kelmen va descriure el terme “Trombopoetina” (TPO) com una substància humoral que causava l'augment de producció de plaquetes després de patir trombocitopènia. Durant molts anys es va intentar aïllar aquesta substància però no es va aconseguir. Aquest fet i el descobriment de citosines amb activitat megacariocítica van posar en dubte l'existència de la substància.
El 1990 es va descobrir el gen que codificava un receptor cel·lular truncat desconegut, Mpl. Dos anys més tard, es va clonar el gen homòleg cel·lular c-Mpl i es va observar que la seqüència era semblant a la d'altres gens de factors de creixement hematopoètics i el 1994 es va aconseguir purificar el lligand específic del receptor c-Mpl i van clonar el seu ADN complementari. Aquest ADNc aïllat codificava una proteïna que van anomenar TPO lligada al receptor c-Mpl. Finalment Wendling i el seu equip d'investigadors van demostrar que la trombopoesis s'activava pel domini extracel·lular del receptor c-Mpl unit a la TPO. Així doncs, es va confirmar que el lligand c-Mpl (TPO) era el factor regulador de la producció de plaquetes.[7]
Estructura
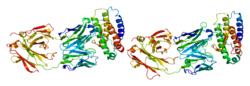
[modifica]La Trombopoetina és una hormona que pesa entre 80 i 90 kDa, en comparació amb el pes habitual de les poetines com l'eritropoetina, que pesa entre 15 i 20kDa. Es tracta d'un polipèptid de la família de les glicoproteïnes i està formada per una cadena de 353 monòmers d'aminoàcids, dels quals els 21 primers conformen el pèptid senyal. Aquesta proteïna es divideix en dos dominis ben diferenciats: aminoterminal i carboxiterminal.[7][8]
- Domini N-terminal: El formen 155 aminoàcids que s'estructuren amb 4 α-hèlix. Aquest domini és molt semblant a la seqüència de l'eritropoetina (EPO), ja que un 23% dels aminoàcids que la formen són idèntics als que formen la EPO i un 46% són molt semblants. Entre els aminoàcids d'aquesta regió, destaquen 4 cisteïnes(Cys) que permeten que es produeixin 2 enllaços disulfur, fet que proporciona forma circular a l'hormona i necessaris per a l'activitat d'aquesta. Aquest domini conté la regió que s'uneix al receptor c-Mpl (centre actiu), des de Asp8 fins a Gln28 i des de Ala60 fins a Arg117.[9]
- Domini C-terminal: El formen 177 aminoàcids de seqüència única. En aquest domini es troben les glicosilacions que donen caràcter glicídic a l'hormona, hi ha 6 llocs amb potencial de N-glicosilació. Els glícids donen estructura a la TPO, augmenten la permanència d'aquesta en la circulació sanguínia fins a 20-40 hores i són importants per la seva segregació.[7]
La proteïna presenta dues arginines (Arg) que són dos possibles punts de proteòlisis, una es localitza a la regió N-terminal (aminoàcid 152-153) i l'altra a la regió C-terminal (245-246).[10][11][12]
En la representació gràfica de l'estructura secundària de la TPO que apareix a continuació es pot veure que no coneixem la estructura de l'hormona en la seva totalitat. Això és degut al fet que només s'ha pogut cristal·litzar una part de la proteïna que és la de la qual podem observar l'estructura.
Seqüència:
1 MELTELLLVV MLLLTARLTL SSPAPPACDL RVLSKLLRDS HVLHSRLSQC PEVHPLPTPV
61 LLPAVDFSLG EWKTQMEETK AQDILGAVTL LLEGVMAARG QLGPTCLSSL LGQLSGQVRL
121 LLGALQSLLG TQLPPQGRTT AHKDPNAIFL SFQHLLRGKV RFLMLVGGST LCVRRAPPTT
181 AVPSRTSLVL TLNELPNRTS GLLETNFTAS ARTTGSGLLK WQQGFRAKIP GLLNQTSRSL
241 DQIPGYLNRI HELLNGTRGL FPGPSRRTLG APDISSGTSD TGSLPPNLQP GYSPSPTHPP
301 TGQYTLFPLP PTLPTPVVQL HPLLPDPSAP TPTPTSPLLN TSYTHSQNLS QEG
Estructura secundària:

| Caràcter | Posició |
|---|---|
| α-hèlix | 32-45 |
| α-hèlix | 46-48 |
| Làmina β | 49-52 |
| Làmina β | 60-63 |
| α-hèlix | 70-74 |
| α-hèlix | 77-98 |
| Gir | 99-101 |
| Làmina β | 104-106 |
| α-hèlix | 107-110 |
| α-hèlix | 113-129 |
| Làmina β | 139-143 |
| α-hèlix | 145-147 |
| α-hèlix | 148-157 |
| Gir | 158-160 |
| α-hèlix | 161-163 |
| Làmina β | 165-167 |
Modificacions als aminoàcids
| Modificació | Posició | Descripció |
|---|---|---|
| Glicosilació | 22 | O-glucosilació |
| Pont disulfur | 28-172 | |
| Pont disulfur | 50-106 | |
| Glicosilació | 58 | O-glucosilació |
| Glicosilació | 131 | O-glucosilació |
| Glicosilació | 179 | O-glucosilació |
| Glicosilació | 180 | O-glucosilació |
| Glicosilació | 184 | O-glucosilació |
| Glicosilació | 197 | N-glicosilació |
| Glicosilació | 206 | N-glicosilació |
| Glicosilació | 213 | O-glucosilació |
| Glicosilació | 234 | N-glicosilació |
| Glicosilació | 255 | N-glicosilació |
| Glicosilació | 265 | O-glucosilació |
| Glicosilació | 340 | N-glicosilació |
| Glicosilació | 348 | N-glicosilació |
Tipus de TPO segons l'estructura
[modifica]En assajos clínics s'estan estudiant dos tipus diferents de trombopoetina que varia la seva estructura en el domini carboxiterminal. Un d'aquests tipus és la TPO humana recombinant que és un polipèptid sencer, l'altre tipus s'anomena "PEG conjugat recombinant humana de creixement de megacariòcits i factor de desenvolupament". Aquest segon tipus és la proteïna manipulada que només conté la part que s'uneix al receptor c-Mpl. La proteïna s'ha modificat químicament mitjançant la unió de polietilenglicol (PEG). Les activitats biològiques dels dos tipus de TPO es creu que són molt semblants, tot i que encara no es coneixen exactament les diferències.[13][14]
Síntesi
[modifica]La síntesi de la trombopoetina depèn del nivell de transcripció del gen TPO. Aquest gen es localitza al cromosoma 3 (regió q26-q27) i conté 5 exons codificadors i 2 no codificadors. La mutació d'aquest gen pot originar anomalies al nostre cos.[7]
La TPO es pot sintetitzar a diferents òrgans del nostre cos. Els llocs principals d'aquesta síntesi són el fetge (60%) i el ronyó. Altres llocs menys freqüents són la melsa, els testicles, el múscul, el cervell i les cèl·lules de la medul·la òssia.
Una vegada s'ha secretat aquest factor que s'allibera directament a la circulació sense emmagatzemar-se, la seva vida mitjana és de 20 a 40 hores. La seva degradació comença després de la unió a receptors específics c-Mpl situats a la superfície de megacariòcits i plaquetes.
Receptor
[modifica]
El receptor de la trombopoetina (TPO-R) és una molècula anomenada c-Mpl (vegeu A en la imatge unió TPO amb el receptor c-Mpl), producte del gen c-Mpl; és una monocadena polipeptídica transmembranal amb una part extracel·lular, on la TPO activa el receptor, i una part intracel·lular, on es produeixen les fosforilacions del receptor. Quan la TPO s'uneix a c-Mpl es forma un complex lligand-receptor i aquest darrer es dimeritza, és a dir forma un complex de dues molècules idèntiques on anteriorment només n'hi havia una (vegeu B en la imatge). A l'extrem intracel·lular s'uneix la cinasa JAK-2, que s'activa quan el lligand (TPO) s'uneix al receptor (vegeu C en la imatge), i fosforila certes tirosines (Tys) específiques de c-Mpl (vegeu D en la imatge). Les tirosines fosforilades seran el lloc d'unió dels senyals intracel·lulars que activaran mecanismes de proliferació, maduració i poliploïdia en els megacariòcits i també de cèl·lules precursores d'altres processos hematopoètics.[17][18] Després d'unir-se al receptor la TPO és degradada a l'interior de la cèl·lula, aquesta propietat també la tenen les plaquetes i serveix com a mecanisme de regulació.[19]
Funció
[modifica]La trombopoetina és un una citocina que intervé en diversos processos hematopoètics -està implicada en la comunicació cel·lular durant la síntesi de cèl·lules i elements sanguinis tals com les plaquetes o els eritròcits-; promou la maduració de les cèl·lules mare hematopoètiques de la medul·la òssia i, alhora, regula processos de formació de cèl·lules específiques. Té un rol essencial en la proliferació i maduració dels megacariòcits, les cèl·lules sintetitzadores de plaquetes.[17]
La TPO és la principal hormona reguladora de la producció de plaquetes. S'uneix al receptor c-Mpl -situat a la membrana plaquetària i dels megacariòcits- que inicia la maduració d'aquests i la producció de plaquetes per tal de mantenir-ne un nombre adequat en el torrent sanguini.
Els megacariòcits són les cèl·lules que alliberen plaquetes i la principal cèl·lula diana de la trombopoetina. La TPO intervé en la seva proliferació, diferenciació, maduració i en l'alliberament de plaquetes. Altres citocines com IL-3 o IL-6 també regulen aquest procés però, tot i que alguns estudis determinen que existeixen rutes alternatives de producció de plaquetes sense TPO, és l'hormona principal del desenvolupament cel·lular dels megacariòcits i és essencial per la maduració total de la cèl·lula i la producció posterior de plaquetes.[20]
La trombopoetina -conjuntament amb altres citocines- també és responsable de l'augment del nombre dels megacariòcits i d'estimular poliploïdia, com a part de la seva maduració, en aquestes cèl·lules.[21]
La trombopoetina també intervé en la producció d'eritròcits a partir de cèl·lules mare hematopoètiques. Juntament amb l'eritropoetina, la principal citosina que regula el procés, estimula la maduració de les cèl·lules progenitores dels eritròcits. Tanmateix la importància de la TPO en aquest procés és molt més reduït que en la trombopoesi, ja que la TPO només actua en les primeres fases del procés mentre que en la trombopoesi a mesura que es produeix la maduració dels megacariòcits la quantitat de TPO implicada augmenta.[20][21]
Regulació
[modifica]Hi ha estudis que expliquen com es regulen els nivells de trombopoetina a la sang. Aquests diuen que:
La producció d'aquesta hormona és constant en el fetge, principalment, i als altres llocs on es sintetitza excepte en presència de certes patologies. Un cop és alliberada a la sang la quantitat de trombopoetina que hi ha a la sang va determinar per la massa de receptors c-Mpl lliures en el plasma. Aquests són les molècules per on es pot produir la unió entre la trombopoetina i c-Mpl mitjançant els mecanismes d'unió lligand/receptor.
Quan hi ha un augment de plaquetes també augmenta el nombre de receptors c-Mpl a la superfície d'aquestes i per tant la quantitat de TPO en sang disminueix. En el cas d'un individu amb trombocitopènia es redueix el catabolisme de la TPO, ja que hi ha un dèficit de trombòcits i per tant també hi ha un dèficit de receptors això provocarà que els nivells de trombopoetina en sang siguin més elevats. A partir d'aquí es pot deduir que el nombre de plaquetes serà inversament proporcional als nivells de TPO en sang.[22][18]
Patologies associades
[modifica]Hi ha dos tipus de patologies associades en funció del nombre de plaquetes.
En els casos en què hi hagi un dèficit de plaquetes (menys de 50.000 per microlitre de sang) en l'organisme respecte al nivell normal (des de 150.000 a 450.000 plaquetes per microlitre de sang), les patologies relacionades amb la trombopoetina són les anomenades: trombocitopènies.[23] Una de les causes que provoquen aquesta alteració és la baixa producció medul·lar associada fonamentalment als baixos nivells de trombopoetina. Com a conseqüència hi ha una disminució de megacariòcits, els quals participen en l'hematopoesi limitant-se a la producció de plaquetes en funció de la velocitat determinada per l'hormona. La producció ineficaç de plaquetes en sang és coneguda com a síndrome mielodisplàstica, la qual pot arribar a desenvolupar citopènies.
Alguns exemples són: trombocitopènia primària o secundària (també anomenada Púrpura trombocitopènica), anèmia aplàstica, hepatopatia crònica, etc.
D'altra banda, en aquells casos en què hi ha una proliferació descontrolada de megacariòcits i xifres molt elevades de plaquetes (superiors a 500.000) a la medul·la òssia, les patologies més significatives causades per la trombopoetina i relacionades amb aquesta anomalia reben el nom de síndromes mieloploriferatives. Una d'aquestes és la trombocitèmia essencial originada per mutacions concretes del gen de la TPO que tenen com a conseqüència un augment de la seva concentració, i una altra és la Leucèmia Mieloide Aguda[24] causada per anomalies al cromosoma 3 del gen de la TPO.
Aplicacions terapèutiques
[modifica]Tal com s'ha comentat amb anterioritat, la TPO es tracta d'un factor regulador que determina la mesura final de les cèl·lules, el nombre de plaquetes produïdes i la seva velocitat d'alliberació cap al torrent sanguini. De tal manera que per una banda s'utilitza per a prevenir l'aparició de trombocitopènia després d'alguna quimioteràpia agressiva. D'altra banda, contribueix en la recuperació de trombocitopènies secundàries durant el procés de quimioteràpia mielosupressora[25] (afecta a la reducció del nombre de cèl·lules sanguínies a la sang), i/o mieloablativa (destrucció de qualsevol tipus de cèl·lules canceroses i també medul·la òssia, la qual s'ha de tornar a regenerar).
Altrament, la TPO incrementa la proliferació de progenitors hematopoètics medul·lars, la qual cosa permet el seu trasplantament[26] que s'utilitza per a teràpies contra neoplàsies i alteracions de la funció de la medul·la òssia i facilita la seva recol·lecció en processos d'extracció de medul·la. A més, permet mobilitzar aquestes cèl·lules a la sang perifèrica, la qual cosa redueix el nombre de procediments d'afèresis, ja que aconsegueix un rendiment plaquetari que duplica i inclús quadruplica el nivell normal i facilita la separació dels components de la sang.
També s'utilitza per a l'aplicació de tractaments en malalties del sistema immunitari i en algunes alteracions metabòliques congènites.
Des del punt de vista de la cirurgia, la dosis suplementària de TPO cinc dies abans de les intervencions quirúrgiques programades, pot significar un benefici important pel pacient, ja que, en augmentar el nombre de plaquetes per a la intervenció permet reduir les necessitats transfusionals; cosa que a la llarga comporta menys necessitat de donants de sang.[6]
Investigació
[modifica]Hi ha diversos assajos clínics realitzats per a augmentar el coneixement vers les relacions que estableix la TPO amb altres elements de l'organisme. En concret mecanismes que tenen com a conseqüència la Trombocitèmia o, contràriament, la Trombocitopènia.
1) Es duu a terme una investigació amb una hipòtesi que afirmava que aproximadament un terç de les dones amb càncer d'ovari tenen un recompte de plaquetes anormalment elevat, cosa que va fer pensar als investigadors que la interlucina-6 produïda pel tumor en qüestió estimulava la producció d'algun factor que induïa la producció de plaquetes.
Aquest fet va ser estudiat en els centres més importants de producció i desenvolupament de les cèl·lules sanguínies de ratolins. Quan la hipòtesi va ser considerada com certa, es va dur a terme l'anàlisi de diferents factors coneguts com a promotors de la producció plaquetària en éssers humans, on es va trobar que dos d'ells estaven significativament per sobre del nivell normal: la interleucina-6 i la TPO. La interleucina produïda pel tumor, estimula la producció de TPO en el fetge, que té com a conseqüència la sobreproducció de plaquetes en la medul·la òssia.
Finalment, es van concluir els resultats amb un examen realitzat al teixit hepàtic de pacients amb càncer d'ovari el qual reflectia nivells molt elevats de TPO, mentre que aquelles que presentaven en el seu teixit baixos nivells d'interleucina-6 tenien una esperança de vida superior a les que en tenien nivells alts.[27]
2) Anys enrere es pensava que la Púrpura Trombocitopènica immune es basava únicament en l'augment de la destrucció de plaquetes perifèriques en aquells pacients que presentaven la patologia. Actualment, s'ha descobert que a més de l'augment també hi ha un trastorn en la producció d'aquestes; és per aquest camí cap a on es dirigeixen els nous tractaments, en buscar l'increment de la producció amb l'objectiu d'equilibrar la destrucció i, per consegüent, augmentar el recompte plaquetari.
És per aquest motiu que la introducció dels anàlegs de la TPO ha significat una millora significativa en aquells pacients en els quals la primera opció terapèutica, els esteroides, no té efecte.[28]
Referències
[modifica]- ↑ «Malalties que s'associen genèticament amb Trombopoetina, vegeu/editeu les referències a wikidata».
- ↑ 2,0 2,1 2,2 GRCh38: Ensembl release 89: ENSG00000090534 - Ensembl, May 2017
- ↑ 3,0 3,1 3,2 GRCm38: Ensembl release 89: ENSMUSG00000022847 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ 6,0 6,1 Sans-Sabrafen, J; Besses Raebel, C; Vives Corrons, J.L. Hematología Clínica. 5a edició. Elsevier, 2006. ISBN 978-84-8174-779-9.
- ↑ 7,0 7,1 7,2 7,3 Español, Ignacio; Pujol-Moix «Trombopoyetina: de su descubrimiento a sus perspetivas clínicas». ELSEVIER, 08-04-2000, pàg. 1. Arxivat de l'original el 2016-03-03 [Consulta: 13 octubre 2015]. Arxivat 2016-03-03 a Wayback Machine.
- ↑ «Estructura trombopoetina». [Consulta: 27 octubre 2015].
- ↑ «Native Thrombopoietin: Structure and Function» (en anglès). [Consulta: 13 octubre 2015].
- ↑ «Trombopoyetina (TPO)» (en castellà). Arxivat de l'original el 2016-11-14. [Consulta: 22 octubre 2015].
- ↑ Kuter, DJ «[9704427 Thrombopoietins and thrombopoiesis: a clinical perspective]». Vox sanguinis, Vol 74 (2), 1998, pàg. 75-85.
- ↑ «TPO_HUMAN». [Consulta: 23 octubre 2015].
- ↑ Pavithran, K «Thrombopoietin». Thrombopoietin.
- ↑ Kaushansky, Kenneth «DRUG THERAPY». Thromopoietin, 10-09-1998.
- ↑ Hoffbrand, A.V.; Pettit, J.E.; Vyas, P.. Color Atlas of Clinical Hematology. 4a edició. Mosby Elsevier, 2010. ISBN ISBN 978-0-323-04453-0.
- ↑ González-Villalva, A E «Vías de señalización implicadas en la megacariopoyesis». Gaceta médica de México, 146 nº2, 2-2010, pàg. 136 -143.
- ↑ 17,0 17,1 Hoffbrand, A.V.; Pettit, J.E.; Vyas, P.. Color Atlas of Clinical Hematology. 4a edició. Mosby Elsevier, 2010. ISBN 978-0-323-04453-0.
- ↑ 18,0 18,1 González-Villalva, A E «Vías de señalización implicadas en la megacariopoyesis». Gaceta médica de México, 146 nº2, 2-2010, pàg. 136 -143.
- ↑ Li, J., Xia, Y. and Kuter, D. J. «Interaction of thrombopoietin with the platelet c-mpl receptor in plasma: binding, internalization, stability and pharmacokinetics.». British Journal of Haematology, Vol 106 (2), 1999, pàg. 345–356.
- ↑ 20,0 20,1 Kaushansky, Kenneth «Thrombopoietin: The Primary Regulator of Platelet Production». Blood - The Journal of American Society of Hematology, Vol 82 (2), 7-1995, pàg. 419-31.
- ↑ 21,0 21,1 Kenneth Kaushansky, M.D «Thrombopoietin». N Engl J Med, Vol. 339, 10-09-1998, pàg. 746-754.
- ↑ Kaushansky, Kenneth «The molecular and cellular biology of thrombopoietin: the primary regulator of platelet production». Nature, Vol. 22, 13-05-2002, pàg. Pàg. 3359-3367.
- ↑ «Trombocitopenia» (en espanyol), 24-02-2014. [Consulta: 13 octubre 2015].
- ↑ «Leucemia_mieloide_aguda». [Consulta: 19 desembre 2022].
- ↑ «Glosario de quimioterapia» (en espanyol), 2015. Arxivat de l'original el 16 de desembre 2016. [Consulta: 28 octubre 2015].
- ↑ «El trasplantament de medul·la òssia». Fundació Josep Carreres. Arxivat de l'original el 17 de gener 2016. [Consulta: 28 octubre 2015].
- ↑ Kathryn, L. Hale «Còpia arxivada». Unas investigaciones exploran la relación entre la trombocitosis y el cáncer, 12-2012, pàg. Vol. 57, Nros. 11-12. Arxivat de l'original el 2016-03-06 [Consulta: 27 octubre 2015]. Arxivat 2016-03-06 a Wayback Machine.
- ↑ Análogos de trombopoyetina facilitan el manejo de la PTI, 04-01-2012.[Enllaç no actiu]