Miozin
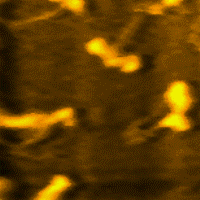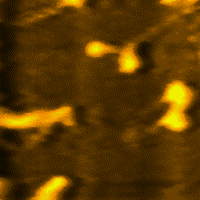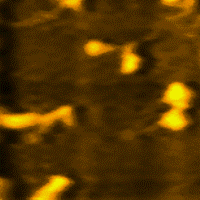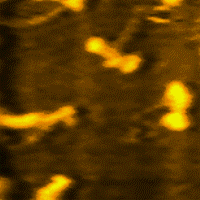
Miozin (grč. μῦς, genitiv μυός - mios = mišić), jedna je od dvije esencijalne bjelančevine u sastavu mišića i mišićnog sistema u cjelini. Uz aktin, omogućava elastičnost i kontrakciju mišića. Čini oko polovine suhe tvari u mišiću.[1][2][3][4][5][6][7]
Miozin je vrlo velika molekula, sa relativnom [[molekulska masa|molekulskom masom od oko 500.000. Sastavljena je od šest polipeptidnih lanaca. Molekule miozina spontano se udružuju u vlaknaste polimerne strukture, koje stvaraju miozinske niti. Grčenje (kontrakcija) mišića počiva na međusobnogom "uklizavanju" debljih miozinskih i tanjih aktinskih niti. Posljedica toga je promjena konformacije miozina, koju pokreće hidroliza adenozin-trifosfata (ATP).
Struktura
[uredi | uredi izvor]

Miozin je ATPaza, odnosno, hidrolizira adenozintrifosfat (ATP) da formira adenozin difosfat (ADP) i Pi, u reakciji mišićne kontrakcije.
Miozin se sastoji od dva identična teška lanca, svaki od po 230 kDa (kilodaltona) i 4 lahka lanca od po 20 kDa. Molekula ima loptasto područje glave, dvostruko vezane za dugu spiralu. Svaka glava spaja dva različita lahka lanca. Svi miozini imaju sekvencu:
– koja je slična sekvenci u aktivnom mjestu drugih ATPaza. Lizin se vezuje za alfa fosfat ATP.
Struktura α-heliksa je neprekidna do repa miozina, čemu pogoduje odsustvo prolina u intervalima od više od 1.000 ostataka i mnogo leucina, alanina i glutamata.
Dio loptastog miozina ima miozin ATPaznu aktivnost i u kombinaciji sa aktinom. Dva lahka lanca su identična (po jedan u svakoj glavi) i mogu se ukloniti bez gubitka ATPazne aktivnosti. Druga dva lahka lanca nisu identični i potrebni su za ATPaznu aktivnost, kao i za vezanje miozina za aktin.
Miozini se mogu razlagati tripsinom u dva fragmenta koji se zovu lahki meromiozin i teški meromiozin.
Vlakna lahkog meromiozina nemaju ATPaznu aktivnost i ne kombiniraju se sa aktinom. To je dvostruko uvijen lanac alfa spirale, dug 850 Ångströma. Teški meromiozin katalizira hidrolizu ATP, veže se za aktin, ali ne gradi vlakna i ne generira snagu za mišićne kontrakcije. Sastoji se od kratkog štapića, u prilogu dva loptasta domena, koji su glave miozina. Teški meromiozin se cijepa papainom u dva štapićasta subfragmenta, pod nazivom S2. Svaki fragment ima mjesta S1, sa ATPaznom aktivnosti i sposobnost vezivanja za aktin. Svaki miofibril se sastoji od više miofilamenata koji su tanje ili deblje niti, koje se sastoje od dva posebna proteina, aktin i miozin. U miofilamentima, miofibrili ne pokrivaju puni obim mišićnih vlakana, već su podijeljeni u pregrade zvane sarkomere.
Grupiranje tankih aktinskih miofilamenata stvara svijetlije poprečne pruge, dok grupe miozinskih miofibrila formiraju tamnije. Prvi su poznati kao I trake, a drugi kao A trake. Ovi bendovi su naizmenični. I i A trake zajedno se nazivaju sarkomera. Osim tanjih miofilamenata aktin, postoje i dvije druge molekule proteina: tropomiozin i troponin, koji su su uključeni u reguliranje kontrakcije mišića.
Sarkomera A je odvojena od drugih, uskim područjima gustog materijala koji su označeni kao linije Z. Tanke niti su fiksne u Z linijama i projiciraju se u oba smjera. Osim toga, aktin, u tankim miofilamentima sadrži dva proteina i mjesta miozinskih receptora. Svaki miozinski filament ima male projekcije pod nazivom mostovi, koji u interakciji s aktinskim vlaknima izazvaju kontrakcije.
Debeli miofilamenti se međusobno dodiruju sa slobodnim krajevima tankih miofilamenata, zauzimajući A bend i sarkomeru. U sredini ove trake se vidi zona H. Molekule miozina koje ga čine imaju zone koje se mogu vezati za aktin i druge molekule, AV pokretima aktinskog filamenta F.[8]
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Međedović S., Maslić E., Hadžiselimović R. (2000): Biologija 2. Svjetlost, Sarajevo, ISBN 9958-10-222-6.
- ^ Warrell D. A., Cox T. M., Firth J. D. (2010): The Oxford Textbook of Medicine Arhivirano 21. 3. 2012. na Wayback Machine (5th ed.). Oxford University Press
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
- ^ Sofradžija A., Šoljan D., Hadžiselimović R. (1996): Biologija 1, Svjetlost, Sarajevo, ISBN 9958-10-686-8.
- ^ Hadžiselimović R. (2005): Bioantropologija – Biodiverzitet recentnog čovjeka. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-2-6.
- ^ Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 978-9958-9344-8-3.
- ^ Hadžiselimović R., Pojskić N. (2005): Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-3-4.
- ^ Walker M. L. , Burgess S. A. , Sellers J. R., Wang F., Hammer III J.A., Trinick J., Peter J. Knight P. J. (200): Two-headed binding of a processive myosin to F-actin. Nature, 405, 804-807. http://www.fbs.leeds.ac.uk/research/contractility/myosinv/index.htm
Vanjski linkovi
[uredi | uredi izvor]- http://www.mechanobio.info/modules/go-0003774#2_go-0003774 Arhivirano 4. 3. 2016. na Wayback Machine MBInfo – Myosin Isoforms]
- http://www.mechanobio.info/modules/go-0008570#2_go-0008570 Arhivirano 15. 4. 2016. na Wayback Machine MBInfo – The Myosin Powerstroke]
- http://www.banyantree.org/jsale/actinmyosin/index.html Myosin Video] A video of a moving myosin motor protein.
- Myosins na US National Library of Medicine Medical Subject Headings (MeSH)
- https://wayback.archive-it.org/all/20090924163125/http://www.mrc-lmb.cam.ac.uk/myosin/myosin.html The Myosin Homepage]
- http://cellimages.ascb.org/cdm4/item_viewer.php?CISOROOT=/p4041coll12&CISOPTR=101&CISOBOX=1&REC=2[mrtav link]</nowiki>Animation of a moving myosin motor protein
- http://www.pdbe.org/emsearch/myosin* 3D macromolecular structures of myosin from the EM Data Bank(EMDB)]


