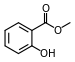
Ester

Esteri (njem. Essig-Äther što je stari naziv za etil-etanoat) su organske tvari u kojima organska grupa, u hidroksilnoj grupi mijenja jedan ili više atoma vodika. Njihova hidroksilna grupa reagira sa karboksilnom grupom pa nastaje nova grupa koja se naziva esterska -COO-.
Najpoznatiji esteri su karboksilni esteri, ali postoje i esteri alkohola i anorganskih kiselina. Jedan od najpoznatijih iz te kategorije je nitroglicerin, koji se dobija reakcijom trovalentnog alkohola glicerola i dušične kiseline, uz prisustvo sumporne kiseline.[1][2][3]
Opća formula estera koji su nastali hemijskom reakcijom s karboksilnim kiselinama je RCOOR’.
Pregled
[uredi | uredi izvor]Estri su organski spojevi koji nastaju reakcijom kiselina i alkohola uz izdvajanje vode (esterifikacija). Primjrerice, reakcijom između sirćetne kiseline i etanola nastaje etilni ester sirćetne kiseline ili etil-acetat:
- CH3COOH + C2H5OH → CH3COOC2H5 + H2O,
a između sumporne kiseline i etanola nastaje etilni ester sumporne kiseline ili dietil-sulfat: - H2SO4 + 2C2H5OH → (C2H5O)2SO2 + 2H2O.
Suprotna reakcija esterifikaciji, u kojoj se estri razlažu na kiselinu i alkohol uz prijem vode, je hidroliza estera ili saponifikacija. Estri su obično hlapljive tekućine ili lahko topive čvrste tvari, koje se ne otapaju u vodi, ali su topive u alkoholu i eteru. Mnogi senalaze u prirodi, osobito u voću.
Od estera anorganskih kiselina, značajni su estri dušične kiseline i sumporne kiseline, nitrati, sulfati (deterdženti) i fosfati (maziva, omekšivači).
Imenovanje
[uredi | uredi izvor]Imenovanje estera se bazira na nazivu alkohola koji je stupio u reakciju tj. prvo ide naziv alkilne skupine alkohola (npr. naziv alkilne skupine propanola je propil). Drugim riječima, umjesto uobičajenog završetka -anol na osnovu imena alkohola doda se nastavak -il. Druga riječ u nazivu estera potiče od kiseline, a tvori se tako da se imenu kiseline oduzme nastavak -ska i doda nastavak -oat (npr., druga riječ u imenu estera butanske kiseline bila bi butanoat). Kod estera sa etanskom kiselinom, često se umjesto etanoata upotrebljava: acetat, kod onih sa metanskom kiselinom: formijat, kod estera sa butanskom kiselinom: butirat, a kod propanske kiseline: propionat. Kod alkohola također postoje drugi nazivi pa se tako umjesto pentil, često nađe i amil:
- alkohol (-ol → -il) + karboksilne kiseline (-ska → -oat)
IUPAC-ova nomenklatura
[uredi | uredi izvor]Esterska imena izvedena su iz naziva matičnog alkohola i roditeljske kiseline, gdje ova može biti organska ili anorganska. Esteri izveden iz najjednostavnijih karboksilnih kiselina se obično zove prema tradicijskim, takozvanim "trivijalnim nazivima" npr. kao format, acetat, propionat, i butirat, za razliku od IUPAC-ove nomenklature: metanoat, etanoat, propanoat i butanoat. Estri izvedeni iz kompleksnijihh karboksilnih kiselina su, s druge strane, češće pod nazivom koji koristi sistematski naziv po IUPAC-u, na osnovu imena za kiselinu zatim dolazi sufiks –oat. Naprimjer, ester-heksiloktanoat, poznat i pod trivijalnim imenom heksil-kaprilat, ima formulu CH3(CH2)6CO2(CH2)5CH3.

Hemijske formule organskih estera obično imaju oblik RCO2R ', gdje su R i R' dijelovi ugljikovodika iz karboksilne kiseline i alkohola. Naprimjer, butil-acetat (sistematski butila-etanoat), izveden iz butanola i acetatne kiseline (sistematski etanska kiselina) se piše kao CH3CO2C4H9. Alternativno prikazivanje obično uključuje BuOAc i CH3COOC4H9. Ciklični estri se zovu laktoni, bez obzira na to da li su izvedeni iz organske ili anorganske kiseline. Jedan primjer (organskog) laktona je γ-valerolakton.
Ortoestri
[uredi | uredi izvor]Neuobičajena klasa organskih estera su ortoesteri, koji imaju formulu RC(OR′)3. Trietilortoformat (HC(OC2H5)3) je izvedenica, u smislu imena (ali ne i sinteze) iz ortomravlje kiseline (HC (OH)3) i etanola.
Neorganski estri
[uredi | uredi izvor]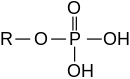
Esteri mogu također biti izvedeni iz neorganskih kiselina i alkohola. Dakle, nomenklatura se proteže na neorganske oksokiseline i njihove odgovarajuće estre: fosforna kiselina i ester-fosfat/organofosfatnimi, sumporna kiselina i sulfat-ester/organosulfati, dušična kiselina i nitrat, borna kiselina i borati. Naprimjer, trifenil-fosfat je ester izveden iz fosforne kiseline i fenola. Organski karbonati su izvedeni iz ugljične kiseline; naprimjer, etilen-karbonat je izvedena iz ugljične kiseline i etilen-glikola.
Alkohol i neorganska kiselina povezivani su preko atoma kisika. Definicija estera neorganske kiseline koji imaju vezu neorganskih hemijskih elemenata između alkohola i anorganske kiseline – vezanje atoma fosfor i tri alkoksi funkcijske grupe u organofosfatima – može se proširiti na iste elemente u raznim kombinacijama kovalentne veze između ugljikovih i centralnog neorganskog atom i vezi ugljik-kisik, sa centralnim anorganski atomima. Naprimjer, fosforna svojstva "tri' veze ugljik-kisik-fosfor i jenu dvostruku vezu fosfor-kisik u organofosfatima,

tri veze ugljik–kisik–fosfor i nijednu dvostruku vezu fosfor–kisik u fosfit-esterima ili organofosfitima,

dvije veze ugljik–kisik–fosfot bondings, nijedna fosfor–kisik dvostruka veza, ali jedna veza fosfor–ugljik u fosfonitima,

jedna veza ugljik–kisik–fosfor, nijedna dvostruka veza fosfor–kisik, ali dvije veze fosfor–ugljik u fosfonitima.

Kao posljedica, funkcije bora je stvaranje bor-estera (n = 2), bor-estera (n = 1) i borata (n = 0). Kisik je hemijski element grupe 16 , a atomi sumpora mogu zamijeniti neke atome kisika u ugljik–kisik–centralni neorganski atom kovalentnih veza estera. Kao rezultat, stvaraju se tiosulfinati i tiosulfonati, sa centralnin neorganskim atomom sumpora, jasno pokazujući asortiman sumpornih estera, koji uključuju i sulfatne, sulfitne, sulfonatne, sulfinatne i sulfenatne estere.
Triacilglicerol
[uredi | uredi izvor]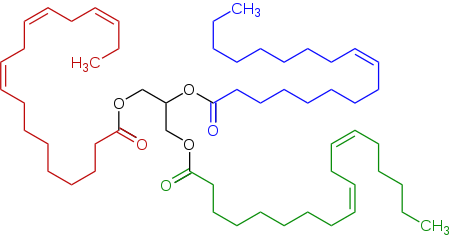
Triacilgliceroli (masti i ulja) su estri koji sadrže tri hidroksilne skupine. Imenuju se slično kao i soli. Netopivi su ili slabo topivi u vodi (lipidi).
Estri se mogu dobiti reakcijom, obično organskih, kiselina i alkohola, uz katalitsko prisutvo sumporne kiseline, iako ima i drugih načina dobivanja estera. Esterifikacija je reverzibilna reakcija u kojoj se istovremeno događa i hidroliza, pa je potrebno higroskopno sredstvo koje reakciji oduzima vodu.
- Alkoholi + karboksilne kiseline ↔ ester + voda (esterifikacija)
- Ester + voda ↔ alkoholi + karboksilne kiseline (hidroliza)
Mnogi estri imaju specifičan miris, zbog čega se većinom kao umjetne arome i u proizvodnji mirisa. Primjerice:
- metil butanoat – ananas, jabuka;
- metil benzoat – voćni miris ylang-ylang;
- etil formijat – rum;
- etil butanoat – ananas, jagoda;
- etil heptanoat – grožđe;
- etil acetat - staro vino;
- amil acetat - banana, kruška.
Metil formijat
[uredi | uredi izvor]Metil metanoat je bezbojna tekućina karakterističnog eterskim mirisom, lako ispariva, sa malom površinskom napetosti.
C2H4O2O=COC
Etil acetat / etil etanoat
[uredi | uredi izvor]Ovo je bezbojna, lahko zapaljiva tekućina karakterističnog mirisa poput ljepila ili sredstava za skidanje laka za nokte.
- C4H8O2
CC(=O)OCC CH3COOCH2CH3
Etil acetat je zapaljiv i kožni iritant.
Dobijanje estera
[uredi | uredi izvor]Esteri se dobijaju pri sintezi sirćetne kiseline i etanola, uz prisutstvom jakih kiselina kao što je sumporna kiselina. CH3CH2OH + CH3COOH → CH3COOCH2CH3 + H2O
Dobijaju se i:
- esterifikacijom metanola i etanoata:
HCOOH + CH3OH → HCOOCH3 + H2O
- industrijski − kombinacijom metanola i ugljikovog monoksida:
CH3OH + CO → HCOOCH3.
Izvori
[uredi | uredi izvor]Prirodni estri su:
Upotreba
[uredi | uredi izvor]Koristi se:
- kao otrov za ubijanje insekata (za prepariranje u entomologiji: insekt ubije, ali se ne uništi)
- u ljepilima i odstranjivačima laka za nokte
- kao reagens za određivanje angiotenzin konvertirajućeg enzima (ACE)
Estri se obično upotrebljavaju i u:
- prehrambenoj i konditorskoj industriji,
- proizvodnji otapala i plastičnih masa,
- proizvodnju parfema.
Upotrebljava se i kao insekticid i u proizvodnji nekih lijekova.
Esterski mirisi
[uredi | uredi izvor]Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger Principles of Biochemistry. W. H. Freeman and Co., ISBN 978-1-4641-0962-1.
- ^ Hall J. E., Guyton A. C. (2006): Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo, ISBN 0-7216-0240-1.
Vanjski linkovi
[uredi | uredi izvor]- Ester na chemguide.co.uk
- Etil acetat