Fosfat
| Fosfat | |
|---|---|
 | |
| Təsnifatı | |
| ChEBI | 26020 |
Fosfat turşusu () — qeyri-üzvi, kimyəvi və fosforlu turşudur. Fosfat turşusu və fosfat biokimya və ekologiya üçün cox mühimdir. Fosfat kənd təsərrüfatı və sənaye üçün çox əhəmiyyətli kimyəvi məhsuldur. Fosfat bərk şəraitli yüksək temperaturda firofosfatdan (Xörək duzu) da kondensasiya oluna bilər.
Bütün hüceyrələri zülal olan fosfalar əlavə və aradan qaldırılması metabolik olan proseslərin tənzimləməsində əsas strategiyadır. Fosforlaşma və defosforlaşmanın enerji saxlanmasında və yaşayış sistemlərinin azad olunmasında əhəmiyyətli yolları var.
Fosfat və ya ortofosfat ionu PO4 −3 üç protonun H+çıxarılması ilə fosfor turşusundan əmələ gəlir. Bir və ya iki protonun çıxarılması, sırasıyla dihidrogen fosfat ionu H2PO4− və hidrogen fosfat ionu HPO4−2 ionunu verir. Bu adlar ammonium dihidrogen fosfat və trisodium fosfat kimi anionların duzları üçün də istifadə olunur.
Üzvi kimyada fosfat və ya ortofosfat bir orqanofosfattır, PO şəklində ortofosfor turşusunun mürəkkəb efiridir. 4RR'R ″ burada bir və ya daha çox hidrogen atomu üzvi qruplarla əvəz olunur. Bir nümunə trimetil fosfattır (CH3)3PO4. Bu termin eyni zamanda üç dəyərli funksional qrupa aiddir və OP(O-)3 belə mürəkkəb efirlərdəndir.
Ortofosfatlar, biokimya, biogeokimya və ekologiyadakı əsas rolları və kənd təsərrüfatı və sənaye üçün iqtisadi əhəmiyyətlərinə görə müxtəlif fosfatlar arasında xüsusilə əhəmiyyətlidir. Fosfat qruplarının əlavə edilməsi və çıxarılması (fosforilləşmə və fosforlaşma) hüceyrə metabolizmasında əsas addımlardır.
Ortofosfatlar kondensasiya olunaraq pirofosfatlar əmələ gətirirlər.
Kimyəvi xüsusiyyətləri
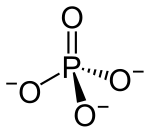
[redaktə | mənbəni redaktə et]Fosfat ionu 94,97 g/mol molyar kütləyə malikdir və tetrahedral bir quruluşda dörd oksigen atomu ilə əhatə olunmuş mərkəzi fosfor atomundan ibarətdir. Hidrogen fosfat ionu HPO4 −2-nin qosulmuş əsasıdır və bu da dihidrogen fosfat ionu H2PO4--nin qoşulmuş əsasıdır, oda öz növbəsində ortofosfor turşusu H3PO4-nun qoşulmuş əsasıdır.

Bir çox fosfatlar standart temperaturda və təzyiqdə suda həll olur. Natrium, kalium, rubidium, sezium və ammonium fosfatlar hamısı suda həll olur. Digər fosfatlar çox az miqdarda həll olunur və ya suda həll olunmur. Bir qayda olaraq, hidrogen və dihidrogen fosfatlar müvafiq fosfatlarla müqayisədə bir qədər daha həll olur.
Məhlulda tarazlığı
[redaktə | mənbəni redaktə et]Su məhlulunda ortofosfat turşusu və onun üç törəmə anionu aşağıdakı dissosasiya və rekombinasiya tarazlıqlarına uyğun olaraq birlikdə mövcuddur.
| Tarazlıq | Dissosasiya sabiti ― Ka[1] | pKa |
|---|---|---|
| H3PO4 ⇌ H2PO4−+ H+ | Ka1 = [ H+ ] [ H2PO4 ] / [ H3PO4 ] ≈ 7.5 × 10−3 | pKa1 = 2.14 |
| H2PO4− ⇌ HPO4−2 + H+ | Ka2 = [ H+ ] [ HPO4−2 ] / [ H2PO4− ] ≈ 6.2 × 10−8 | pKa2 = 7.20 |
| HPO4−2 ⇌ PO4−3 + H+ | Ka3 = [ H+] [ PO4−3 ] / [ HPO4−2] ≈ 2.14 × 10−13 | pKa3 = 12.37 |
Datalar 25 °C və 0 ion gücündə hesablanıb[1].
İstinadlar
[redaktə | mənbəni redaktə et]- ↑ 1 2 Kipton J. Powell, Paul L. Brown, Robert H. Byrne, Tamás Gajda, Glenn Hefter, Staffan Sjöberg, Hans Wanner (2005): "Chemical speciation of environmentally significant heavy metals with inorganic ligands. Part 1: The Şablon:Chem, Cl−, OH−, Şablon:Chem, Şablon:Chem, and Şablon:Chem aqueous systems". Pure and Applied Chemistry, volume 77, issue 4, pages 739–800. DOI:10.1351/pac200577040739

